“四氧化三铅组成的测定”实验方法的改进研究
2017-09-15温志国孙国峰
温志国,张 颖,孙国峰,※,廖 娜
(1.乐山师范学院 化学学院,四川 乐山 614000;2.西南大学 化学化工学院,重庆 北碚 400715)
“四氧化三铅组成的测定”实验方法的改进研究
温志国1,张 颖1,孙国峰1,※,廖 娜2
(1.乐山师范学院 化学学院,四川 乐山 614000;2.西南大学 化学化工学院,重庆 北碚 400715)
根据教材中的方法,四氧化三铅组成测定实验常常得不到准确的数据。文章通过对实验过程中溶液pH值变化的研究,对教材中“四氧化三铅组成的测定”实验进行了改进。在测定PbO含量时采用缓冲溶液控制溶液的pH值,避免了浑浊现象的产生;测定PbO2含量时加入20mL 0.05mol/L的EDTA消除了PbI2对滴定终点的影响。改进后的实验操作简单,易观察,实验结果更准确。
无机化学实验;实验改进;四氧化三铅组成
“四氧化三铅组成的测定”是由北京师范大学无机化学教研室等编写的《无机化学实验》第三版中的综合实验,目的是测Pb3O4中PbO和PbO2的摩尔比和样品中Pb3O4的质量分数[1-2]。其原理是先用稍过量的硝酸溶解Pb3O4得到硝酸铅和二氧化铅,再分别用络合滴定法和间接碘量法测定二价铅和四价铅的含量,方程式如式(1)~(3)。
络合滴定法测定二价铅:
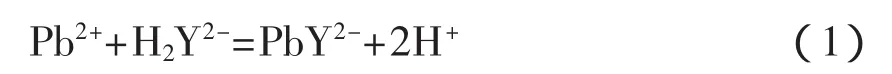
间接碘量法测定四价铅:
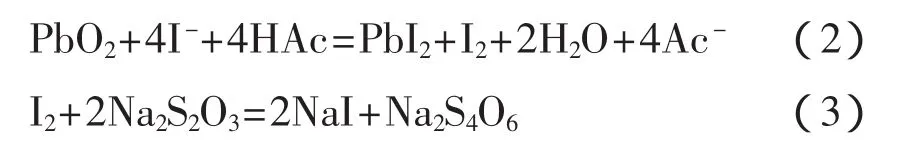
根据教材的实验步骤进行实际操作,主要存在以下几个问题[3-4]:
(1)乙二胺四乙酸二钠(EDTA)和硫代硫酸钠(Na2S2O3)浓度过低。
(2)PbO含量测定时,要求滴加1∶1的氨水使溶液由黄色变为橙色。但是黄色和橙色颜色接近,颜色变化不易判断,而且在调节pH值过程中容易产生白色沉淀。操作比较复杂。
(3)PbO2含量测定时,要求在溶液呈淡黄色时加入淀粉溶液,再滴加Na2S2O3至无色为终点。但是根据教材所述操作,溶液中会产生大量PbI2黄色沉淀,影响学生对终点的判断,常在滴定达到终点后才加入淀粉溶液,导致实验失败。
高仁全等通过计算和实验确定了所用EDTA标准溶液和Na2S2O3标准溶液的浓度应在 0.04~0.10mol·L-1之间[3]。它虽然确定了 1∶1氨水的用量,提出淀粉需提前加入,但仍无法解决黄色和橙色的辨别、白色浑浊现象的产生以及碘化铅沉淀影响终点判断的问题。
童吉灶等研究了不同浓度HAc-NaAc缓冲溶液和EDTA溶液对去除PbI2沉淀影响的效果,提出用30mL 0.5mol·L-1HAc-NaAc缓冲溶液或20mL 0.05mol·L-1EDTA溶液可以消除PbI2对终点的干扰[4]。但在实际操作中发现这两种方法仍然不能彻底消除PbI2对实验结果的影响。
本文在前人研究的基础上,通过研究实验过程中溶液的pH值变化,对实验方法进行了改进研究,省去了加入氨水时辨别黄色变橙色的步骤,避免了影响观察的白色沉淀的生成,并且在四价铅测定过程中消除了PbI2沉淀对终点观察的影响。采用改进后的方法进行实验,操作简单,现象也更加明显而容易观察,数据更准确。
1 实验部分
1.1 实验仪器及药品
仪器:雷磁PHS-3c酸度计,电子分析天平,容量瓶,酸式滴定管(50mL),碱式滴定管(50mL),移液管,烧杯,锥形瓶(250mL),量筒,恒温干燥箱,棕色试剂瓶,滴管,吸滤瓶,洗瓶。
固体药品:四氧化三铅(Pb3O4,A.R)、碘化钾(KI,A.R)。
液体药品:6mol/L HNO3溶液,二甲酚橙指示剂,氨水(1∶1),20% 六亚甲基四胺((CH2)6N4)溶液,(CH2)6N4-HCl缓冲溶液 (pH=5.46),0.5mol·L-1HAc-NaAc缓冲溶液,HAc-NaAc缓冲溶液(pH=5.46),EDTA 标准溶液(0.049 95mol·L-1),Na2S2O3标准溶液(0.049 95mol·L-1)。
1.2 四氧化三铅组成测定实验改进
1.2.1 四氧化三铅的分解
准确称取0.5 g干燥Pb3O4于50mL烧杯中,加入2mL 6mol/L HNO3溶液,搅拌至红色固体变为棕黑色固体。抽滤,用蒸馏水少量多次洗涤固体残渣,合并滤液。保留滤液及固体[1]。
1.2.2 PbO含量的测定改进研究
根据文献[1]实验方法:将滤液转入锥形瓶,加入几滴二甲酚橙,然后逐滴加入1∶1的氨水,使溶液由黄变橙,加入20%(CH2)6N4溶液呈稳定的紫红色,再过量5mL,此时溶液的pH值为5~6。用EDTA滴定溶液至亮黄色时,即为滴定终点,记录消耗EDTA的体积。
以二甲酚橙为指示剂,EDTA滴定Pb2+需在弱酸性条件(pH=5~6)下进行[1,5]。在实验过程中加入的氨水和20% (CH2)6N4溶液均为碱性,容易过量导致溶液产生白色浑浊影响观察颜色变化。
为了简化操作便于观察,对实验方法改进如下:在滤液中加入二甲酚橙指示剂后,不加氨水,直接加入pH=5.46的缓冲溶液,观察到溶液颜色由黄色变橙色,最后变成稳定的紫红色后,再加入7~9mL过量的缓冲溶液(总用量11~12mL左右),再用EDTA标准溶液滴定。
1.2.3 PbO2含量的测定改进研究
根据文献[1]实验方法:将1.2.1中得到的黑色固体同滤纸一起转入碘量瓶中,加入30mL HAc-NaAc(1∶1) 混合液和 0.8 g 的固体KI,摇动锥形瓶使黑色固体溶解,溶液呈深棕色。用Na2S2O3标准溶液滴定至溶液呈淡黄色时加入1mL淀粉溶液,继续滴定至蓝色刚好褪去即为滴定终点,记录消耗Na2S2O3的体积。
经过实际操作,只加入30mL 0.5mol·L-1HAc-NaAc缓冲溶液无法消除PbI2对终点的干扰。而用20mL 0.05mol·L-1EDTA溶液代替30mL 0.5mol·L-1HAc-NaAc 缓冲溶液,虽然可以消除PbI2沉淀,但消耗Na2S2O3的体积远小于理论值。其原因在于,随着Na2S2O3的滴入,溶液呈碱性,大部分I2发生歧化反应生成了碘酸根和碘离子。
因此为了消除PbI2对终点的干扰并保持溶液的弱酸性,对实验方法进行了以下改进:在加入30mL HAc-NaAc缓冲溶液和KI固体溶解PbO2后,再加入20mL EDTA溶液或30mL HAc-NaAc缓冲溶液以消除PbI2对终点颜色的干扰。
2 实验结果与讨论
2.1 PbO含量测定实验方法改进
根据文献[1]的实验方法,得到的实验结果见表1。

表1 PbO含量测定实验结果
由表1可见:(CH2)6N4过量5mL后溶液的pH值很接近6。在实验过程中发现,在加入(CH2)6N4使溶液变紫的过程中由于pH值接近6,铅离子浓度较高,使得浓度积Jc=[Pb2+][OH-]2>Ksp(Pb(OH)2),从而产生 白色沉淀Pb(OH)2。
对实验方法进行改进后,溶液由黄色到紫色颜色变化明显,过程无沉淀产生。实验结果见表2和表3。

表2 不加氨水,直接加pH=5.46的 (CH2)6N4-HCl缓冲溶液

表3 不加氨水,直接加pH=5.46的HAc-NaAc缓冲溶液
由表2和表3可见:方法改进后可使溶液在滴定前的pH略大于5,浓度积Jc=[Pb2+][OH-]2<Ksp(Pb(OH)2),因此不产生沉淀。改进后的实验误差与教材方法相比较小。
由表1可见,加入氨水使溶液变橙色后,溶液表现为酸性(pH=2.4~2.6),随后加入的(CH2)6N4与溶液中的酸形成缓冲溶液,由于用量控制不够精确,使得溶液的pH值偏高。而改进实验方法后,因为加入的是配制好的pH=5.46的缓冲溶液,与溶液中过量的酸作用后,溶液的pH值不会超过5.46,而且通过控制缓冲溶液的用量可以使溶液的pH略大于5。
综上,改进后的实验方法,既可以省略滴加氨水的步骤,也可以很好地控制溶液的pH值,不会出现白色沉淀,操作简便,现象也更易观察。
2.2 PbO2含量测定改进实验结果
根据文献[4]所述,加入黑色固体和滤纸后,加 20mL 0.05mol·L-1EDTA和 0.8 g的KI,可以将PbI2络合溶解。在实际操作中测得此时溶液的pH值在8左右,而I2在碱性水溶液中会发生歧化反应[5]:
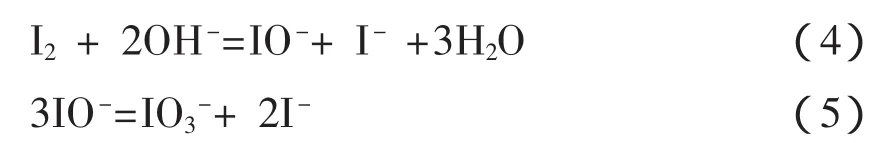
因此溶液中的I2大量减少,Na2S2O3的消耗量远低于理论值。
为了避免歧化反应的发生,在消除PbI2的同时必须保证溶液的弱酸性环境。
根据1.2.3所述,改进后的实验结果见表4和表5。
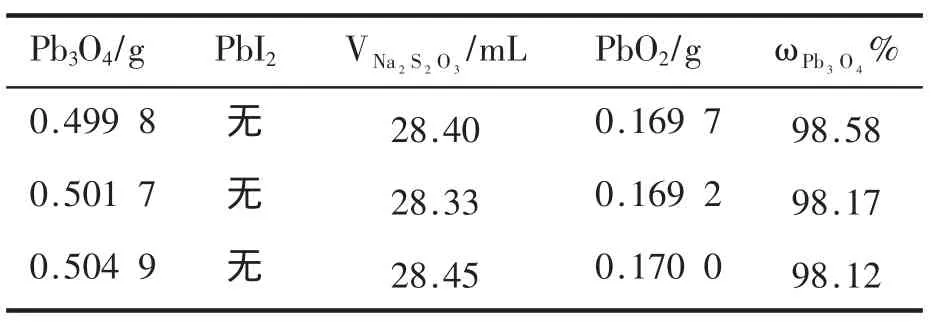
表4 加入20mL 0.05mol·L-1EDTA溶液
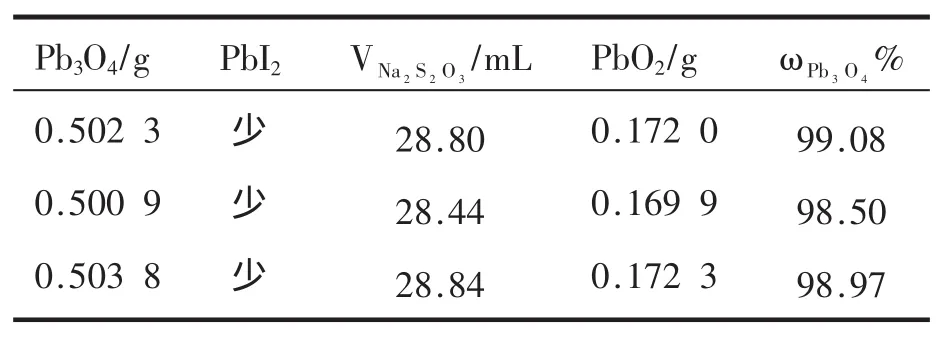
表5 加入过量30mL的0.5mol·L-1HAc-NaAc缓冲溶液
由表4、表5可见,EDTA溶液消除PbI2的效果好于HAc-NaAc缓冲溶液,且两种方法都不会影响实验结果。
在锥形瓶中加入黑色固体和滤纸后,加30mL 0.5mol·L-1HAc-NaAc缓冲溶液和 0.8 g的KI,为PbO2氧化I-提供了稳定的酸性条件。氧化反应只消耗了0.003 moL左右的HAc,对缓冲溶液的缓冲能力影响不大。黑色固体溶解PbI2随之大量产生后,加入额外的EDTA溶液和HAc-NaAc缓冲溶液则起到了溶解PbI2沉淀的作用,原理见式(6)和式(7)。

2.3 改进后的实验结果
根据前述实验结果,改进后的实验方法如下:
1)按文献[1]分解四氧化三铅并进行固液分离。
2)PbO含量测定:在滤液中加入3滴二甲酚橙指示剂,再逐滴加入pH=5.46的HAc-NaAc缓冲溶液,溶液变紫红色后再过量7-9mL,使溶液 pH=5~6。用 0.05mol/L的 EDTA标准溶液滴定至亮黄色时,即为滴定终点,记录消耗EDTA的体积。
3)PbO2含量测定:将黑色固体同滤纸一起转入碘量瓶中,加入30mL 0.5mol·L-1HAc-NaAc缓冲溶液和0.8 g的KI,振摇使黑色固体溶解得到棕色溶液和黄色沉淀,再加入20mL 0.05mol/L的EDTA溶液使黄色沉淀溶解,滴定过程按照文献[1]实验步骤进行。
改进后的实验结果见表6。

表6 改进后Pb3O4组成的测定的实验结果
由表6可见,改进后的三次实验,结果都在实验要求范围内:PbO/PbO2<2±0.05,Pb3O4的质量分数大于95%[1],且实验操作更简便。
3 结论
本文通过对实验关键步骤的溶液pH值的检测,改进了教材中的实验方法:(1)在PbO含量测定中,不加氨水,只用pH=5.46的HAc-NaAc缓冲溶液调节溶液的pH值为5,颜色由黄色变紫色,现象更容易观察;(2)在PbO2含量测定中,加入30mL 0.5mol·L-1HAc-NaAc缓冲溶液和0.8 g的KI溶解PbO2后,再加入0.05mol/L的EDTA溶液以消除PbI2沉淀对判断滴定终点的影响。改进以后的方法简化了操作,减少了需要准备的试剂种类,实验结果也更准确,同时也减轻了实验员的准备工作。
[1]北京师范大学无机化学教研室,等.无机化学实验[M].3版.北京:高等教育出版社,2001:223-224.
[2]陈文兴,钱宇,罗宿星,等.四氧化三铅组分的测定微型化学实验探索[J].内蒙古民族大学学报,2009,15(4):130-132.
[3]高仁金,郭巧萍.四氧化三铅组成的测定实验改进研究[J].实验科学与技术,2013,11(6):240-242.
[4]童吉灶,王钊.四氧化三铅组成的测定方法研究[J].上饶师范学院学报,2007,27(6):31-34.
[5]武汉大学.分析化学[M].5版.北京:高等教育出版社,2006:190.
Research for Method Improvement of the Composition Determination of the Lead Tetraoxide
WEN Zhiɡuo1,ZHANG Yinɡ1,SUN Guofenɡ1,LIAO Nɑ2
(1.School of Chemistry,Leshan Normal University,Leshan Sichuan 614000;2.School of Chemistry and Chemical Engineering,Southwestern University,Beibei Chongqing 400715,China)
According to the method in the textbook,the experiment of composition determination of lead tetraoxide often fails to obtain accurate data.Through the study of the change of pH value in the experiment process,the experiment of“determination of the composition of lead tetraoxide”shown in textbook was improved.During the determination process of the content of PbO,the buffer solution was added to control the pH value of the solution to avoid the turbidity.The extra addition of 20mL 0.05mol/L-1 EDTA solution added into the determination process of the content of PbO2 eliminated the influence of PbI2 to titration end-point.Meanwhile,the improved experiment makes the experiment more easily be operated and observed with more accurate results.
Experiment of Inorganic Chemistry;Experiment Improvement;Composition of Lead Tetroxide
O6-3
A
1009-8666(2017)08-0020-05
[责任编辑、校对:李书华]
10.16069/j.cnki.51-1610/g4.2017.08.005
2017-05-20
乐山师范学院科研项目“非异氰酸酯聚氨酯药物释放材料的制备”(Z1306);乐山师范学院教育教学改革项目“《无机化学实验》教学方法改革与实践”(JG14-ZF05)和“高中新课改理念下高中—大学贯通式化学人才培养新模式的研究与实践”(JG14-YB16)
温志国(1983—),男,福建永定人。乐山师范学院化学学院副教授,博士,研究方向:功能高分子材料和无机实验教改;孙国峰(1975—),男,山西襄汾人。乐山师范学院化学学院副教授,博士,研究方向:有机化学教学和有机合成。
