胆汁酸受体FXR和TGR5在溃疡性结肠炎中的表达
2017-09-15程文芳露南京医科大学附属江宁医院消化科000南京医科大学附属江苏省人民医院消化科
魏 敏 程文芳 平 晶 夏 露南京医科大学附属江宁医院消化科(000) 南京医科大学附属江苏省人民医院消化科
胆汁酸受体FXR和TGR5在溃疡性结肠炎中的表达
魏 敏1程文芳2*平 晶1夏 露1
南京医科大学附属江宁医院消化科1(211000) 南京医科大学附属江苏省人民医院消化科2
背景:发达国家溃疡性结肠炎(UC)的发病率高于发展中国家,可能与西化的生活方式有关,特别是高动物蛋白和低复杂碳水化合物的饮食习惯。随着高脂肪、高肉类摄入的增加,肝脏合成和分泌的胆汁酸相应增加,可能对UC的发生产生影响。目的:观察法尼醇X受体(FXR)、G蛋白偶联胆汁酸受体5(TGR5)在UC中的表达。方法:选取2013年1月—2016年6月南京医科大学附属江宁医院30例活动期UC患者,以30名健康者作为对照。采用免疫组化法检测结肠黏膜中FXR和TGR5表达。结果:与对照组相比,UC组FXR表达显著降低(4.63±2.07对6.91±2.62,P=0.00),TGR5表达无明显差异(6.70±2.90对6.11±2.44,P=0.40)。右半结肠炎患者的FXR表达显著高于左半结肠炎患者(P<0.05)。结论:UC患者结肠黏膜FXR表达明显减少,在UC发病中可能起一定的作用,而TGR5在UC发病中可能无明显作用。
TGR5; FXR; 结肠炎, 溃疡性; 免疫组织化学
溃疡性结肠炎(UC)是一种病因尚不清楚的慢性反复发作性的肠道非特异性炎症。基于人口的流行病学研究显示,UC的患病率以北美、北欧最高,亚洲较低;欧洲和北美的患病率为192/106~243/106,而我国基于多家医院病例统计结果推测,UC的患病率约为11.6/106[1-2]。UC发病率和患病率的地域差异可能与西化的生活方式有关,特别是高动物蛋白和低复杂碳水化合物的饮食习惯。近年研究已证实胆汁酸与肠道疾病有一定关系,如肠道胆汁酸暴露增加可影响肠易激综合征(IBS)患者的排便习惯和肠道转运时间[3]。胆汁酸在胃肠道中主要通过两个受体影响其功能,分别为法尼醇X受体(farnesoid X receptor, FXR)和G蛋白偶联胆汁酸受体5(G protein-coupled bile acid receptor 5, TGR5)。本研究通过检测UC患者胆汁酸受体FXR和TGR5表达的变化,旨在探讨胆汁酸与UC发生的关系。
材料与方法
一、资料来源
选取2013年1月—2016年6月南京医科大学附属江宁医院30例UC患者,诊断符合2012年中华医学会消化病分会炎症性肠病学组制定《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[4]。入院详细询问病史,排除合并胆道疾病、妊娠期妇女、酗酒者、药瘾者以及长期服用质子泵抑制剂、激素或非甾体消炎药者。30例UC患者中,男16例,女14例;年龄20~76岁,平均49岁;病变范围为左半结肠型7例,全结肠型23例。随机选择同期30名健康者作为对照,其中男14名,女16名;年龄16~74岁,平均44岁。两组患者的基本情况相比差异无统计学意义(P>0.05)。
二、研究方法
采用免疫组化SP法,获取UC患者和对照者的结肠组织(其中UC患者仅活检右半结肠2例,仅活检左半结肠10例,左右结肠均活检18例,多处活检者取均值。11名对照者活检部位为回盲部,19名为左半结肠),石蜡包埋,切片。常规脱蜡水化,行抗原修复后,分别加入FXR一抗(购自Sigma公司,工作浓度为1∶200)和TGR5一抗(购自Novus公司,工作浓度为1∶100);加入二抗;DAB染色,显微镜下观察。
结果判定:FXR主要定位于细胞核,TGR5主要定位于细胞膜。两种抗体评分采用半定量法,显微镜下随机选取5个视野,观察细胞染色情况。阳性细胞百分数:1分,阳性细胞数<5%;2分,5%~25%;3分,26%~50%;4分,>50%。染色强度:1分,浅黄色;2分,棕黄色;3分,深棕色。阳性细胞数与染色强度评分之积为染色总评分。
三、统计学分析
结 果
一、FXR表达
FXR在UC组和对照组结肠组织中均有表达。对照者FXR均阳性,主要为细胞核染色,部分阳性染色位于腺体周围结缔组织(图1)。UC组FXR阳性染色明显减弱,以胞质染色为主。UC组FXR表达显著低于对照组(4.63±2.07对6.91±2.62,P=0.00)(表1)。
二、TGR5表达
TGR5在UC组和对照组结肠组织中均有表达,主要表达于细胞膜,部分阳性染色位于胞质(图2)。UC组TGR5表达与对照组相比无明显差异(6.70±2.90对6.11±2.44,P=0.40)(表1)。
三、不同部位的FXR表达
右半结肠炎患者的FXR表达显著高于左半结肠炎(4.99±1.92对4.35±2.21),差异有统计学意义(P=0.003)。
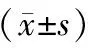
表1 UC组和对照组中FXR和TGR5表达情况
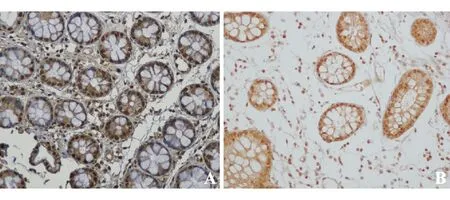
A:UC患者;B:对照组

A:UC患者;B:对照组
讨 论
UC的发病机制尚未完全阐明,目前认为环境、遗传、炎症、免疫反应等因素致肠道内环境紊乱、肠黏膜上皮功能障碍、黏膜免疫反应异常,最后导致肠道反复炎症,引起UC的发生、发展[5]。胆汁酸参与的肠肝循环对肠道稳态起至关重要的作用。作为一种信号分子[6],胆汁酸通过激活各种核受体和膜受体,在肝脏和胃肠道的自我调节中发挥重要作用[7]。FXR是核受体超家族的成员,是一种配体依赖性转录因子,主要表达于肝脏、肠道、肾脏等组织中,可调节胆汁酸代谢和胆汁酸肠肝循环[7]。TGR5是一种细胞膜受体,定位于人染色体2q35,同源性在人和哺乳动物中高度保守(>80%)[8]。TGR5在免疫细胞、肠道、胆囊等中高表达,在肺、脾、肾、子宫等中度表达,其他组织中弱表达或不表达[9]。胆汁酸通过激活FXR和TGR5信号通路,在调节炎症反应、细胞增殖和凋亡、控制糖脂和能量代谢中具有重要作用,参与肠道免疫调节和屏障功能,减轻炎症反应,保证肠道上皮完整性,防止肠道菌群易位[10-11]。
本研究通过检测UC患者和对照者结肠黏膜胆汁酸受体的表达情况,发现FXR表达在UC患者中显著下降,而TGR5表达无明显差异。说明FXR降低可能参与了肠道炎症的形成。Vavassori等[12]的研究发现,基础状态下,敲除FXR基因16周后,野生型小鼠出现了明显肠道炎症反应和前炎性因子mRNA表达。FXR激动剂GW4064可明显抑制胆管结扎小鼠肠道细菌过度生长和肠上皮绒毛中性粒细胞浸润,保护肠黏膜完整性[13],但对FXR基因敲除小鼠无此作用。此外,FXR缺失导致容易患胆囊结石[14]、原发性胆汁性肝硬化[15]。FXR表达与多种代谢、再生过程、细胞分化有关,说明其可能具有一定的抗炎作用[16]。
有研究表明,FXR表达从正常肠黏膜的末端回肠到远端结肠呈逐渐降低的梯度变化[17];UC缓解组、对照组的回肠和升结肠FXR mRNA表达无明显差异[18]。目前尚未见FXR在UC患者不同肠道部位分布情况的报道。UC好发于乙状结肠和直肠,本实验显示UC患者右半结肠FXR表达明显高于左半结肠,说明FXR在UC的发生中可能起保护作用。
胆汁酸是结直肠癌的促进因素,长期暴露于胆汁酸使机体活性氧簇(ROS)和活性氮簇(RNS)显著增加,加剧了对细胞膜和线粒体的破坏,促进DNA损伤、突变和凋亡,因此,胆汁酸暴露时间可能是消化道肿瘤发生的独立危险因素[18]。目前相当多的证据证实FXR表达与结肠腺瘤、结直肠癌呈负相关[19]。UC的严重程度与结直肠肿瘤的发生率呈正相关[20],据统计,约7%~10%的UC患者在发病20年后发展为结直肠肿瘤[21],从另一方面证实了FXR与UC的相关性。
本研究中,UC患者TGR5表达与对照组无明显差异,说明胆汁酸对UC的影响可能主要通过FXR起作用,但这一结论需扩大样本量进一步研究证实。体外研究[22]证实,UC与TGR5表达呈正相关,小鼠结肠炎模型中TGR5 mRNA表达增加,TGR5活化后可激活腺苷酸环化酶,从而导致细胞内cAMP浓度增加,参与机体重要功能的调控。TGR5在肠神经元表达,使抑制性运动神经元释放一氧化氮并抑制肠道运动,这可能是胆汁酸影响肠道动力的一种新机制[23]。目前胆汁酸对肠道疾病影响的研究结果不一,可能与胆汁酸受体在不同疾病的不同表达有关,其机制还需行进一步研究探讨。胆汁酸对UC可能有保护作用,但这一结论仍需开展大样本研究深入探讨
综上所述,FXR在UC患者结肠黏膜中的表达明显降低,导致对肠道的保护作用减弱,在UC的发病中起有重要作用。FXR可能是通过抑制转录因子NF-κB通路从而抑制炎症反应,但仍需进一步研究证实。此外,胆汁酸受体在炎症反应时间轴的哪一点、如何调控炎症反应过程仍需进一步研究。随着研究的深入,胆汁酸受体可作为药物靶点,用于治疗临床胃肠道疾病。
1 Ng SC, Bernstein CN, Vatn MH, et al; Epidemiology and Natural History Task Force of the International Organization of Inflammatory Bowel Disease (IOIBD). Geographical variability and environmental risk factors in inflammatory bowel disease[J]. Gut, 2013, 62 (4): 630-649.
2 Ye L, Cao Q, Cheng J.Review of inflammatory bowel disease in China[J].ScientificWorldJournal, 2013, 2013: 296470.
3 Bajor A, Törnblom H, Rudling M, et al. Increased colonic bile acid exposure: a relevant factor for symptoms and treatment in IBS[J]. Gut, 2015, 64 (1): 84-92.
4 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
5 Podolsky DK. Inflammatory bowel disease[J]. N Engl J Med, 2002, 347 (6): 417-429.
6 Thomas C, Pellicciari R, Pruzanski M, et al. Targeting bile-acid signalling for metabolic diseases[J]. Nat Rev Drug Discov, 2008, 7 (8): 678-693.
7 Fiorucci S, Cipriani S, Baldelli F, et al. Bile acid-activated receptors in the treatment of dyslipidemia and related disorders[J]. Prog Lipid Res, 2010, 49 (2): 171-185.
8 Duboc H, Taché Y, Hofmann AF. The bile acid TGR5 membrane receptor: from basic research to clinical application[J]. Dig Liver Dis, 2014, 46 (4): 302-312.
9 Kuipers F, Bloks VW, Groen AK. Beyond intestinal soap -- bile acids in metabolic control[J]. Nat Rev Endocrinol, 2014, 10 (8): 488-498.
10 Stepanov V, Stankov K, Mikov M. The bile acid membrane receptor TGR5: a novel pharmacological target in metabolic, inflammatory and neoplastic disorders[J]. J Recept Signal Transduct Res, 2013, 33 (4): 213-223.
11 Gadaleta RM, van Mil SW, Oldenburg B, et al. Bile acids and their nuclear receptor FXR: Relevance for hepatobiliary and gastrointestinal disease[J]. Biochim Biophys Acta, 2010, 1801 (7): 683-692.
12 Vavassori P, Mencarelli A, Renga B, et al. The bile acid receptor FXR is a modulator of intestinal innate immunity[J]. J Immunol, 2009, 183 (10): 6251-6261.
13 D’Aldebert E, Biyeyeme Bi Mve MJ, Mergey M, et al.Bile salts control the antimicrobial peptide cathelicidin through nuclear receptors in the human biliary epithelium[J]. Gastroenterology, 2009, 136 (4): 1435-1443.
14 Bergheim I, Harsch S, Mueller O, et al. Apical sodium bile acid transporter and ileal lipid binding protein in gallstone carriers[J]. J Lipid Res, 2006, 47 (1): 42-50.
15 Chignard N, Poupon R. Targeting farnesoid x receptor in hepatic and biliary inflammatory diseases[J]. Gastroenterology, 2009, 137 (2): 734-735.
16 D’Errico I, Moschetta A. Nuclear receptors, intestinal architecture and colon cancer: an intriguing link[J]. Cell Mol Life Sci, 2008, 65 (10): 1523-1543.
17 Lax S, Schauer G, Prein K, et al. Expression of the nuclear bile acid receptor/farnesoid X receptor is reduced in human colon carcinoma compared to nonneoplastic mucosa independent from site and may be associated with adverse prognosis[J]. Int J Cancer, 2012, 130 (10): 2232-2239.
18 Nijmeijer RM, Gadaleta RM, van Mil SW, et al; Dutch Initiative on Crohn, Colitis (ICC). Farnesoid X receptor (FXR) activation and FXR genetic variation in inflammatory bowel disease[J]. PLoS One, 2011, 6 (8): e23745.
19 Torres J, Bao X, Iuga AC, et al. Farnesoid X receptor expression is decreased in colonic mucosa of patients with primary sclerosing cholangitis and colitis-associated neoplasia[J]. Inflamm Bowel Dis, 2013, 19 (2): 275-282.
20 Rutter M, Saunders B, Wilkinson K, et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis[J]. Gastroenterology, 2004, 126 (2): 451-459.
21 Lewis JD, Deren JJ, Lichtenstein GR. Cancer risk in patients with inflammatory bowel disease[J]. Gastroenterol Clin North Am, 1999, 28 (2): 459-477, x.
22 Cipriani S, Mencarelli A, Chini MG, et al. The bile acid receptor GPBAR-1 (TGR5) modulates integrity of intestinal barrier and immune response to experimental colitis[J]. PLoS One, 2011, 6 (10): e25637.
23 Poole DP, Godfrey C, Cattaruzza F, et al. Expression and function of the bile acid receptor GpBAR1 (TGR5) in the murine enteric nervous system[J]. Neurogastroenterol Motil, 2010, 22 (7): 814-825. e227-e228.
(2017-02-15收稿;2017-03-24修回)
Expressions of Bile Acid Receptor FXR and TGR5 in Patients with Ulcerative Colitis
WEIMin1,CHENGWenfang2,PINGJing1,XIALu1.
1DepartmentofGastroenterology,theAffiliatedJiangningHospitalofNanjingMedicalUniversity,Nanjing(211000);2DepartmentofGastroenterology,JiangsuProvinceHospital,NanjingMedicalUniversity,Nanjing
CHENG Wenfang, Email: 13062589271@163.com
TGR5; FXR; Colitis, Ulcerative; Immunohistochemistry
10.3969/j.issn.1008-7125.2017.08.005
*本文通信作者,Email: 13062589271@163.com
Background: The incidence of ulcerative colitis (UC) in developed countries is higher than that in developing countries, which may be related with westernized lifestyle, especially high animal protein and low complex carbohydrate diet.With the increased high fat and meat intake, synthesis and secretion of bile acid in liver is also increased, which may have an impact on the occurrence of UC. Aims: To investigate the expressions of farnesoid X receptor (FXR)and G protein-coupled bile acid receptor 5 (TGR5) in patients with UC. Methods: Thirty patients with active UC from January 2013 to June 2016 at the Affiliated Jiangning Hospital of Nanjing Medical University were enrolled, and 30 healthy subjects were served as controls. Expressions of FXR and TGR5 were determined by immunohistochemistry. Results: Compared with control group, expression of FXR was significantly decreased in UC patients (4.63±2.07vs. 6.91±2.62,P=0.00), however, no significant difference in expression of TGR5 was found between the two groups (6.70±2.90vs. 6.11±2.44,P=0.40).Expression of FXR was significantly increased in right hemicolon colitis than in left hemicolon colitis (P<0.05). Conclusions: There is a significant decrease in FXR in active UC patients, indicating that FXR may have some role in the pathogenesis of UC, however, TGR5 may have no obvious effect in the pathogenesis of UC.
