延迟增强磁共振显像对房颤患者外科消融预后的评估价值
2017-09-15周敏黄日太薛松
周敏 黄日太 薛松
临床研究
延迟增强磁共振显像对房颤患者外科消融预后的评估价值
周敏 黄日太 薛松
目的 比较延迟增强磁共振(DE-MRI)与病理组织学方法检测心房纤维化程度的相关性,并分析其对房颤患者外科消融预后的评估价值。方法 2013年10月至2015年12月间,43例心脏瓣膜病合并房颤拟同期行房颤消融手术的患者,术前行DE-MRI检查评估心房纤维化程度,以此将患者分为轻度强化、中等强化和异常强化3组。术中切取左心耳标本通过病理组织学等检查评估心肌纤维化水平,比较DE-MRI检查与病理组织学检查的相关性。术后随访确定窦性心律维持率。结果 病理组织学等检查结果与术前DE-MRI检查所示的左心房延迟强化程度普遍具有相关性(r=0.69、0.48、0.65、0.51、0.47、0.52,P均<0.05),中度强化组1年窦率维持率显著高于异常强化组(85.7%比55.6%,P<0.05)。结论 延迟增强MRI显像可用于对拟行房颤外科消融患者的预后评估。DE-MRI检查异常强化(>35%)提示房颤消融手术的效果不佳。
心房颤动; 心肌纤维化; 延迟增强磁共振
心房颤动(atrial fibrillation,AF)为临床最常见的心律失常之一。有关其发生机制有很多学说,经典的学说主要有多发子波折返假说、主导折返环伴颤动样传导理论学说及局灶激动学说等。近年来发现,心房组织的纤维化与AF的发生也密切相关[1,2]。
延迟增强磁共振显像技术(delayed-enhancement magnetic resonance imaging,DE-MRI) 是近几年来发现的用于判断心房组织纤维化的重要检查方法[3,4]。其原理是当正常的心肌细胞由胶原替代形成纤维瘢痕后,胶原纤维的间隙较原先正常细胞外的间隙扩大,导致造影剂停留时间延长,因此在延迟显像时纤维化的心肌组织较周围正常心肌的信号高,即表现为延迟相强化。
本研究旨在比较DE-MRI与病理组织学方法检测心房纤维化程度的相关性,并分析其对房颤患者外科消融预后的评估价值。
1 资料与方法
1.1 临床资料 2013年10月至2015年12月期间,选取43例心脏瓣膜病合并AF拟同期行AF消融手术的患者。合并手术类型:行单纯二尖瓣置换术24例,单纯主动脉瓣置换术7例,主动脉瓣+二尖瓣置换术 11例,二尖瓣+主动脉瓣置换+三尖瓣置换术1例,26例同期行三尖瓣成形术。患者基本资料见表1。
表1 入组患者基本资料(±s)

表1 入组患者基本资料(±s)
例数 性别 年龄(岁)心功能男性 女性 Ⅱ级 Ⅲ级 Ⅳ级43 19 24 53.8±9.4 49.1±10.6 51.6±9.2 11.7±5.6 19 18 6左心房内径(mm)射血分数(%)房颤病程(月)
1.2 方法
1.2.1 DE-MRI检查 术前DE-MRI检查确定左心房纤维化程度。所有患者均采用3.0T MRI(飞利浦,acheiver)进行研究。MRI延迟增强定义为注射造影剂15 min后获得的图像,扫描技术采用3维(3D)预反转恢复,呼吸导航及心电门控。标准的图像采集参数如下:使用自由呼吸导航门控,横断面等体素成像,实际成像体素大小1.25 mm×1.25 mm×2.5 mm,翻转角度为22°,重复时间/回波时间6.1/2.4 ms,反转时间为230~320 ms,R2和42参考线并行成像GRAPPA技术。MRI图像的三维可视化和图像分割使用Osiri X2.7.5软件,采用手动分割技术获得左心房图像。采用MATLAB软件手动对心脏外缘和内缘进行勾划和确认。对左心房壁内纤维化的相对程度的评估是基于阈值的算法[5]进行量化分析,由软件计算得出异常强化心房组织的百分比(%)。按照左心房心肌增强的程度,将患者分为以下3个等级。轻度强化患者为左心房心肌异常强化<15%,中等强化是左心房心肌异常强化为15%~35%,左心房心肌异常强化>35%被认为是异常强化。
1.2.2 手术方法 建立体外循环后,应用Atricure射频发生器和 Atricure双极射频隔离钳(型号OLL2)进行消融,应用能量为 22.8~28.5 W。在体外转流并行循环下,首先行右侧肺静脉环状消融,游离出右肺静脉,行右肺静脉及右心房前庭处钳夹消融3~5次。消融结束后降温,阻断升主动脉,灌注心脏停搏液,游离左肺静脉,行左肺静脉钳夹消融2~3次。以电凝切断Marshell韧带,切除左心耳(置于冰生理盐水备用),以双极笔行左心耳切缘到左肺静脉环线的连线消融,再自右心房顶平行界嵴切开右心房和房间隔进行右心房面的消融。然后经右上肺静脉左心引流处切口插入双极消融笔,行两侧肺静脉环线连接线的消融及到二尖瓣环的消融线。完成消融后心脏停跳下进行瓣膜置换术。
1.2.3 心肌Ⅰ、Ⅲ型胶原观察 应用苦味酸天狼猩红染色偏振光显微镜观察心肌Ⅰ、Ⅲ型胶原。术中获取左心耳组织,用4%多聚甲醛固定,取左心耳冠状面最大横径处切片,按以下步骤进行苦味酸天狼猩红染色:①组织切片常规脱蜡至水,蒸馏水洗3次;②0.1%苦味酸天狼猩红染色液(北京海德生物制剂公司)滴染60 min;③自来水冲洗5 min;④梯度酒精脱水,二甲苯透明,中性树胶封固。在偏振光显微镜下随机选取4个不含血管视野,Image Pro plus 6.0图像分析系统计算每个视野中Ⅰ、Ⅲ型胶原组织所占面积的百分比,取均数代表Ⅰ、Ⅲ型胶原CVF(胶原容积分数)。
1.2.4 Ⅰ、Ⅲ型胶原mRNA表达测定 应用逆转录多聚酶链反应(RT-PCR)测定Ⅰ、Ⅲ型胶原mRNA表达。心房组织标本经液氮冷冻磨碎,每100 mg心肌组织加入Trizol 1 ml充分裂解,加入氯仿200μl混匀30 s后离心(12 000 rpm,室温下5 min),后经异丙醇抽提RNA,然后用 MMLV逆转录酶进行cDNA的逆转录,合成好的cDNA作为模板进行Ⅰ/Ⅲ型胶原的PCR扩增反应,扩增条件是:25~28个循环,95 ℃ 30 s,55 ℃ 1 min,72 ℃ 30 s。GAPDH 作为内参。具体的引物序列如下:CollagenⅠ(上游5′-GGCGGCCAGGGCTCCGACCC-3′;下游 5′-AATTCCTGGTCTGGGGCACC-3′),Collagen Ⅲ (上游 5′-TGGTGTTGGAGCCGCTGCCA-3′; 下 游 5′-CTCAGCACTAGAATCTGTCC-3′),GAPDH(上游 5′-TGAAGGTCGGAGTCAACGGATTTGGT-3′;下游 5′-CATTGTGGCCATGAGGTCCACCAC-3′)。反应产物进行2%琼脂糖凝胶电泳和检测。PCR产物片段采用显微图像分析仪进行Ⅰ、Ⅲ型胶原积分光密度分析,计算平均积分光密度。
1.2.5 Ⅰ、Ⅲ型胶原蛋白检测 应用免疫组化法检测Ⅰ、Ⅲ型胶原蛋白。心房组织冰冻切片,经1%小鼠血清封闭非特异性抗原结合位点后,加入小鼠抗人Ⅰ型(Oncogene Research Products,1∶300 稀释)和Ⅲ型(Sigma Chemical Co,1∶150稀释)胶原蛋白单克隆抗体,置湿盒在室温下1 h。采用PAP免疫组织化学染色,AEC显色。每张切片随机取5个高倍视野(×400),通过测定5个高倍视野中阳性染色物质平均灰度值分析来定量评估心房组织Ⅰ型和Ⅲ型胶原蛋白表达。
1.2.6 随访 所有入组患者均在术后3、6、12个月及以后的每年一次进行电话或门诊随访,随访内容包括患者心功能、超声心动图、心电图和24 h动态心电图(Holter)。以随访期内死亡、房颤或房扑复发及其他心律异常需要安装起搏器治疗作为终点。
1.3 统计学方法 采用SPSS 19.0软件进行统计分析。计量资料采用±s表述,计数资料采用例数(百分比)表示。两组间率的比较采用卡方检验,各指标两两差异比较采用相关性分析,相关性用系数r表示。P<0.05为差异有统计学意义。
2 结果
2.1 DE-MRI结果 术前DE-MRI结果显示,入组患者普遍(90.7%)为中度以上强化(轻度强化患者4例、中度强化21例、异常强化18例)。全组手术无死亡。出院时全组患者中维持窦性心律40例,占全组93.0%,其中中度强化组窦性心律转复率95.2%,异常强化组为 88.9%,χ2=27.92,P=0.75。
2.2 相关性检验 入组患者的左心房延迟增强程度(%)与病理组织学检查各指标(Ⅰ、Ⅲ型胶原容积分数、Ⅰ型胶原蛋白含量、Ⅲ型胶原蛋白含量、Ⅰ型胶原mRNA表达、Ⅲ型胶原mRNA表达)的相关性系数(r)分别为 0.69、0.48、0.65、0.51、0.47、0.52,P 值分别为 0.00、0.02、0.03、0.01、0.01、0.02。
2.3 术后随访 1年随访期内无失访患者。截至2016年 11月,平均随访(13.3±8.1)个月。32例患者维持窦性心律,11例患者仍为房颤,无死亡。中度强化组(15%~35%)1年随访窦性心率维持率85.7%,异常强化组(>35%)1年随访窦性心率维持率 55.6%,χ2=7.41,P=0.01。见表 2。
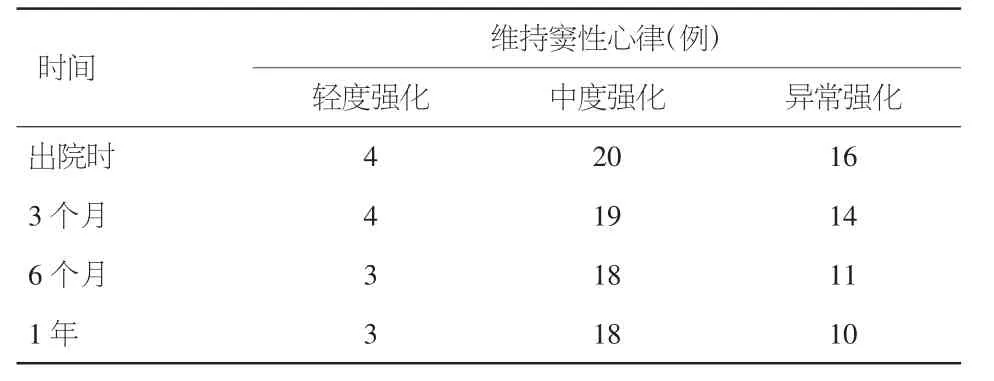
表2 患者随访情况(例)
3 讨论
房颤的发病机制一直是国内外心脏病专家关注的热点话题。20世纪50年代Moe提出的多子波微折返假说被认为是房颤的经典发病机制[6]。经过几十年从基础到临床的研究,形成了许多学说,其中心房纤维化学说正逐渐受到学者们关注[7-13]。
当房颤发生时,心房会产生电生理、收缩力以及心房肌组织的重构(structural remodeling,SRM),这些重构的最终结果就是出现心房肌细胞凋亡、胶原组织增生,最终导致心肌组织弥漫性纤维化[14,15]。心房纤维化由于增加了心房的局部传导异常,在房颤的发生和维持中起到了关键的作用[16]。
1987年,Cox等[17]最早报道应用“切和缝”的“迷宫手术”治疗房颤,其转复窦性的有效率可以达到97%。虽然成功率较高,但由于其复杂性及较高的并发症发生率,迷宫手术已逐步从最初“切和缝”的方法被以各种不同能源为代表的手术消融所代替[18]。对于房颤的治疗目前主要包括药物治疗、心脏电复律、内科的介入导管射频消融以及外科手术消融等。尽管房颤的治疗手段较多,但不管应用哪一种方法治疗,治疗成功率仍较低,特别是对于慢性房颤,不管是应用内科的导管消融手术还是心脏外科手术同期行房颤的消融治疗,成功率都只有60%~80%。传统认为房颤治疗的成功率主要与患者房颤的病程长短、左心房内径大小及房颤的类型等有关。而近年来,随着房颤机制研究的深入,心房组织的纤维化程度对于房颤消融治疗效果的影响更引起人们的注意。因此,寻找一种无创伤的评判心房组织纤维化程度对指导房颤的消融治疗具有一定的临床意义。
2009年,Oakes等[5]最早对81例准备行肺静脉前庭隔离术的房颤患者术前进行DE-MRI检查评价,结果发现,DE-MRI检查的左心房增强程度(亦即代表左心房组织纤维化程度)与房颤的复发率密切相关,左心房增强面积越大的患者房颤的复发率越高,即消融效果越差。Kuppahally等[19]及Daccarett等[20]的研究也发现同样的研究结果,并且进一步发现,消融术后房颤的转复率只与术前DE-MRI检查显示的左心房纤维化程度有关,而与阵发性房颤或持续性房颤无关。这进一步证明DE-MRI检查显示的左心房纤维化程度对房颤消融手术预后方面的重要指导意义。
Oakes等的研究发现为房颤消融的术前评估提供了一种简单无创的方法,但同时也引起了很多的争议和疑问,主要集中在应用DE-MRI检查发现的心房肌组织纤维化尚缺乏直接的病理学证据,而病理学证据是公认判断组织纤维化的“金标准”。其次,DE-MRI检查纤维化的程度如何科学地量化?Oakes也认为,因为他的研究对于心房组织纤维化程度的判断是应用“基于阈值的计算法”(thresholdbased algorithm),因此检查者的经验十分重要,由于缺乏直接的病理学组织切片检查作为对照,检查者只能凭借经验来确定阈值及纤维化程度,这也成为他这个研究的一个局限。
本研究结合了DE-MRI技术与病理组织学等检查,发现试验组患者的左心房延迟增强程度(%)与病理组织学检查各指标(Ⅰ/Ⅲ型胶原容积分数、Ⅰ/Ⅲ型胶原蛋白含量、Ⅰ/Ⅲ胶原mRNA表达)的相关性系数(r)分别为 0.69、0.48、0.65、0.51、0.47、0.52,P均<0.05,提示患者术前DE-MRI检查所显示的左心房延迟强化程度与病理组织学检查各指标所反映的心房纤维化程度普遍具有相关性。
结合随访资料本研究发现,术前DE-MRI结果提示心房异常强化(>35%)房颤患者1年随访窦性心率维持率仅有55.6%,显著低于心房强化程度较低的房颤患者,提示心房延迟强化程度越高,消融术的预后也越差。这与最近Gal等[21]发表的研究结论相近。可见,DE-MRI方法可用于评估心肌纤维化程度,并为持续性房颤患者行消融手术的预后评估及治疗方案选择提供有效的临床依据。
[1]Everett TH,Wilson EE,Verheule S,et al.Structural atrial remodeling alters the substrate and spatiotemporal organization of AF:a comparison in canine models of structural and electrical atrial remodeling.Am J Physiol Heart Circ Physiol,2006,291:H2911-2923.
[2]Everett TH,Olgin JE.Atrial fibrosis and the mechanisms of atrial fibrillation.Heart Rhythm,2007,4:S24-27.
[3]Zhu H,Zhang W,Zhong M,et al.Myocardial ultrasonic integrated backscatter analysis in patients with chronic atrial fibrillation.Int J Cardiovasc Imaging,2010,26:861-865.
[4]Shah D.The role of MRI-detected left atrial delayed enhancement in selecting the right patient and choosing the optimal strategy for catheter ablation of atrial fibrillation.J Cardiovasc Electrophysiol,2011,22:23-24.
[5]Oakes RS,Badger TJ,Kholmovski EG,et al.Detection and quantification of left atrial structural remodeling with delayedenhancement magnetic resonance imaging in patients with atrial fibrillation.Circulation,2009,119:1758-1767.
[6]周自强,胡大一,陈捷,等.中国心房颤动现状的流行病学研究.中华内科杂志,2004,43:491-494.
[7]Guo YT,Gregory YH,Apostolakis S.Inflammation in Atrial Fibrillation.J Am Coll Cardiol,2012,60:2263-2270.
[8]Conway DS,Buggins P,Hughes E,et al.Relationship of interleukin-6 and C-reactive protein to the prothrombotic state in chronic atrial fibrillation.J Am Coll Cardiol,2004,43:2075-2082.
[9]任立权,彭定凤.心房颤动患者高敏C反应蛋白的变化及与心房重构的关系.临床心血管病杂志,2011,27:175-177.
[10]柯丹,许春萱,张建成,等.心房颤动患者心房组织肿瘤坏死因子-α的表达.中国心脏起搏与心电生理杂志,2008,22:131-134.
[11]Xiao HD,Fuchs S,Campbell DJ,et al.Mice with cardiacrestricted angiotensin-converting enzyme (ACE) have atrial enlargement, cardiac arrhythmia, and sudden death.Am J Pathol,2004,165:1019-1032.
[12]Ponten A,Li X,Thoren P,et al.Transgenic overexpression of platelet-derived growth factor-C in the mouse heart induces cardiac fibrosis,hypertrophy,and dilated cardiomyopathy.Am J Pathol,2003,163:673-682.
[13]袁秋晓,徐新,张社兵.心房颤动危险因素国内外研究进展.中国心血管病研究,2014,12:567-569.
[14]Casaclang-Verzosa G,Gersh BJ,Tsang TS.Structural and functional remodeling of the left atrium:Clinical and therapeutic implications for atrial fibrillation.J Am Coll Cardiol,2008,51:1-11.
[15]Akoum N,Daccarett M,McGann C,et al.Atrial fibrosis helps select the appropriate patient and strategy in catheter ablation of atrial fibrillation:a DE-MRI guided approach.J Cardiovasc Electrophysiol,2011,22:16-22.
[16]Cha TJ,Ehrlich JR,Zhang L,et al.Atrial ionic remodeling induced by atrial tachycardia in the presence of congestive heart failure.Circulation,2004,110:1520-1526.
[17]Cox JL,Schuessler RB,D′Agostino HJ Jr,et al.The surgical treatment of atrial fibrillation,Ⅲ:development of a definitive surgical procedure.J Thorac Cardiovasc Surg,1991,101:569-583.
[18]Weimar T,Schena S,Bailey MS,et al.The Cox-Maze Procedure forLone AtrialFibrillation:A Single-Center Experience Over 2 Decades.Circ Arrhythm Electrophysiol,2012,5:8-14.
[19]Kuppahally SS,Akoum N,Badger TJ,et al.Echocardiographic left atrial reverse remodeling after catheter ablation of atrial fibrillation is predicted by preablation delayed enhancement of leftatrium bymagneticresonanceimaging.Am HeartJ,2010,160:877-884.
[20]Daccarett M,Badger TJ,Akoum N,et al.Association of left atrialfibrosis detected by delayed-enhancementmagnetic resonance imaging and the risk of stroke in patients with atrial fibrillation.J Am Coll Cardiol,2011,57:831-838.
[21]Gal P,Marrouche NF.Magnetic resonance imaging of atrial fibrosis:redefining atrial fibrillation to a syndrome.Eur Heart J,2015 Sep 25.[Epub ahead of print]
Clinical value of delayed enhancement MRI in evaluating the prognosis of surgical ablation in patients with atrial fibrillation
ZHOU Min,HUANG Ri-tai,XUE Song.Department of Cardiovascular Surgery,Renji Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200127,China
HUANG Ri-tai,E-mail:huangritai@renji.com
ObjectiveTo investigate the value of Delayed Enhancement MRI(DE-MRI) in evaluating the prognosis of surgical ablation in patients with atrial fibrillation(AF)and the relationship between DE-MRI and histopathology examination.MethodsFrom October 2013 to December 2015,43 AF patients undergoing surgical ablation got DE-MRI before the surgery and were divided into three groups according to the extent of atrial fibrosis.With the surgical occlusion process,the left atrial appendages were taken to histopathology examination and RTPCR.ResultsThe results of DE-MRI were correlated with the histopathology examinations(r=0.69,0.48,0.65,0.51,0.47,0.52,P<0.05);the sinus rhythm rate in 1 year of the moderate-enhancement group was much higher than the unusual-enhancement group(80.0%vs 57.1%,P<0.05).ConclusionDE-MRI can be used to detect the extent of the atrial fibrosis and late enhancement area over 35%suggests poor prognosis.
Atrial fibrillation; Myocardial fibriosis; Delayed-Enhancement Magnetic resonance imaging
上海市科委医学引导项目(项目编号:134119a5600);上海交大医学院附属仁济医院临床科研创新培育基金计划(项目编号:PYMDT-008)
200127 上海市,上海交通大学医学院附属仁济医院心血管外科
黄日太,E-mail:huangritai@renji.com
10.3969/j.issn.1672-5301.2017.04.015
R654.2
A
1672-5301(2017)04-0350-05
2016-12-12)
