骨髓间充质干细胞在低氧共培养条件下对髓核细胞保护作用的实验研究
2017-09-15季伟李海峰程实陈佳海徐成刘玥何勍阮狄克
季伟李海峰程实陈佳海徐成刘玥何勍阮狄克*
(1.第四军医大学西京医院骨科,西安710032;2.海军总医院骨科,北京100048)
∙基础研究∙
骨髓间充质干细胞在低氧共培养条件下对髓核细胞保护作用的实验研究
季伟1,2李海峰2程实2陈佳海2徐成2刘玥2何勍2阮狄克2*
(1.第四军医大学西京医院骨科,西安710032;2.海军总医院骨科,北京100048)
背景:对于骨髓间充质干细胞(BMSCs)与髓核(NP)细胞共培养的研究主要集中在不同条件下的干细胞向NP细胞表型的分化。一些研究表明,在动物试验中干细胞影响退变的NP细胞。少有研究人BMSCs对NP细胞的影响,特别是在低氧条件下。目的:建立同一患者的BMSCs和NP细胞的共培养模型,探讨在低氧环境下BMSCs对NP细胞的生物学影响。方法:分离培养患者的NP细胞和BMSCs。并将其分为两组。A组为NP细胞单独培养组,B组为NP细胞与BMSCs共培养组。两组细胞均连续培养14 d。通过光学显微镜观察两组细胞形态及数量,用流式细胞仪和扫描电子显微镜(SEM)观察细胞死亡。用细胞计数kit-8试剂盒(CCK8)评估细胞增殖,进一步采用实时/逆转录-聚合酶链反应(RT-PCR)检测细胞外基质(ECM)和NP细胞特殊表型的标记的表达。结果:培养14 d后,光学显微镜下观察,单独培养组可见NP细胞贴壁和延伸,NP细胞的数量比培养前多。在共培养组,NP细胞形态是纺锤形,贴壁、延伸比单培养组好,NP细胞的数量远远超过培养前,并且多于单独培养组。CCK8检测表明,培养14 d后,与单独培养组相比,共培养组的NP细胞更多(P<0.05),单独培养组细胞凋亡率高于共培养组(P<0.05)。在低氧和与BMSCs共同培养条件下,蛋白多糖(AGG)、胶原Ⅱ(COL2),SOX-9,角蛋白19(KRT19),碳酸酐酶Ⅻ(CA12)和低氧诱导因子(HIF)表达增加。RT-PCR检测表明这些基因和蛋白的合成、分泌在与BMSCs共培养的NP细胞组中明显高于NP细胞单独培养组。结论:在体外更接近体内条件的低氧直接共同培养条件下,BMSCs可能会通过调节ECM和调节基因来保护或激活退化的NP细胞。为BMSCs治疗椎间盘退变提供了一个重要的新思路。
共培养;低氧;骨髓间充质干细胞;髓核细胞;椎间盘;细胞治疗
退行性椎间盘疾病(DDD)在腰痛患者中比较常见,严重影响生活和工作。研究表明其发病机制是中央胶状髓核(NP)细胞减少[1]。退变过程的特点是细胞总数减少,细胞功能障碍,细胞外基质蛋白聚糖产生下降[2]。在这方面,许多研究都指出,异常载荷可能导致椎间盘细胞合成和胶原基因表达的变化,蛋白聚糖和蛋白酶的激活,以及细胞凋亡[3-5]。目前,治疗DDD大多数是缓解症状,并有诸多限制和并发症。因此,新的治疗椎间盘退变的方法越来越受到关注。
一种可能性是利用组织工程和细胞移植技术将活细胞植入NP,扭转退化过程,活细胞能够在椎间盘内生存,类似产生椎间盘细胞外基质或改变生物力学性能[6,7]。1998年Nishimura首次尝试在椎间盘内植入NP细胞会减缓椎间盘退变[8]。Ganey等[9]将自体椎间盘软骨细胞植入退化的椎间盘后可以存活并产生细胞外基质成分,类似正常椎间盘组织。通过Mochida等[10]的临床研究证实了活化NP细胞移植的安全性,研究结果表明这种治疗方法减缓了椎间盘的进一步退化。然而,这些方法在实际临床应用有一定的局限性,因为从椎间盘收集患者自身细胞或NP细胞会加速椎间盘退化,而从相邻的正常椎间盘获得细胞则会减缓椎间盘退变。因此,合适的活细胞来源是细胞生物修复策略的关键因素之一。
间充质干细胞(MSCs)的增殖能力和多向分化能力优异,故其成为治疗椎间盘退变的选择。在成人中,有大量干细胞的潜在来源[11]。已有研究证明,体外MSCs,如BMSCs[12]和脂肪干细胞(ADSCs)[13]可以定向分化为具有NP表型的细胞。在低氧和转化生长因子-β1(TGF-β1)条件下,BMSCs分化的表型与NP细胞是一致的[14]。Richardson的研究表明,NP细胞和BMSCs间接触共培养,将上调NP细胞标记基因的表达,并分化为NP细胞样表型3。BMSCs移植到NP后,能够100%存活并有增殖活性[15],椎间盘的蛋白多糖也会增加[16],特别是,BMSC分化成表达NP细胞主要的表型特征的细胞[17]。
大量的研究都集中在不同条件下的干细胞向NP细胞表型的分化。有些报告称,干细胞对退化的NP细胞有营养影响。在直接共培养系统中BMSCs可上调NP细胞活力[18,19]。Gruber等[20]一直致力于自体椎间盘细胞移植治疗砂大鼠模型椎间盘退变的效果。Nishimura等[21]报道,自体NP细胞的恢复会减缓椎间盘退变。Yukihiro等[19]发现NP细胞和BMSCs共培养会显著上调NP细胞活力。尽管BMSCs对NP细胞具有保护作用,但很少有研究集中在低氧环境下来自于同一个人的BMSCs对NP细胞的影响。因此,本研究旨在建立同一患者的BMSCs和NP细胞的共培养模型,探讨在低氧环境下BMSCs对NP细胞的生物学影响。
1 材料与方法
1.1 组织收集
本研究经由海军总医院伦理审查委员会批准。实验用髓核和骨髓血来自椎间盘突出症后路椎间盘切除减压融合患者。共培养两种细胞来自同一组患者(n=10;年龄30~50岁,平均41.5岁)。通过分析MRI数据,我们选择患者椎间盘Pfirrmann分级为Ⅱ~Ⅲ级。
1.2 人NP细胞的分离与培养
为了分离人类的NP细胞,在手术后2 h内,从10例患者获取NP组织。患者NP组织被切断,用尼龙网过滤(100 μm),然后用0.025%胶原酶Ⅱ溶液消化(Sigma,美国),在无血清培养基中,37℃,5%CO2的培养箱中过夜。1000×g离心5 min,分离的细胞以密度为1×103/cm2培养在DMEM培养基和F12(DMEM/ F12,Hyclone)培养基含10%胎牛血清(FBS;Gibco)、2 mmol/L谷氨酰胺,100 U/ml青霉素,100 mg/ml链霉素在37°C含5%的CO2的环境下。每3天换1次培养基。冻存细胞用胰蛋白酶/乙二胺四乙酸(0.05%/ 0.02%;Gibco),传代比例为1:3。最后,第3代NP细胞用于实验。
1.3 人BMSC s s的分离鉴定
用10~20ml肝素抗凝骨髓血,在手术过程取自于椎弓根的骨髓血在正常的生理盐水中使用5%右旋糖酐,固定1 h。将上层血清离心3000 r/m,20 min,用生理盐水洗两次,1500×g离心5 min。选择中间部分培养在10c m2的培养瓶中含有相同的培养基。认为贴壁细胞是BMSCs。传代两次后,细胞染色,用荧光素标记的单克隆抗体CD14、CD29、CD34、CD44、CD45、CD80、CD86、CD106、HLA-ABC和HLA-DR(BD Pharmingen,San Diego,CA,USA)、CD90和CD105(Serotec,Oxford,UK)染色后用流式细胞仪分析(FACSort;BD,San Jose,CA,USA)。
1.4 BMSC s s和NP细胞共培养
本试验使用六孔共培养板(康宁公司,美国),transwell膜所带孔洞直径1.0 μm,第三代BMSCs和NP细胞用于本实验,培养方式为接触式共培养[19]。
1.5 细胞数量和形态
共培养前观察两种细胞的形态。共培养2周后,用光学显微镜(Olympus,Tokyo,Japan)观察NP细胞的形态和数目变化。
1.6 测量细胞增殖
采用细胞计数kit-8试剂盒(CCK-8,Dojindo,日本)评估细胞增殖。按每孔1×104NP细胞接种于24孔培养板中,与BMSCs共培养,没有共培养组作为对照组。使用酶标仪(Elx800,Bio-Tek,美国)测量450 nm处的吸光度以间接反映细胞数。实验重复3次,结果取平均值分析。最后,换新培养基添加CCK-8溶液(10 μl)孵育30 min,然后移到96孔板。
1.7 流式细胞术测细胞凋亡
用Annexin V-FITC/PI(BD Biosciences,San Diego,CA,USA)将细胞染色进行流式细胞术检测。用PBS洗涤后将1×105细胞重新悬浮在结合缓冲液中。在室温下,用Annexin V-FITC和PI将细胞孵育5 min,进行样品分析。每个实验重复3次。
1.8 扫描电子显微镜
用SEM测定在各组中NP细胞的黏附性。用4%多聚甲醛将NP细胞在室温下固定30 min。样品用蒸馏水和连续乙醇溶液脱水洗涤3次。在室温下真空干燥,样品镀膜,然后用扫描电子显微镜(Hitachi S-3400N,日本)观察。
1.9 实时//逆转录--聚合酶链反应分析
经过14 d的培养,采用Trizol试剂提取总RNA。然后,使用逆转录试剂获得总RNA的cDNA。1μl RNA混合2 μl 5×PrimeScript®RT MasterMix和10μl RNase dH2O。混合溶液在37℃下孵育15 min,然后85℃、5s,并存储在-80°C。β-actin作为对照。分析ECM相关基因(COL2,SOX-9,AGG)的mRNA表达水平和NP细胞的表型相关基因(CA12,HIF-1, KRT19)。用于扩增的引物,由生工生物技术有限公司合成(上海,中国)。95℃、20 s,在95℃、5 s和60℃、20 s反应循环40次。得到每个样本的阈值(Ct),取三个值得平均值。用2−△△CT评估基因的相对表达水平。
1.10 统计分析
采用SPSS统计软件包(SPSS,Chicago,IL,美国)的统计分析方法。两组参数分析中使用双尾t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞数量和形态
两组培养14 d后,共培养髓核细胞的形态优于单独培养组,细胞数量多于单独培养组(图1)。
2.2 BMSC对NP细胞凋亡的影响
NP细胞用AV和PI标记,流式细胞仪通过识别AV和PI标记确定活细胞数目(Q3:AV-PI-),早期凋亡细胞数(Q4:AV+PI)和坏死细胞数(Q2:AV-PI+)。用流式细胞仪测定早期凋亡和坏死细胞的百分比。如图2所示,与BMSCs共培养导致细胞凋亡明显减少(AV+PI,P<0.05)。坏死细胞的百分比(AV-PI+)无显著差异。此外,通过扫描电镜观察各组细胞的形态特征:NP细胞每一组贴壁、延伸,并开始分裂(图3)。非共培养组NP细胞收缩,细胞膜破裂,颗粒物减少。相反,在共培养的NP细胞组形态向两极或多级延伸,无明显凋亡表现。电镜结果与细胞凋亡检测结果一致。
2.3 NP细胞的增殖
CCK-8分析,共培养组较非共培养组最佳密度值在7 d增加40%(P<0.05)和在14 d增加58%(P<0.01,图4)。
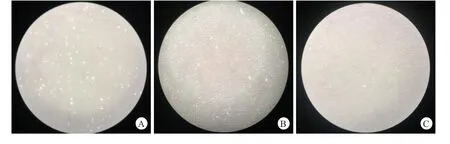
图1 A.共培养前髓核细胞,B.单独培养14 d后髓核细胞的形态及数量,C.共培养14 d后髓核细胞的形态及数量
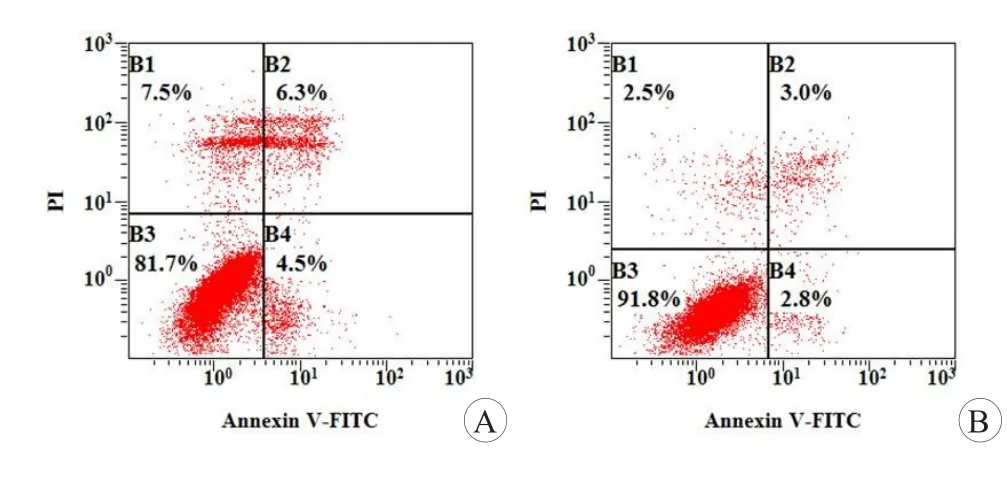
图2 流式细胞仪分析NP细胞凋亡

图3 扫描电子显微镜下的两组NP细胞
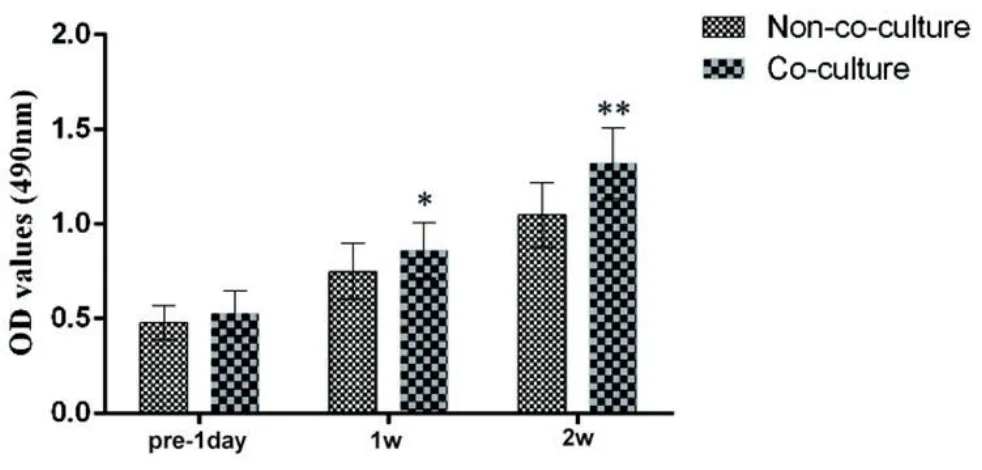
图4 两组NP细胞的CCK-8值
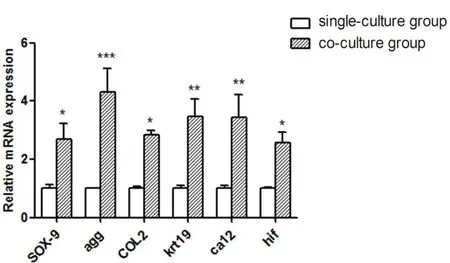
图5 培养14 d后,NP细胞的SOX-9,COL2,AGG,CA12,KRT19和HIF-1的mRNA表达水平
2.4 培养后的基因表达检测
ECM(SOX-9、COL2、AGG)是由定量逆转录聚合酶链反应分析,培养2周后,这三个基因的表达显著增加(P<0.05)。NP细胞的特征标记物(CA12、KRT19、HIF-1)的表达由定量逆转录-聚合酶链反应分析,培养2周后,3种标记物的表达均显著增加(P< 0.05,图5)。退化的NP细胞与BMSCs直接共培养后,NP细胞的SOX-9,COL2,AGG,CA12,KRT19和HIF-1明显增加。
在NP细胞和BMSCs接触共培养系统中,NP细胞可以刺激BMSCs向NP细胞表型分化。另一方面,我们的结果表明,BMSCs可以保护或激活NP细胞当细胞处在凋亡和退化的状态下,在低氧环境通过不同的分子机制:上调ECM,NP特异性标记的高表达来上调NP细胞的增殖。在这项研究中两种类型细胞的相互影响的发现,扩大我们对BMSCs治疗椎间盘再生了解与应用。
3 讨论
间充质干细胞广泛分布于不同的成体组织中,如脂肪组织、骨、肺和外周血[22]。近年来,许多研究表明,从人骨髓中分离出间充质干细胞具有多向分化潜能。骨髓间充质干细胞因其可分化为成骨细胞、软骨细胞、脂肪细胞、骨骼肌纤维、心肌细胞、肝细胞、上皮细胞而众所周知[23]。根据此独特的多向分化能力方面,诸多报道集中在BMSCs的可塑性方面[24,25]。据报道,在椎间盘再生治疗方案中,骨髓间充质干细胞是一种很有前景的选择。大量研究表明,将干细胞注射到NP组织是一种治疗椎间盘退行性疾病有效的生物学治疗方式[26-30]。实际上,在将骨髓间充质干细胞注射治疗之前,椎间盘退行性疾病患者的NP细胞可能都已经退化殆尽了[11]。椎间盘的发展与NP细胞死亡有关。在大多数的椎间盘病理学中都发现了NP细胞的减少[31]。BMSCs分化是一个重要的问题。在干细胞治疗椎间盘中我们需要全面清楚的了解BMSCs对剩余的已退化的NP细胞的影响[32]。在这项研究中,我们发现,在低氧条件下,BMSCs可以防止细胞凋亡,增加细胞外基质和NP细胞特定的标记物的表达,这可能会揭示干细胞治疗对椎间盘再生的影响。
椎间盘是一种几乎无血管的组织,它由软骨板、纤维环、髓核组成[33]。在缺血的IVD,O2浓度是梯度下降的,在一个大椎间盘中心,O2的浓度低至1%[34]。因此,NP细胞能够在低氧环境下存活和发挥功能。有推测,氧浓度影响BMSCs向NP样细胞分化。事实上,以前的研究报告说,2%的氧浓度就可以促进BMSCs分化为NP样细胞[14,35]。最近Dahia等[36]报道,椎间盘分化需要Sonic hedgehog信号通路,这个信号可以由缺氧来诱导[37]。NP细胞特征标记FOXF1可以由其激活和调节[38]。
此外,在缺血、低氧、酸性的成人椎间盘环境,要保持CA12平衡[39],通过HIF-1在低氧条件下调节[40]。因此,含氧量低,在NP细胞发展中是一个重要因素,可以通过Sonic hedgehog信号或HIF-1[41]调节NP细胞特征性标记的表达。NP细胞合成典型软骨成分如SOX9、Ⅱ型和Ⅳ型胶原、蛋白多糖和多能聚糖,是ECM重要组成成分。以往的研究表明,没有明确的NP细胞的标志,NP细胞经常被视为软骨样细胞,在NP组织时期,认为与透明软骨具有相似的生物大分子。目前,在2014年度ORS会议上,科学家们定义和推荐了年轻健康的髓核细胞表型:HIF-1,GLUT-1,AGG、COL2比值>20,Shh,Brachyury,KRT18/19、CA12,CD24的稳定表达。
在体外实验中,Yamamoto等[19]发现,当BMSCs和NP细胞直接接触共培养后,NP细胞的增殖、DNA合成、蛋白多糖明显升高;维持NP细胞生物力学特性的;不同生长因子的表达均显著增加。这种新共培养体系的另一个优点是在较早的阶段增强细胞的粘附性,增殖速度显著加快,NP细胞可以在4天就达到充分融合。这些结果表明共培养体系中细胞与细胞直接接触的重要性。因此,目前的研究采用细胞与细胞直接接触共培养系统。本研究首次建立同源的NP细胞和BMSCs的体外共培养模型,探讨低氧环境下BMSCs对NP细胞的生物学效应。
本研究显示,与BMSCs共培养后,ECM基因的表达(SOX-9、COL2、AGG)显著增加,增殖增强,凋亡被抑制,这表明对NP细胞有保护作用。与BMSCs共培养后,NP细胞特异性标志基因的表达(CA12、KRT19、HIF-1)也明显增加,这表明NP细胞变得更健康。特别是AGG和NP细胞特异性标志基因的表达与其他相比更为突出,维持ECM功能和使NP细胞适应环境。我们的研究结果表明,在治疗退行性椎间盘疾病中,BMSCs发挥恢复的作用,不但可以向NP细胞分化而且有利于现有的NP细胞在不利环境提高功能,这种提高是通过细胞因子和细胞与细胞间的直接接触实现的。
目前的研究有几个局限性。首先,虽然目前共培养系统具有许多优点,它不能实现更好维持NP细胞表型的3D培养。单层培养与体内研究相比,细胞基质合成和信号转导将受到干扰。第二,我们只研究了细胞外基质和NP细胞特异性标记基因的表达,进一步的实验应该做如信号转导通路和分子机制。第三,虽然我们保持了两种细胞在自然条件下,但椎间盘源性环境的特点,如酸性、高渗是复杂的,难以完全在体外模拟[42]。最后,这项研究只是提供了探讨BMSCs可能有助于DDD基础细胞治疗的第一步。然而,在临床上应用需要进一步了解NP细胞的生物学的上调和代谢活性。
本研究建立了同一患者的BMSCs和NP细胞的体外共培养模型,探讨低氧环境下BMSCs对NP细胞的生物学效应。结果表明,BMSCs对NP细胞的凋亡有抑制作用,对NP细胞的增殖有很好的保护作用。此外,BMSCs通过增加ECM的功能和NP细胞标记的表达对NP细胞有激活影响。
本研究结果提供了更合理的证据,BMSCs对NP细胞提供了关键的保护和活化作用。需要进一步的研究,阐明分子信号中的分子机制。因此,这两种类型的细胞的相互影响的发现可能对我们理解和应用BMSCs用于椎间盘再生有一个进一步的认识。
总之,目前的研究进一步阐明MSCs和退化的NP细胞之间的相互作用的机制。我们的研究发现,在低氧条件下的BMSCs和NP细胞共同培养时,BMSCs可以保护和激活NP细胞。因此,BMSCs可能能够刺激退化的NP细胞自我修复。这为种治疗IVD提供了新的思路。BMSCs和NP细胞共培养可以保护NP细胞。然而,我们还需要进一步研究BMSCs在共培养过程中保护和激活NP细胞的分子机制。
[1]Freemont AJ,Watkins A,Le Maitre C,et al.Current understanding of cellular and molecular events in intervertebral disc degeneration:implications for therapy.J Pathol,2002, 196(4):374-379.
[2]Chung SA,Khan SN,Diwan AD.The molecular basis of intervertebral disk degeneration.Orthop Clin North Am, 2003,34(2):209-219.
[3]Hutton WC,Toribatake Y,Elmer WA,et al.The effect of compressive force applied to the intervertebral disc in vivo. A study of proteoglycans and collagen.Spine(Phila Pa 1976),1998,23(23):2524-2537.
[4]Lotz JC,Chin JR.Intervertebral disc cell death is dependent on the magnitude and duration of spinal loading.Spine (Phila Pa 1976),2000,25(12):1477-1483.
[5]Kuo YJ,Wu LC,Sun JS,et al.Mechanical stress-induced apoptosis of nucleus pulposus cells:an in vitro and in vivorat model.J Orthop Sci,2014,19(2):313-322.
[6]Richardson SM,Walker RV,Parker S,et al.Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells,2006,24(3):707-716.
[7]Brisby H,Tao H,Ma DD,et al.Cell therapy for disc degeneration--potentials and pitfalls.Orthop Clin North Am, 2004,35(1):85-93.
[8]Nishimura K,Mochida J.Percutaneous reinsertion of the nucleus pulposus.An experimental study.Spine(Phila Pa 1976),1998,23(14):1531-1538.
[9]Ganey T,Libera J,Moos V,et al.Disc chondrocyte transplantation in a canine model:a treatment for degenerated or damaged intervertebral disc.Spine(Phila Pa 1976),2003, 28(23):2609-2620.
[10]Mochida J,Sakai D,Nakamura Y,et al.Intervertebral disc repair with activated nucleus pulposus cell transplantation: a three-year,prospective clinical study of its safety.Eur Cell Mater,2015,29:202-212.
[11]Sun Z,Luo B,Liu ZH,et al.Adipose-derived stromal cells protect intervertebral disc cells in compression:implications for stem cell regenerative disc therapy.Int J Biol Sci, 2015,11(2):133-143.
[12]Steck E,Bertram H,Abel R,et al.Induction of intervertebral disc-like cells from adult mesenchymal stem cells. Stem Cells,2005,23(3):403-411.
[13]Lu ZF,Zandieh Doulabi B,Wuisman PI,et al.Differentiation of adipose stem cells by nucleus pulposus cells:configuration effect.Biochem Biophys Res Commun,2007,359 (4):991-996.
[14]Risbud MV,Albert TJ,Guttapalli A,et al.Differentiation of mesenchymal stem cells towards a nucleus pulposus-like phenotype in vitro:implications for cell-based transplantation therapy.Spine(Phila Pa 1976),2004,29(23):2627-2632.
[15]Crevensten G,Walsh AJ,Ananthakrishnan D,et al.Intervertebral disc cell therapy for regeneration:mesenchymal stem cell implantation in rat intervertebral discs.Ann Biomed Eng,2004,32(3):430-434.
[16]Zhang YG,Guo X,Xu P,et al.Bone mesenchymal stem cells transplanted into rabbit intervertebral discs can increase proteoglycans.Clin Orthop Relat Res,2005,(430): 219-226.
[17]Sakai D,Mochida J,Iwashina T,et al.Differentiation of mesenchymal stem cells transplanted to a rabbit degenerative disc model:potential and limitations for stem cell therapy in disc regeneration.Spine(Phila Pa 1976),2005,30 (21):2379-2387.
[18]Vadalà G,Studer RK,Sowa G,et al.Coculture of bone marrow mesenchymal stem cells and nucleus pulposus cells modulate gene expression profile without cell fusion.Spine (Phila Pa 1976),2008,33(8):870-876.
[19]Yamamoto Y,Mochida J,Sakai D,et al.Upregulation of the viability of nucleus pulposus cells by bone marrow-derived stromal cells:significance of direct cell-to-cell contact in coculture system.Spine(Phila Pa 1976),2004,29(14): 1508-1514.
[20]Gruber HE,Johnson TL,Leslie K,et al.Autologous intervertebral disc cell implantation:a model using Psammomys obesus,the sand rat.Spine(Phila Pa 1976),2002,27(15): 1626-1633.
[21]Nishimura K,Mochida J.Percutaneous reinsertion of the nucleus pulposus.An experimental study.Spine(Phila Pa 1976),1998,23(14):1531-1538.
[22]Fukuchi Y,Nakajima H,Sugiyama D,et al.Human placenta-derived cells have mesenchymal stem/progenitor cell potential.Stem Cells,2004,22(5):649-658.
[23]Ferrari G,Cusella-De Angelis G,Coletta M,et al.Muscle regeneration by bone marrow-derived myogenic progenitors.Science,1998,279(5356):1528-1530.
[24]Wu S,Suzuki Y,Ejiri Y,et al.Bone marrow stromal cells enhance differentiation of cocultured neurosphere cells and promote regeneration of injured spinal cord.J Neurosci Res,2003,72(3):343-351.
[25]Mwale F,Roughley P,Antoniou J.Distinction between the extracellular matrix of the nucleus pulposus and hyaline cartilage:a requisite for tissue engineering of intervertebral disc.Eur Cell Mater,2004,8:58-63.
[26]Yang F,Leung VY,Luk KD,et al.Mesenchymal stem cells arrest intervertebral disc degeneration through chondrocytic differentiation and stimulation of endogenous cells.Mol Ther,2009,17(11):1959-1966.
[27]Chun HJ,Kim YS,Kim BK,et al.Transplantation of human adipose-derived stem cells in a rabbit model of traumatic degeneration of lumbar discs.World Neurosurg, 2012,78(3-4):364-371.
[28]Yang X,Li X.Nucleus pulposus tissue engineering:a brief review.Eur Spine J,2009,18(11):1564-1572.
[29]Yi Z,Guanjun T,Lin C,et al.Effects of transplantation of hTIMP1-expressing bone marrow mesenchymal stem cells on the extracellular matrix of degenerative intervertebral discs in an in vivo rabbit model.Spine(Phila Pa 1976), 2014 Apr 8.[Epub ahead of print]
[30]Leung VY,Aladin DM,Lv F,et al.Mesenchymal stem cells reduce intervertebral disc fibrosis and facilitate repair.Stem Cells,2014,32(8):2164-2177.
[31]Prockop DJ.Marrow stromal cells as stem cells for nonhematopoietic tissues.Science,1997,276(5309):71-74.
[32]Kermani HR,Hoboubati H,Esmaeili-Mahani S,et al.Induction of intervertebral disc cell apoptosis and degeneration by chronic unpredictable stress.J Neurosurg Spine, 2014,20(5):578-584.
[33]Sakai D.Stem cell regeneration of the intervertebral disk. Orthop Clin North Am,2011,42(4):555-562.
[34]Mwale F,Ciobanu I,Giannitsios D,et al.Effect of oxygen levels on proteoglycan synthesis by intervertebral disc cells.Spine(Phila Pa 1976),2011,36(2):E131-E138.
[35]Stoyanov JV,Gantenbein-Ritter B,Bertolo A,et al.Role of hypoxia and growth and differentiation factor-5 on differentiation of human mesenchymal stem cells towards intervertebral nucleus pulposus-like cells.Eur Cell Mater,2011, 21:533-547.
[36]Dahia CL,Mahoney E,Wylie C.Shh signaling from the nucleus pulposus is required for the postnatal growth and differentiation of the mouse intervertebral disc.PLoS One, 2012,7(4):e35944.
[37]Bijlsma MF,Groot AP,Oduro JP,et al.Hypoxia induces a hedgehog response mediated by HIF-1alpha.J Cell Mol Med,2009,13(8B):2053-2060.
[38]Pattappa G,Li Z,Peroglio M,et al.Diversity of intervertebral disc cells:phenotype and function.J Anat,2012,221 (6):480-496.
[39]Minogue BM,Richardson SM,Zeef LA,et al.Characterization of the human nucleus pulposus cell phenotype and evaluation of novel marker gene expression to define adult stem cell differentiation.Arthritis Rheum,2010,62(12):3695-3705.
[40]Wykoff CC,Beasley NJ,Watson PH,et al.Hypoxia-inducible expression of tumor-associated carbonic anhydrases. Cancer Res,2000,60(24):7075-7083.
[41]Hu X,Zhou Y,Zheng X,et al.Differentiation of menstrual blood-derived stem cells toward nucleus pulposus-like cells in a coculture system with nucleus pulposus cells.Spine (Phila Pa 1976),2014,39(9):754-670.
[42]Han B,Wang HC,Li H,et al.Nucleus pulposus mesenchymal stem cells in acidic conditions mimicking degenerative intervertebral discs give better performance than adipose tissue-derived mesenchymal stem cells.Cells Tissues Organs, 2014,199(5-6):342-352.
Human bone mesenchymal stem cells protect nucleus pulposus cells by co-culture under hypoxia environment:an experimental study
JI Wei1,2,LI Haifeng2,CHENG Shi2,CHEN Jiahai2,XU Cheng2,LIU Yue2,HE Qing2,RUAN Dike2*
(1.Department of Orthopedic Surgery,Xijing Hospital,Fourth Military Medical University,Xi'an,710032;2.Department of Orthopedic Surgery,Navy General Hospital,Beijing 100048,China)
Background:Numerous studies about the co-culture of bone marrow mesenchymal stem cells(BMSCs)with nucleus pulposus(NP)cells have focused on the differentiation of stem cells towards NP cell phenotypes in various conditions.There are few studies on the effects of human BMSCs on the NP cells which are homologous,especially under hypoxia environment.Objec:tive:To establish a co-cultured model of human NP cells with human BMSCs which come from the same patient,so as to explore the biological effect of BMSCs on NP cells under hypoxic environment.Methods:Human NP cells and BMSCs from one patient were isolated and cultured.Then they were divided into two groups.There were only NP cells in group A,and NP cells were co-cultured with BMSCs in group B.All the cells were cultured for 14 d.The NP cells morphology of both groups was observed under optical microscope.Cell apoptosis was evaluated by flow cytometry and scanning electron microscope(SEM).Cell proliferation was assessed by cell counting kit 8(CCK8).Real-time PCR(RTPCR),western blot and immunofluorescent staining were used to determine the expression of the extracellular matrix (ECM)and NP cells special phenotype markers.Results:After cultures 14 d,NP cell adherence and elongation were found in group A under optical microscope,and the amount of the NP cells increased.The NP cells were spindle-shaped in group B.The NP cell adherence and elongation in group B were superior to that in group A,and the amount of the NP cells in group B were significantly greater than that in group A.The rate of cell apoptosis in group A was significantly higher than that in group B(P<0.05).The expression of proteoglycan(AGG),collagenⅡ(COL2),SOX-9,keratin 19(KRT19)and carbonic anhydraseⅫ(CA12)and hypoxia-inducible factor(HIF)increased under co-culture and hypoxic environment.RTPCR showed that the synthesis and secretion of these genes and proteins in group B were significantly higher than those in group A.Conclusions:BMSCs might protect or activate NP cells from apoptosis and degradation by regulating ECM and modulator genes.The protective effect of BMSCs provides an essential understanding and expands our knowledge of BM-SC therapy for intervertebral disc regeneration in the future.
Co-culture;Hypoxia;Bone Marrow Mesenchymal Stem Cells;Nucleus Pulposus Cells;Intervertebral Discs; Cell Therapy
2095-9958(2017)04-0148-06
10.3969/j.issn.2095-9958.2017.02-14
*通信作者:阮狄克,E-mail:ruandikengh@163.com
