氮化碳的梯度热分解法制备与产氢研究
2017-09-12代宏哲高续春张俊霞梁颖樊君
代宏哲,高续春,张俊霞,梁颖,樊君
氮化碳的梯度热分解法制备与产氢研究
代宏哲1,高续春1,张俊霞2,梁颖1,樊君3
(1. 榆林学院 化工学院,陕西 榆林 719000; 2. 榆林学院 能源工程学院,陕西 榆林 719000; 3. 西北大学 化工学院,陕西 西安 710069)
以三聚氰胺为原料,采用梯度升温热解法制备了石墨状氮化碳(g-C3N4),采用 XRD、XPS、FTIR、SEM及UV-Vis、PL等技术手段对氮化碳材料的微观结构和光学性能进行了表征,并分析其光解水产氢性能。结果表明:采用梯度升温热解法制备的g-C3N4结构良好;620 °C才开始快速分解,对热稳定性良好;几乎不溶于常见试剂,化学稳定性较好;在400~550 nm的可见光波长范围内对可见光有着明显吸收,禁带宽度达到2.42 eV,具有较高的光催化分解水制氢能力(18.95 μmol/h).
产氢;石墨状氮化碳;光催化
光催化反应作为一种绿色、高效的解决能源危机和环境污染问题的有效方法受到越来越多的工业化国家和学者的重视,发展廉价、高效、光响应范围宽广的光催化材料是该领域的核心课题[1]。最近,石墨型氮化碳(g-C3N4)材料因价廉易得、光热稳定性良好、能带结构独特等特点逐渐成为光催化领域内研究热点[2,3]。E.G.Gillan[4]在185 ℃通过加热分解叠氮类化合物三叠氮化三聚氰(Cyanuric triazide)合成了球状g-C3N4;Antonietti课题组[5]以单氰胺为前驱体在500~600 ℃条件下,利用热分解得到具有石墨状结构氮化碳;Wang等[6]以双氰胺为前驱体在550 ℃条件下,利用热分解得到具有石墨状结构氮化碳,该氮化碳具有较大的比表面积,光催化活性也较高。此后,国内外研究者在氮化碳的制备和改性方面取得了较大进展[7-15]。
但以三聚氰胺为原料,采用梯度温升程序制备石墨氮化碳的研究报道相对较少,本文拟采用三聚氰胺为反应物,以梯度温升热分解法合成石墨状氮化碳(g-C3N4),并对其进行相关表征。
1 实验部分
1.1 试剂与仪器
三聚氰胺(分析纯)、三乙醇胺(分析纯)等均购自国药试剂。
采用Rigaku D/max-3c X射线衍射仪(日本理学)、Thermo ESCALAB 250 X射线光电子能谱仪(美国赛默飞世尔)、Bruker VERTEX 70傅里叶变换红外光谱仪(德国布鲁克)、JEOL JSM 6390扫描电子显微镜(日本电子)、Nova2000e型比表面积测定仪(美国康塔)、Shimadzu UV-3600紫外可见分光光度计(日本岛津)、F-7000荧光分光光度计(日本日立)、851TGA热重分析仪(瑞士梅特勒-托利多)等对材料结构及性能进行表征。
1.2 g-C3N4光催化剂制备
在氮气保护的手套箱内称取10 g三聚氰胺并放入带盖坩埚中,然后将坩埚迅速放置于气氛炉内,分别以10,5,2 ℃/min的升温速率将温度升至200,450,620 ℃,并在设定温度下恒温4 h之后,自然冷却至室温后取出,将样品研磨成粉末状后放于烧杯内,分别用水、乙醇、丙酮反复洗涤数次,抽滤,在丙酮溶液中超声3 h后过滤,并在真空条件下65 ℃干燥24 h,研磨并装入玻璃瓶中封存待测,记为g-C3N4t。
1.3 g-C3N4化学稳定性评价
将0.5 g g-C3N4t样品在常温常压情况下放入50 mL烧杯内,然后分别加入水、甲醇、乙醇、丙酮、苯、甲苯、氯仿、四氢呋喃、N,N-二甲基甲酰胺、乙酸乙酯、二甲基亚砜及1 M盐酸溶液、1 M硫酸溶液、1 M硝酸溶液和1 M氢氧化钠溶液等常用溶剂30 mL,并搅拌2 h,密封保存30 d,过滤,65 ℃真空干燥12 h。称量并用红外表征。
1.4 g-C3N4光催化活性评价
称0.5 g g-C3N4t粉末并将其分散于600 mL10%三乙醇胺/水溶液中,将上述溶液缓慢倒入自制的石英质光催化制氢装置内,氙灯作为可见光光源置于反应器中心位置,灯前设置滤光片,灯外设冷却水套。反应开始前,关闭反应器进料口和氢气出口,开放氮气出口,从进气口鼓入氮气,鼓气持续30 min;开启搅拌并在转速2 000 r/min下保持30 min以排除反应装置内空气并使催化剂充分被吸附。之后,开启光源,搅拌转速保持4 000 r/min使催化剂处于悬浮状态且使其能均匀接受光源辐射,反应持续25h,每隔60 min使用500 μL进样针抽取样品一次,并用气相色谱仪分析生成H2浓度。
2 结果与讨论
2.1 催化剂的结构信息分析
从 X射线衍射(XRD)结果(图1)可知,在2=27.4º (=3.23Å)和2=12.6º(=7.01Å)两处位置出现强衍射峰,说明样品结晶性较好。其中27.4º处的衍射峰最强,对应于(002)晶面,可以解读为其结构中存在类似石墨的层状结构;另外一个比较强的峰位置为12.6º,对应于(100)晶面,具有3-s-三嗪结构的melon类物质的特征峰,与文献报道一致[2]。
样品g-C3N4t主要由N、C、O三种元素组成,其含量分别为55.85%、41.76.72%、2.23%,其中C、N原子之比为0.747(表1),基本接近0.75。
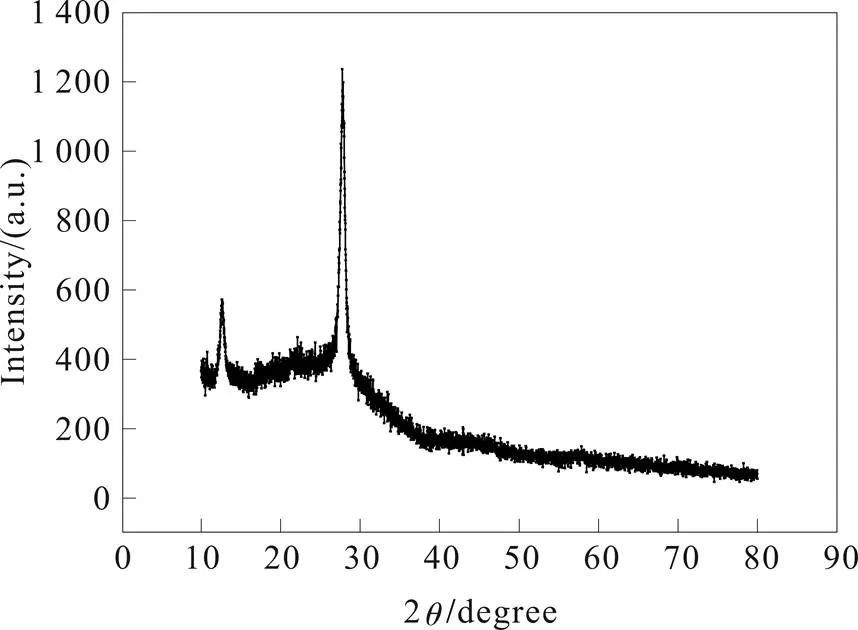
图1 热解法合成石墨状氮化碳XRD图
纳米材料一般表面积较大,很容易吸附二氧化碳、水及氧气,而且还难以去除。但相较于一般热分解法,本样品的O和其他元素含量较低,可能与梯度热解造成样品表面吸附的O2、H2O或者CO2较少有关。
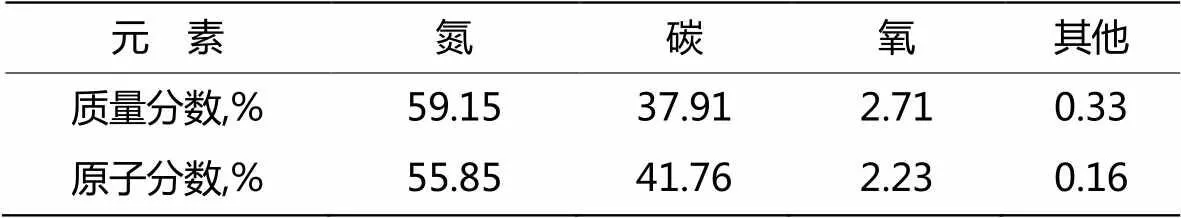
表1 样品中各元素的含量
样品的XPS总谱(图2)中,280-295和394~407 eV处有强烈衍射峰,分别归属于C、N两种原子。此外,在532.8 eV处和102.4 eV处存在有较小和非常微弱的峰,被认为是O1s和Si2p的贡献,O和Si的存在可能是由于氧气、水或者二氧化碳以及仪器的污染所致,与元素分析(表1)结果基本一致。从C1s(图3a)高分辨分谱可以看到。
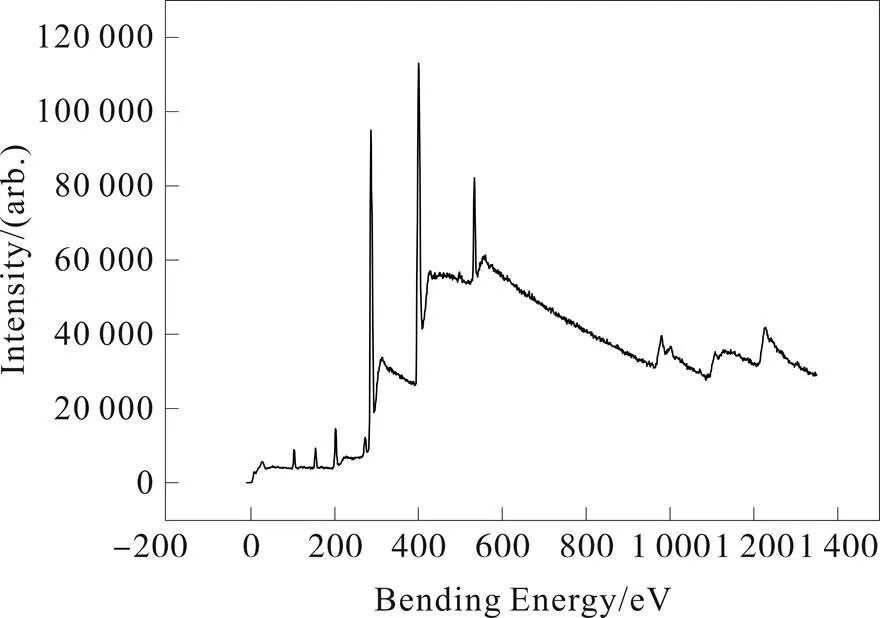
图2 热解法合成石墨状氮化碳总谱
Cls自动分裂为两个非常漂亮的峰,且每个单峰对称性都很好,位于285.72 eV处的衍射峰可以被指派为芳香环内被sp2杂化的C原子[3-6];而位于287.87 eV处的衍射峰应归属于sp3杂化C原子[5-7]。对N1s高分辨谱图,结合能分别为398.9、400.8和402.4 eV的三个并肩峰可分别指派给与3-s-三嗪环内与sp3杂化C原子相连的氮原子、与sp2杂化C原子相连的氮原子,与氧相连构成N-O键的氮原子。
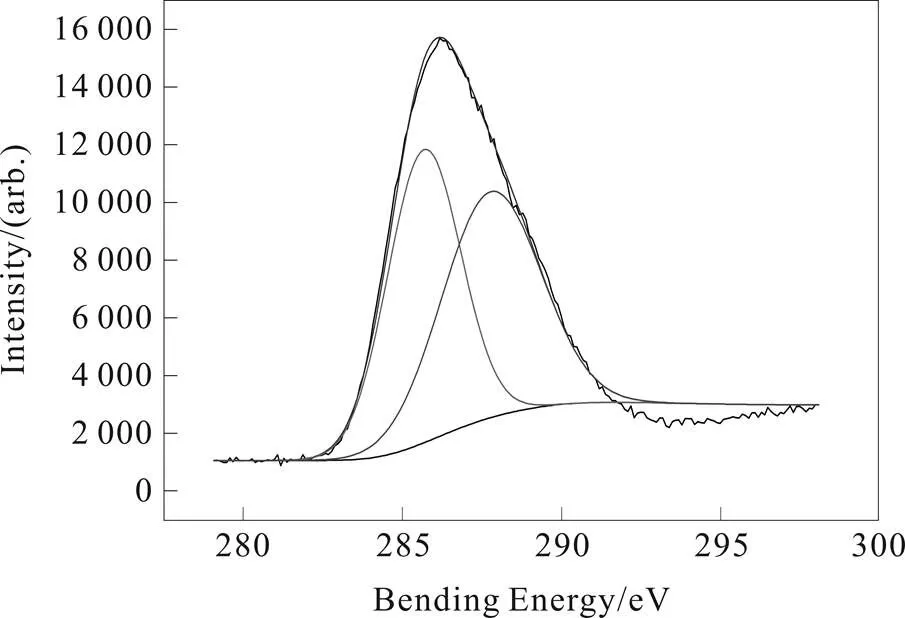
a. deconvoluted spectrum of C1s; b. deconvoluted spectrum of N1s
样品C3N4t的红外光谱吸收峰主要集中在810、1 200~1 600 和3 000~35 00 cm-1等三个区域,见图4。
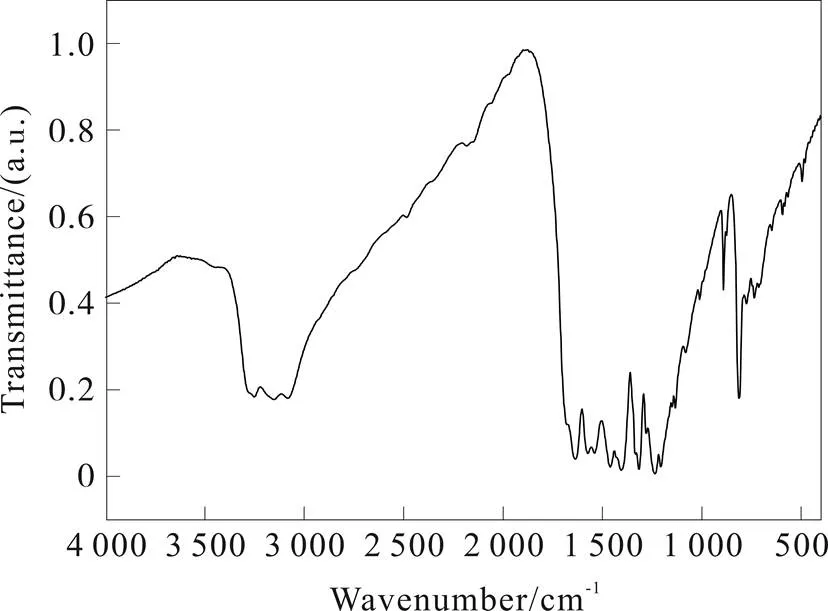
图4 热解法合成石墨状氮化碳的FTIR图
在1 200~1 600 cm-1范围内几个比较强的波峰可以与CN杂环化合物的特征峰相对应,而810 cm-1处的吸收峰则是由于3-s-三嗪环的伸缩振动所引起,3 000~3 500 cm-1宽吸收带对应于氨基或亚氨基团中N-H键的振动(也可能有羟基O-H的少量贡献),这可能与石墨状氮化碳分子内的伯胺和仲胺有关,说明层状结构的氮化碳的边缘存在着未缩聚的氨;2 200 cm-1左右的吸收很弱,证明基本没有C≡N三键或者-N=C=N-这样的累积双键存在。
通过观测SEM图(图5),可以发现氮化碳颗粒直径大约在80~100 nm的狭小区间内,粒径分布也与XRD图(图1)中存在的尖锐的衍射峰相一致。

图5 热解法合成石墨状氮化碳的SEM
2.2 催化剂的稳定性分析
从样品的热重(图6)可以看出,300 °C范围内,样品几乎没有质量损失,说明样品在300 °C内对热很稳定;在300~450 °C范围内,样品的质量损失很小,这是由于样品中吸附的水分子和挥发性组分的释放而导致部分失重;530~600 °C范围内,氮化碳开始缓慢分解,这时可能有氨气溢出;620 °C后,氮化碳开始迅速分解,直至720 °C完全分解,几乎没有残余物质剩留。
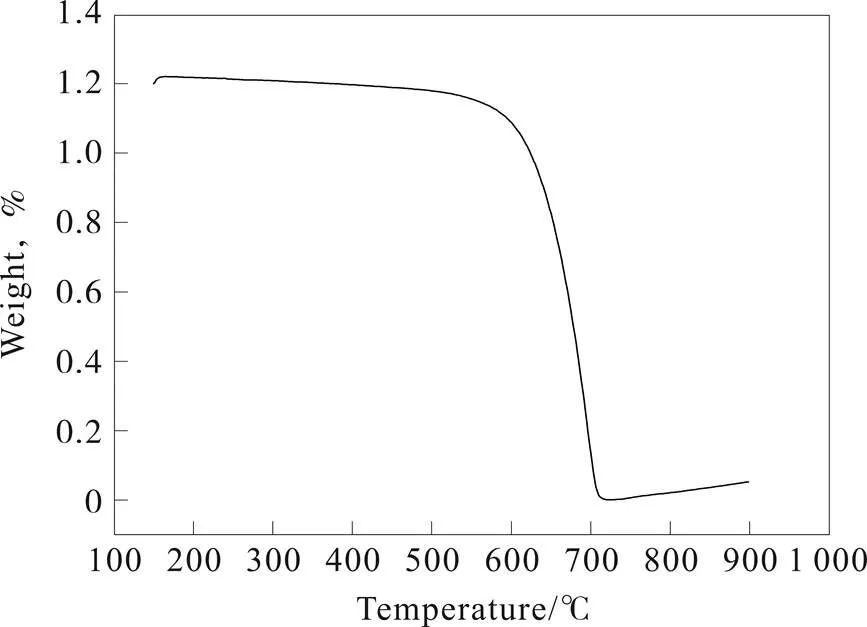
图6 热解法合成石墨状氮化碳的TGA
将g-C3N4t材料在水、甲醇、乙醇、苯、甲苯、氯仿、丙酮、乙腈、二甲基亚砜、四氢呋喃、乙酸乙酯和N,N-二甲基甲酰胺等各种常规有机溶剂浸泡,30 d后,经干燥后所测的FTIR图(图7)。可以看出,经过30 d各种溶剂的作用,大多数样品红外光谱几乎没有任何变化,这说明氮化碳在常温下几乎不跟有机物发生化学反应,耐蚀性较好。
从g-C3N4t的等温吸附-脱附线(图8)可以看出,其具有第IV型等温线的特征,并携带H1滞后环。等温线从一开始就呈线性增长态势,到相对压力达到0.7后则以指数形式上升,说明该样品主要为多层吸附,单层吸附所占比例极小。
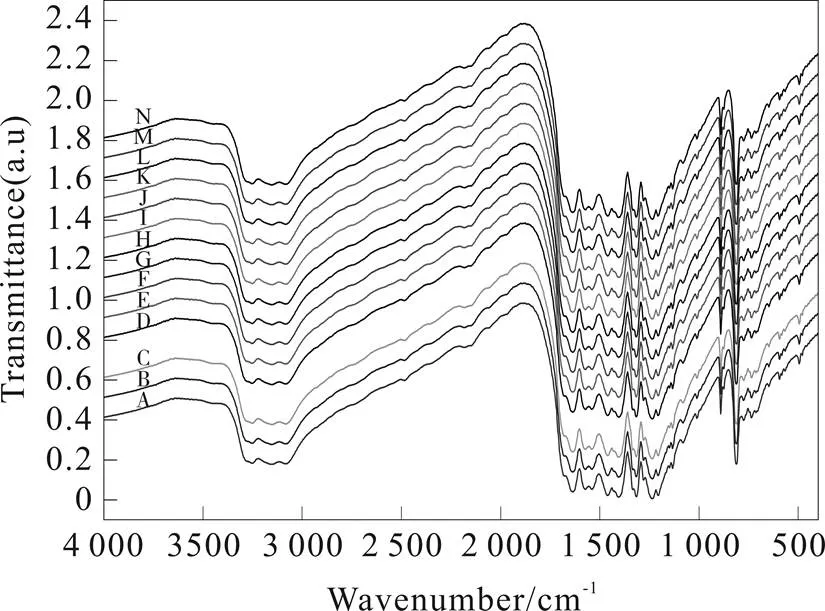
图7 热解法合成的氮化碳经过溶解处理后的红外光谱图
a. the untreated C3N4t; b.water; c.acetone;d. acetonitrile;d.toluene;f. benzene;g. DMSO;h.THF; i. carbontetrachloride;j. DMF;k. ethanol;l. chloroform;m. ethylacetate;n. methanol
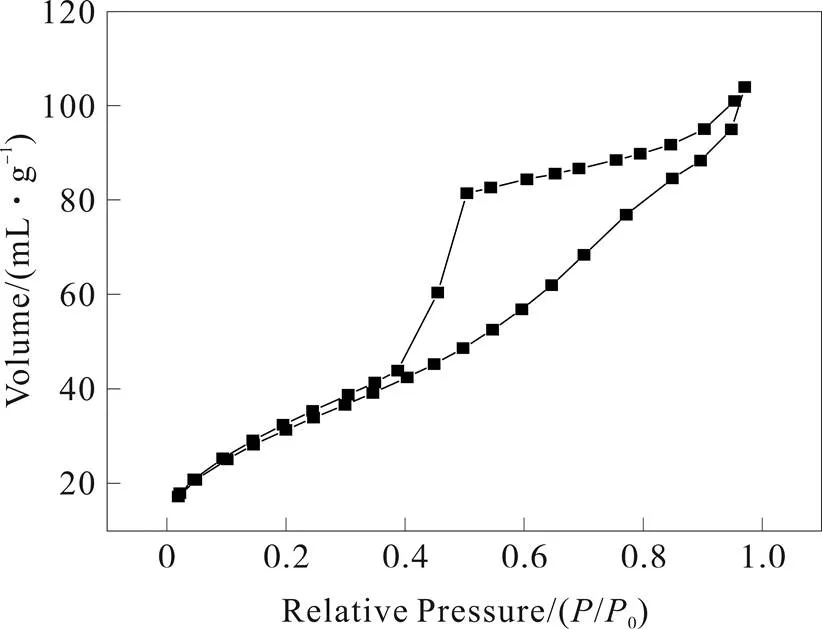
图8 热解法合成石墨状氮化碳的BET
总之,该氮化碳分子内粒子堆积方式比较整齐,孔间贯通性较好,92.5 m2/g的比表面积相也能说明此问题,其结果也与扫描电镜的结果相吻合。结合XRD、SEM分析可知,该法合成的氮化碳粒径较小,比表面积较大,分子堆积规整,内部孔径也相对较大,对该材料应用于催化剂方面较为有利。
2.3 催化剂的光学性能分析
样品的紫外可见图(图9)中,348.9 nm处出现一个强烈的紫外吸收峰,在400~650 nm范围内其对可见光吸收明显,这很可能起因于3-s-三嗪环内共轭电子引起的π–π*或者 n–π*电子转移。需要注意的是,样品在400~450 nm出现宽范围的吸收而不是比较尖锐的吸收峰,很可能是由于粒径和形状的不均匀,以及不同的共振吸收波长而导致各共振吸收峰之间的叠加。通过换算,其禁带宽度达到2.42 eV,吸收边比文献报道值[16]发生明显红移,可能与450~620 °C热解阶段的升温速率有关,较慢的升温有利于促进g-C3N4的聚合均匀化,利于拓展其π共轭体系。在280 nm光的激发下,其在380~538 nm很宽的范围内发光(图10),但总体发光强度不大。
2.4 催化剂的光催化产氢性能及稳定性分析
通过光催化水制氢来评价催化剂的光催化性能(图11)。
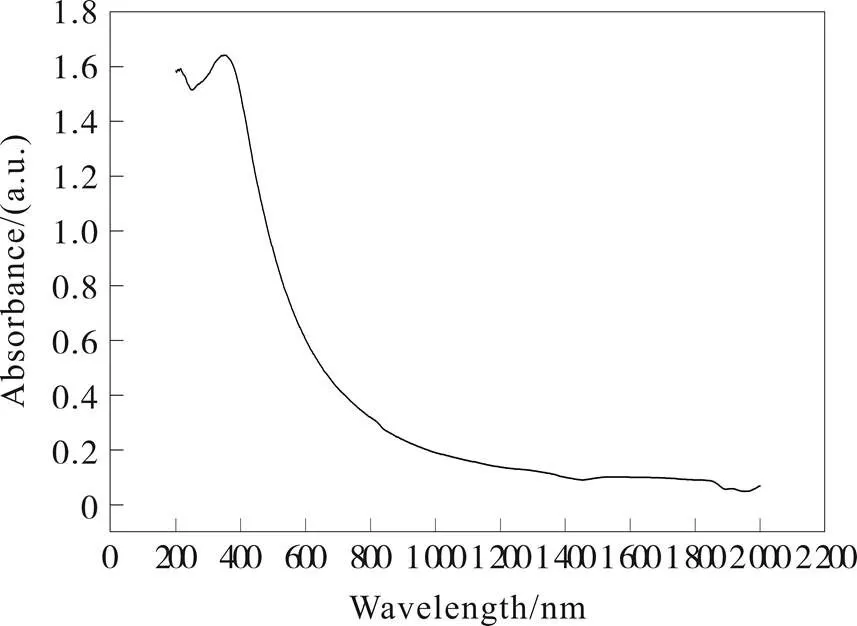
图 9 热解法合成石墨状氮化碳的UV-vis
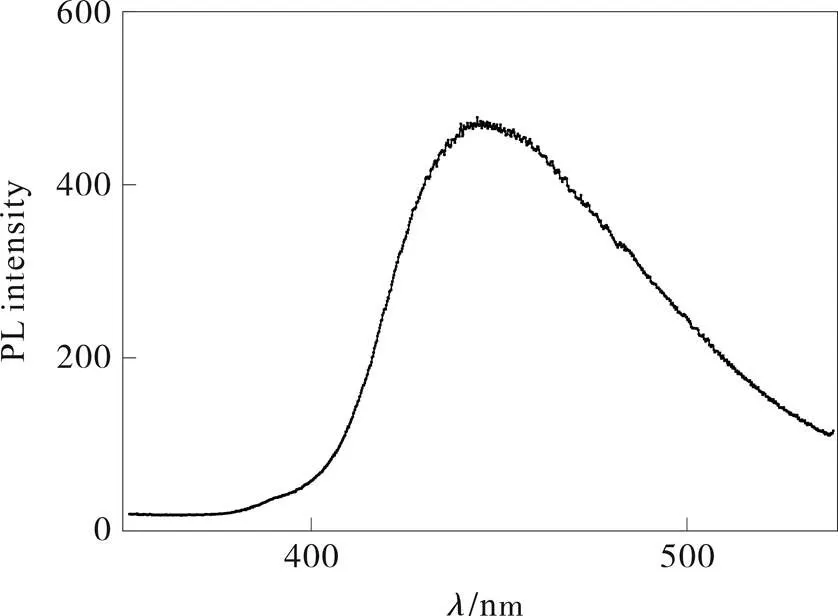
图 10 热解法合成石墨状氮化碳的PL
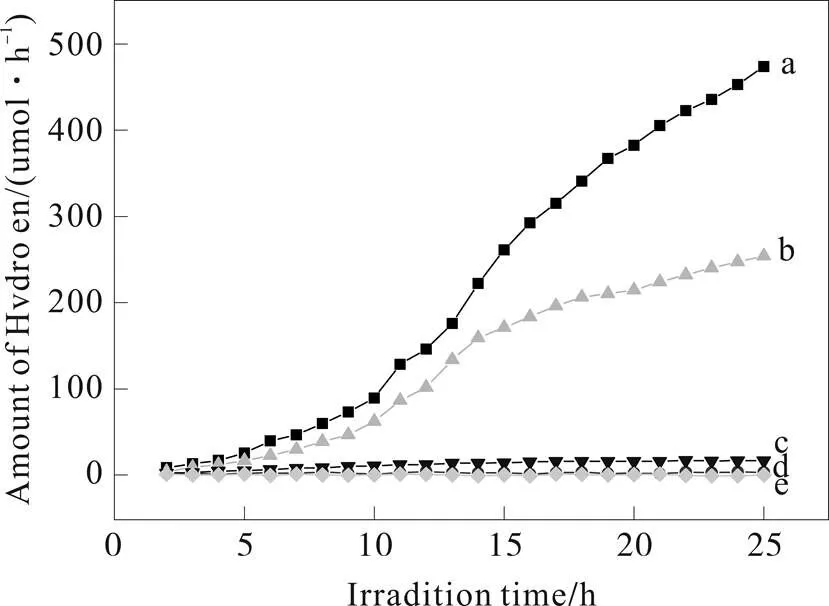
图11 g-C3N4t光解水制氢曲线
a. Pt/C3N4t+TEOA;b. C3N4t+TEOA;c. Pt+TEOA;d. Pt/C3N4t; e. dark
当反应体系缺少氮化碳时,其产氢能力大大降低,只有0.40 μmol/h(图11c),说明该光催化体系中氮化碳的决定性作用;在无光照条件下,几乎没有H2生成(图11e),说明光照对整个反应体系的重要性,也从侧面反映了g-C3N4催化体系为光能驱动,再结合催化体系无氮化碳存在就不产氢,可以得出,本实验所制的氮化碳样品的确具有光催化制氢活性;在缺少作为电子给体的牺牲剂三乙醇胺时,体系也几乎没有H2产生(图11d),这主要因为TEOA能够不可逆地消耗空穴H+,延长了光生电子寿命的同时,提升产氢效率,因而,在缺少TEOA时,光生电子的寿命大大降低,电子很难突破体相复合和表面复合限制,产氢效率大大降低;在助催化剂Pt存在的情况下,体系产氢能力高达18.95 μmol/h(图11a),主要是因为Pt具有较高的功函数和较低的费米能级,能够在Pt和g-C3N4界面处形成肖特基势垒,该势垒的存在能使光生电子较容易地从g-C3N4表面转移至Pt表面,促进了g-C3N4催化剂上光生电子空穴的分离,提高了产氢效率。当然,助催化剂Pt的存在,也为光生电子提供了第二个传递通道,同时,Pt的出现也提供了更多产氢活性位点,这些都有助于产氢效能的增加;当然,样品g-C3N4t的产氢能力比文献报道值(10.69 μmol/h)[6]大将近两倍,可能由于在催化剂制备过程中,升温速率的变化引起催化剂表面残留的氨基、羟基的减少,进而加剧光生电子-空穴的分离,也提高了光催化产氢活性。
3 结束语
以三聚氰胺为反应物,采用梯度热分解法成功合成g-C3N4。该法制备的g-C3N4在400~550 nm的可见光波长范围内对可见光有着明显的吸收,比表面积为92.5 m2/g,光催化分解水制氢能力达18.95 μmol/h,即具有更大的比表面积、更广的可见光吸收范围和更强的光催化活性,有潜在应用价值。为了弄清梯度法合成的g-C3N4具有更好性能的原因,下一步准备研究合成过程中不同温度段的g-C3N4具体结构及升温速率与结构间的内在联系。
[1]Kudo A., Miseki Y. Heterogeneous photocatalyst materials for water splitting[J]. Chem. Soc. Rev., 2009, 38:253-278.
[2]Wang X.C., Maeda K., Takanabe K., Antonietti M., et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light[J]. Nat. Mater., 2009, 8:76-80.
[3]Zhang P., Wang M., SunL.C., et al. Photochemical H2production with noble-metal-free molecular devices comprising a porphyrin photosensitizer and a cobaloxime catalyst[J]. Chem. Commun., 2010, 46: 8806-880.
[4]Gillan E G. Synthesis of nitrogen-rich carbon nitride networks from an energetic molecular azide precursor[J]. Chemistry of materials, 2000, 12(12): 3906-3912
[5]Zhang J, Zhang G, Chen X, et al. Co-Monomer Control of Carbon Nitride Semiconductors to Optimize Hydrogen Evolution with Visible Light[J]. Angewandte Chemie, 2012, 124(13): 3237-3241
[6]Wang X, Maeda K, Thomas A, et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light[J]. Nature Materials, 2008, 8(1): 76-80
[7]Zhang X. D., Xie X., Wang H., et al. Enhanced photoresponsive ultrathin graphitic-phase C3N4nanosheets for bioimaging[J]. J. Am. Chem. Soc., 2013, 135:18-21.
[8]Cheng N. Y., Jiang P., Liu Q., et al. Graphitic carbon nitride nanosheets: one-step, high-yield synthesis and application for Cu2+detection [J]. Analyst, 2014, 139: 5065-5068.
[9]Zhao Z.K., Lin J.H., Wang G.R., et al. Highly-Ordered Mesoporous Carbon Nitride with Ultrahigh Surface Area and Pore Volume as a Superior Dehydrogenation[J]. Catalyst Chem. Mater., 2014, 26(10): 3151-3161.
[10]Li Z., Wu Y.Q., Lu G.X. Highly efficient hydrogen evolution over Co(OH)2nanoparticles modified g-C3N4co-sensitized by Eosin Y and Rose Bengal under Visible Light Irradiation[J]. Applied Catalysis B: Environmental, 2016, 188(5): 56-64.
[11]Wang G.Q., Kuang S., Zhang J., et al. Graphitic carbon nitride/ multiwalled carbon nanotubes composite as Pt-free counter electrode for high-efficiency dye-sensitizedsolar cells[J]. Electrochimica Acta, 2016, 187(1):243-248.
[12]Wang G.Q., Zhang J., Hou S. g-C3N4/conductive carbon black composite as Pt-free counter electrode in dye-sensitized solar cells[J]. Materials Research Bulletin, 2016, 76, 454-458.
[13]Oh Y.T., Le V.D., Kim Y.H., Kim S. O., et al. Selective and Regenerative Carbon Dioxide Capture by Highly Polarizing Porous Carbon Nitride[J]. ACS Nano, 2015, 9(9): 9148–9157.
[14]Dontsova D., Fettkenhauer C., Antonietti M., et al. 1,2,4-triazole- based approach to noble metal free visible-light driven water splitting over carbon nitrides[J]. Chem. Mater., 2016, 28(3): 772-778.
[15]Chen S., Wang C.,Wang C.Y., Zang L., et al. Enhancement ofvisible- light-driven photocataly- tic H2evolution from water over g-C3N4through combination with perylene diimide aggregates[J]. Appl. Catal., A: 2015, 498:63–68.
[16]Tyborski T., Merschjann C., Orthmann S., et al. Tunable optical transition in polymeric carbon nitrides synthesized via bulk thermal condensation[J]. J.Phys.Conden.Matter, 2012, 24(16):162-201.
Research on Synthesis of g-C3N4by Gradient Pyrolysis Method and Its Photocatalytic Hydrogen Production Performance
1,1,2,1,3
(1. College of Chemical Engineering, Yulin University, Shaanxi Yulin 719000, China;2. College of Energy Engineering, Yulin University, Shaanxi Yulin 719000, China;3. College of Chemical Engineering, Northwestern University, Shaanxi Xi’an 710069, China)
Graphitic carbon nitride materials (g-C3N4) with high visble-light response were prepared from melamine by gradient pyrolysis method. XRD, XPS, FT-IR, SEM and UV-Vis, PL were employed to investigate the crystal phases, composition and chemical states, micrographs of the materials. Also, the light absorption and photocatalytic activity of g-C3N4for hydrogen production were studied. The results indicate that g-C3N4can be successfully prepared by gradient pyrolysis method, and it has many characteristics, such as good structure, goodheat stability and good chemical stability; In visible wavelength range of 400~550 nm, g-C3N4can obviously absorb visible light, and the band gap is about 2.42 eV which means efficient visible light absorption, and hydrogen yield can reach to 18.95 μmol/h.
Hydrogen production; Graphitic carbon nitride; Photocatalysis
TQ426.91
A
1671-0460(2017)08-1538-05
国家自然基金,项目号21476183; 陕西省教育厅科学研究计专项,项目号15JK1846;榆林学院博士科研启动基金,项目号:16GK09。
2017-05-27
代宏哲(1974-),男,陕西西安人,讲师,博士,2013年毕业于西北大学化学工程专业,研究方向:从事纳米材料工作。E-mail:daihongzhe@126.com。
