山茶花提取物对海马神经元缺氧损伤的保护作用
2017-09-12卢炜卓褚世居
卢炜卓,陈 攻,王 慧,褚世居
(合肥职业技术学院, 合肥238000)
山茶花提取物对海马神经元缺氧损伤的保护作用
卢炜卓,陈 攻,王 慧,褚世居
(合肥职业技术学院, 合肥238000)
通过研究山茶花提取物(extract of Camellia japonica L, ECJ)对海马神经元缺氧损伤是否具有保护作用,探讨其可能机制;取胎鼠海马神经元原代培养,缺氧3 h/复氧24 h后,细胞存活率、培养上清液中乳酸脱氢酶( lactate dehydrogenase,LDH)活力检测作为细胞损伤指标;通过检测细胞内游离Ca2+浓度进行可能的机制探讨;结果显示,与单独使用ECJ相比,ECJ联合大脑中动脉血管( middle cerebral artery,MCA)段明显抑制缺氧海马神经元存活率降低,显著降低培养上清液中的LDH活性和海马神经元细胞内的游离Ca2+的增高;NO合酶抑制剂N-nitro-L-arginine-methyl-ester(L-NAME) 或者PGI2抑制剂indomethacin(Indo)对ECJ的作用并无显著影响;乙酰胆碱( acetylcholine,Ach)作为阳性对照,具有相似的保护作用;研究表明ECJ对缺氧复氧致神经细胞损伤有一定的保护作用,其机制可能涉及血管内皮,促进内皮源性超极化因子(Endothelium-derived hyperpolarizing factor,EDHF)的释放。
山茶花提取物; 缺氧复氧损伤; LDH; 钙超载; EDHF; 海马神经元
脑细胞对缺血缺氧的耐受性极差,并且较易发生不可逆损伤,特别是缺氧后复氧性损伤将给脑细胞带来致命的打击,急性脑缺血缺氧是围手术期死亡及手术后中枢神经系统疾病并发症的最主要原因,故脑缺血缺氧损伤一直是研究的热点之一[1-3]。
ECJ是山茶花中的有效成分,我们以往的研究表明ECJ对小鼠脑缺血再灌注损伤有明显保护作用[4],为了更进一步探讨其作用机制,我们以原代培养的海马神经细胞为研究对象,建立缺氧复氧性损伤模型,以细胞存活率、培养上清中LDH的活力以及胞浆游离Ca2+浓度的变化为观察指标,研究ECJ对神经细胞缺氧复氧性损伤的保护作用,并与乙酰胆碱(Acetylcholine,Ach)刺激血管内皮细胞释放EDHF的保护作用比较,对其可能的机制进行探讨。
1 材料与方法
1.1 药品与试剂
ECJ是用乙醇提取法提取山茶花中的有效成分,实验前用生理盐水配成所需浓度;吲哚美辛(indomethacin, Indo)、左旋硝基精氨酸甲酯(N-nitro-L-arginine-methyl-ester, L-NAME)、Neurobase medium、Fluo-3AM、B27:二甲亚砜(Dimethyl sulfoxide,DMSO)、四甲基偶氮唑盐(2,5-diphenyltetrazolium bromide, MTT)、多聚赖氨酸均购自Sigma公司;胎牛血清购自杭州四季青生物工程材料有限公司;LDH试剂盒购自南京建成生物工程研究所。
1.2 动物
清洁级SD大鼠,体重220 g左右,由安徽医科大学实验动物中心提供。
1.3 方法
1.3.1 海马神经元原代培养[5]
乙醚麻醉孕期为18天的SD大鼠,无菌条件下取出胎鼠,解剖分离出海马,加入预冷的无钙镁D-Hanks液,剪碎海马组织后加入胰蛋白酶(终浓度0.25 %),在37 ℃培养箱中消化10~15 min,不断震荡以促进消化,加入胎牛血清(终浓度为10 %)终止消化过程,离心弃上清,随后使用适量的含胎牛血清的D-Hank洗涤细胞2次,并用200目不锈钢网过筛,收集滤液,离心弃上清,用NB培养液重悬细胞后细胞计数,配制成5×105/L/细胞悬液,加入预先用0.01 %多聚赖氨酸包被过夜的24孔培养板中, 5 % CO237℃培养。
1.3.2 海马神经元缺氧/复氧损伤模型的建立[2]
待海马细胞铺满单层后,将培养板放置于密闭容器内,于37 ℃培养箱中通入N2进行缺氧,3 h后移入正常氧含量的CO2培养箱中再给氧24 h。
1.3.3 实验分组
海马细胞铺满单层后,分为6个实验组:正常组。海马细胞孔内加入一段长度为3 mm左右的MCA;模型组。海马细胞孔内加入MCA;Ach+Indo+L-NAME组。分别加入终浓度为1 umol/L的Ach和10 umol/L的Indo和300 umol/L的L-NAME +MCA;ECJ组。加入终浓度为60 mg/L的ECJ;ECJ+血管组。加入终浓度为60 mg/L的ECJ +MCA;ECJ+Indo+血管组。分别加入终浓度为60 mg/L的ECJ和10 umol/L的Indo 和300 umol/L的L-NAME +MCA。将上述海马神经细胞(正常组除外)行缺氧复氧处理。
实验结束后收集培养上清液,按试剂盒说明书测LDH的活力,MTT法进行细胞活力分析,测各孔吸光度(λ=490 nm),并按以下公式计算存活率:细胞存活率(% )= 各组OD值/正常对照组OD值×100 %。
1.3.4 激光共聚焦测定细胞内游离Ca2+浓度
每孔加入300 ul D-Hank’s液(含0.03 %F-127和终浓度5 umol/L的Fluo3),37 ℃孵育60 min,为了使染料均匀进入细胞,孵育期间需多次震荡,然后用D-Hank’s轻柔洗细胞3出,去除多余的染料,最后每孔加入1 mlD-Hank's,在激光共聚焦显微镜下探测荧光发射、扫描。每孔选5个视野,随机取15个细胞,应用软件计算平均荧光灰度值,反映细胞内游离Ca2+浓度的相对水平。
1.4 统计学方法
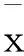
2 结果
2.1 ECJ对神经细胞缺氧复氧损伤的影响
与正常组比较,模型组海马神经元存活率明显降低,LDH漏出至培养上清明显升高(p <0.01)(见表1),说明缺氧3 h/复氧24 h可以导致海马神经细胞损伤;而与模型组比较,Ach +MCA组海马神经元存活率明显提高,上清液中LDH水平有显著下降,不受NO和PGI2合成抑制剂L-NAME和Indo影响,除此之外,Ach本身对海马细胞损伤没有明显的影响。说明Ach刺激血管内皮细胞释放的EDHF对神经细胞缺氧复氧损伤有明显的保护作用。
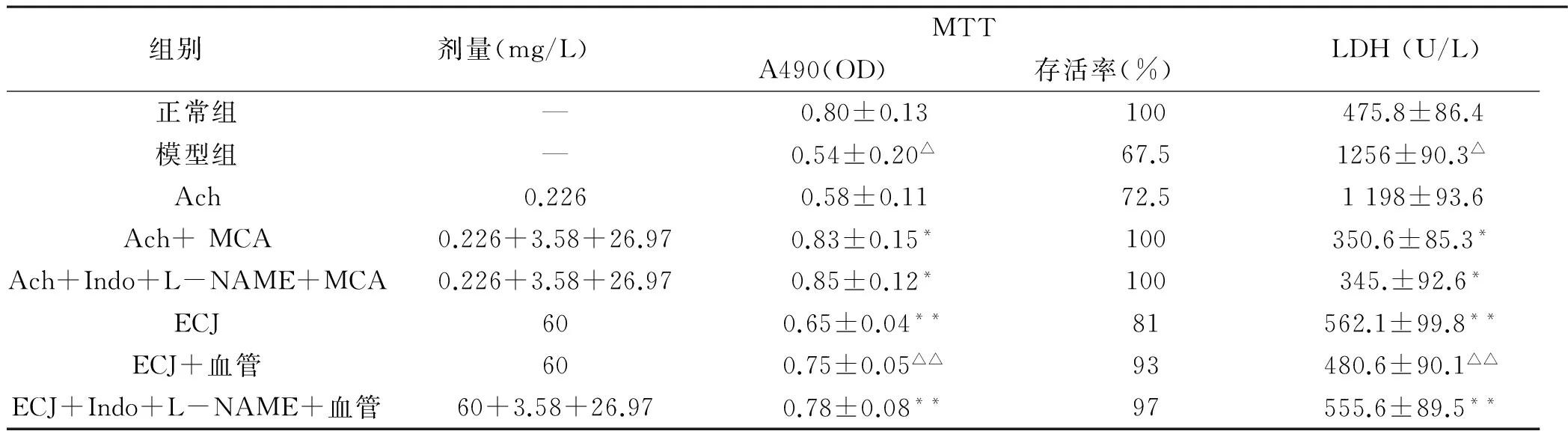
表1 ECJ对海马神经元存活率的影响及培养上清液中LDH活力的影响(x±s, n=8)
与正常组相比,Δp<0.01; 与模型组相比,*p<0.01
60 mg/L ECJ单独存在,显著增加神经元存活率、降低上清液中LDH活力,说明ECJ对神经细胞有直接保护作用,而60 mg/LECJ联合MCA,能进一步使神经元的存活率增加和降低上清液中LDH活力,与Ach联合MCA相似,同样不受Indo和L-NAME的抑制,与ECJ单独组比较,差异有显著性(p<0.05),提示ECJ的保护作用可能与刺激内皮细胞释放EDHF有关。
2.2 ECJ对神经细胞内游离Ca2+的影响
与正常组比较,模型组神经元细胞内的游离Ca2+浓度明显升高(p<0.01)(见表2),在Ach中加入MCA后,显著降低细胞内游离Ca2+浓度,与Ach单独组比较,差异有显著性(p<0.05),同样不被Indo和L-NAME抑制。而60 mg/L ECJ亦可降低神经细胞内的游离Ca2+浓度,ECJ联合MCA可以进一步降低神经细胞内的游离Ca2+浓度,与ECJ单独组比较,有显著性差异(p<0.05)。
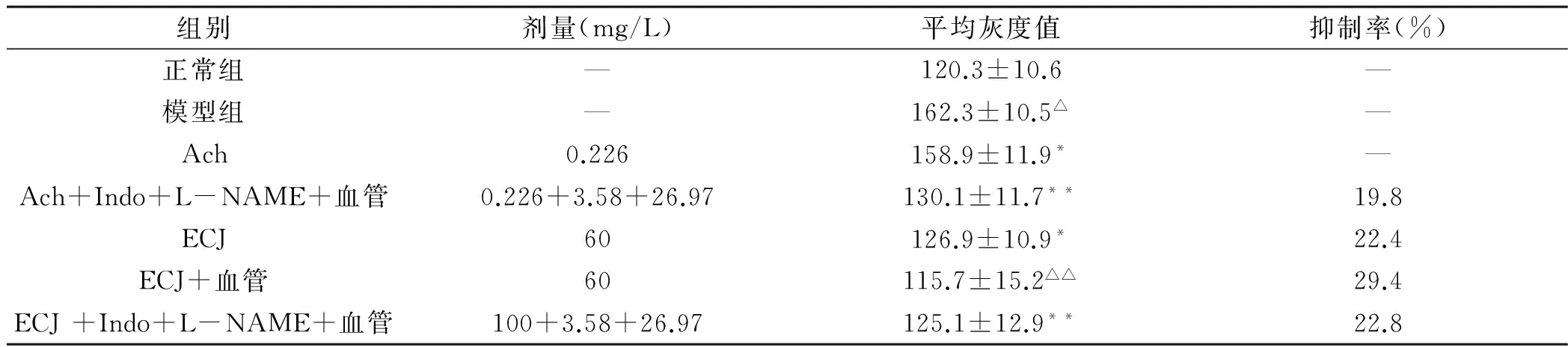
表2 ECJ加血管对神经细胞内的Ca2+影响(x±s, n=8)
与正常组相比,Δp<0.01; 与模型组相比较,**p,△△p <0.01; 与ECJ组相比较,△△p <0.05
3 讨论
缺氧后的神经细胞,由于能量缺乏、钙离子超载、细胞膜通透性增加均会导致细胞损伤甚至死亡,而复氧后细胞损伤仍会继续一段时间。LDH为细胞浆内酶,如果细胞膜破坏则会漏出,因此体内血清LDH或体外培养上清液中LDH是反映细胞功能状态较敏感的生化指标之一。本实验结果显示海马神经元缺氧复氧后,培养上清液中的LDH活力明显升高,同时细胞存活率明显降低,均为细胞缺氧损伤的有力依据。以往的文献资料显示,Ach作用于内皮细胞乙酰胆碱激活蛋白,可介导EDHF释放[6],多采用NO 、PGI2合成抑制剂排除NO和PGI2作用后,利用Ach释放EDHF[7]。EDHF是内皮细胞释放的一类既不同于PGI2,也不同于NO的活性成分,可激活平滑肌细胞钙依赖性钾通道,诱导细胞电位超级化,内皮依赖性舒血管反应。本研究我们发现Ach联合脑血管对缺氧复氧损伤的神经细胞有明显保护作用,且不被Indo或者L-NAME减弱。而给予ECJ预处理对缺氧细胞具有明显的保护作用,表现为细胞培养上清液LDH活性明显降低,细胞存活率明显升高。ECJ联合血管段则对细胞损伤的保护作用进一步增强,即培养上清液LDH活性降低和海马神经细胞存活率增加更为明显,并且不被Indo或者L-NAME改变。结合以上结果, ECJ对细胞缺氧复氧损伤具有血管内皮依赖性的保护作用。
为了进一步探讨,ECJ对海马神经细胞缺氧损伤保护作用机制,我们应用激光共聚焦技术检测细胞内游离Ca2+浓度的改变,因为以往有关于神经细胞缺血缺氧时,钙超载可激发作为第二信使的一系列酶反应对细胞产生损害[8],而抑制细胞内钙超载,可阻止调亡的发生[9]的报道。本实验研究发现:在海马神经元缺氧复氧模型上,Ach加血管组,以及ECJ加血管组均可显著降低神经细胞内的游离Ca2+浓度,并且不受NO和PGI2合成抑制的影响,提示ECJ对海马神经元缺氧复氧损伤的保护作用机制,介导血管内皮释放EDHF,抑制细胞内钙超载有密切的关系。
[1] 黄小平,邓常清,邱咏园.黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血/再灌注后氧化应激和 Nrf2 /HO-1 途径的影响[J].中国药理学通报, 2013(11):1596-1601.
[2] 贺旭, 葛金文, 黄俊,等.三七总皂苷对全脑缺血成年大鼠侧脑室室管膜区神经再生的影响[J].中草药, 2016(9):1535-1540.
[3] 佘颜,王宇红,邵乐,等. 补阳还五汤精简方对大鼠脑缺血后血管新生及 Nrf2 /HO-1信号途径的影响[J].中国药理学通报,2016(2):123-128.
[4] 卢炜卓, 文继月, 陈攻,等.山茶花提取物预处理对小鼠脑缺血损伤的影响[J].铜陵职业技术学院学报,2013(1):27-29.
[5] 吴剑,陈志武.乙酰胆碱介导的内皮超极化因子对海马神经元缺氧/再给氧损伤的保护作用[J].中国药理学通报, 2007(12):1624-1629.
[6] 韩黎黎.映山红花总黄酮对全脑缺血再灌注大鼠脑基底动脉超极化反应的诱导作用[J].中草药,2011(6):1164-1168.
[7] Han J,Chen ZW,He GW.Acetylcholine- and sodium hydrosulfide-induced endothelium-dependent relaxation and hyperpolarization in cerebral vessels of global cerebral ischemia-reperfusion rat[J].J Pharmacol Sci,2013(4):318-326.
[8]Xie J,Guo Q,Zhu H,et al.Protein kinase C iota protect neural cell against apoptosis induced by amyloid beta-peptide[J].Brain Res,2000(1/2):107-113.
[9]Takel N,Endo Y.Ca2+ionophre-induced apoptosis on cultured embryonic rat cortical neurons[J].Brain Res,1994(1):65-70.
2017-04-07
合肥职业技术学院自然科学类重点资助(项目编号:zrzd201103)
卢炜卓(1978-),男,安徽巢湖人,讲师,研究方向为心血管药理学,电话:18256510760。
R285
B
1671-4733(2017)04-0008-03
