利用酵母单杂交筛选拟南芥AtSTK基因表达调控蛋白的研究
2017-09-12田梦涵任媛媛黄占景葛荣朝
杨 歌,惠 颖,赵 翠,田梦涵,任媛媛,黄占景,葛荣朝
(1. 河北师范大学 生命科学学院,河北 石家庄 050024;2. 石药集团 中奇制药技术有限公司,河北 石家庄 050035)
利用酵母单杂交筛选拟南芥AtSTK基因表达调控蛋白的研究
杨 歌1,惠 颖2,赵 翠1,田梦涵1,任媛媛1,黄占景1,葛荣朝1
(1. 河北师范大学 生命科学学院,河北 石家庄 050024;2. 石药集团 中奇制药技术有限公司,河北 石家庄 050035)
拟南芥丝氨酸/苏氨酸蛋白激酶基因AtSTK的过量表达可以明显提高拟南芥的耐盐性。为进一步研究AtSTK基因表达的调控机制,以拟南芥基因组DNA为模板设计引物,扩增获得AtSTK基因的启动子序列,并构建到报告载体pAbAi,将重组报告载体质粒pAbAi-HYT利用BstbⅠ进行单酶切线性化,转化酵母菌株Y1H Gold,线性化的pAbAi-HYT整合到基因组中。然后,将纯化的拟南芥双链cDNA、pGADT7-Rec载体共转化含有报告载体pAbAi-HYT的酵母菌,将菌液涂布到含有100 ng/mL AbA的SD/-Leu培养基上进行阳性克隆的酵母单杂交筛选。通过回复鉴定、序列测定,最终筛选获得了可能参与AtSTK基因表达调控的4个拟南芥基因。测序结果表明,酵母单杂交筛选获得的拟南芥基因AT3G32090含有WRKY转录因子保守结构域,为WRKY类转录因子的一员。因此,AtSTK基因的表达很可能接受MAPK信号传导途径中AT3G32090基因编码的WRKY类转录因子的调控,从而影响拟南芥植株的耐盐性。
AtSTK;启动子;表达调控蛋白;酵母单杂交
目前土地的盐渍化程度在不断加重,盐胁迫主要是通过渗透胁迫、离子伤害等过程损伤植物,最显著的效应就是抑制植株生长[1-3]。所以土地的盐渍化严重影响了生态环境和农业生产,导致了粮食和经济作物减产。除了通过改良土壤减少盐碱地之外,我们还可以利用基因工程的手段,通过分子生物学方法,培育出高产耐盐的作物品种来达到改造和利用盐碱地的目的。目前国内外的学者对植物耐盐机制及耐盐相关基因等方面都进行了大量的研究,在各个研究领域均取得了长足的进展。
植物体在受到盐胁迫的情况下,会激活或启动体内一系列的生物化学反应,从而对植物的生理变化进行调节,以保持内稳态。植物在盐胁迫下,会通过信号的信息传导来保持细胞和整个植株的离子平衡,或是通过激活或抑制一些转录因子的表达来对下游应答基因进行调控。在真核生物中,MAPK级联途径是由一类保守的丝氨酸/苏氨酸蛋白激酶参与的信号传导途径[4-7]。此类蛋白激酶在多种信号传递中起着重要的作用。研究发现,在植物体中MAPK信号途径参与干旱、高盐、低温等多种胁迫反应的信号传递[8-10]。AtMEKK1基因是从拟南芥中分离出的MAPK基因,它参与高盐胁迫的信号传导[11-13]。AtMKK2基因受盐胁迫、冷害和MKK1特异激活,可以与下游的MPK4和MPK6直接作用,诱导下游一系列高盐胁迫相关基因的表达[14]。
到目前为止,利用酵母单杂交技术已经识别并鉴定出了许多与目的DNA片段相结合的蛋白质。2015年,Deokar等[15]利用酵母单杂技术筛选出了与鹰嘴豆非生物胁迫相关的转录因子CarERF116。Wang等[16]应用酵母单杂交技术,从玉米中分离获得了bZIP家族转录因子ABP9。Yu等[17]利用酵母单杂交方法确定了野大豆碱胁迫相关转录因子GsERF71。利用酵母单杂交系统寻找与特定顺式元件结合的转录因子基因,与植物调控逆境胁迫和生长发育的研究相结合来挖掘与植物抗逆有关的转录因子成为当前研究的重点。
AtSTK基因是前期研究发现的一个与拟南芥耐盐性密切相关的蛋白激酶基因,其过量表达可以明显提高拟南芥的耐盐性[18]。通过对其启动子系列缺失和盐胁迫诱导研究,确定了该启动子的盐诱导敏感元件。本研究利用AtSTK基因启动子序列作为诱饵构建载体,利用酵母单杂交技术来筛选能够作用于该启动子的转录因子基因,以探明影响AtSTK基因表达的调控机制。
1 材料和方法
1.1 构建报告载体
根据启动子序列设计引物:Hybc:5′-CGAGCTCCGGAAAATCAACAAAACCC-3′,Hyxb:5′-CCTCGAGTAAGCTTCTCACGATCTTCTTC-3′,以含有AtSTK基因启动子的质粒为模板进行PCR扩增,对产物加A后连接到pMD18-T载体,利用SacⅠ、XhoⅠ双酶切,将启动子片段连接到pAbAi载体,获得报告载体(pAbAi-HYT),转入大肠杆菌保存。
1.2 酵母单杂交cDNA文库构建与筛选
提取拟南芥幼苗总RNA,采用SMART技术合成cDNA第一链,反转录产物用RNaseH处理后,进行LD-PCR扩增双链cDNA,反应循环数定为22个循环。对双链cDNA进行1%琼脂糖凝胶电泳检测,使用CHROMA SPIN+TE-400 Column纯化双链cDNA。
从大肠杆菌提取构建好的重组报告载体质粒pAbAi-HYT,利用BstbⅠ进行单酶切线性化,转化酵母菌株Y1H Gold,线性化的pAbAi-HYT整合到基因组中。然后,将线性化的文库载体pGADT7-Rec和双链文库cDNA共转化含有pBait-AbAi的酵母菌。将转化液按1/10,1/100,1/1 000,1/10 000比例稀释后分别取100 μL涂布在SD/-Leu和含有100 ng/mL AbA的SD/- Leu培养基上,30 ℃培养4~6 d。
利用pGADT7-Rec载体引物pGAD-RecS(5′-CTATTCGATGATGAAGATACCCCACCAAACCC-3′)和pGAD-RecX(5′-GTGAACTTGCGGGGTTTTTCAGTATCTACGAT-3′),对初步筛选获得的酵母菌进行PCR检测。对鉴定获得的阳性克隆进行回复鉴定。然后将确定的阳性菌株中的质粒进行测序,测定的序列提交到NCBI进行Blast同源比对。
2 结果与分析
2.1 酵母报告载体的构建
以含有AtSTK基因启动子片段的载体为模板,Hybc和Hyxb为引物进行PCR扩增,回收后连接到pMD18-T载体进行测序,阳性克隆命名为pMD18-T-HYT。用SacⅠ和XhoⅠ酶切质粒pMD18-T-HYT,回收启动子片段后,连接到报告载体pAbAi,转化大肠杆菌,鉴定获得阳性克隆pAbAi-HYT(图1)。

A.PCR产物; B.报告载体质粒;C.报告载体的酶切鉴定;M.分子量Marker。A.PCR product;B.pAbAi-HYT plasmid;C.pAbAi-HYT plasmid digested with SacⅠ/XhoⅠ; M.Molecular weight Marker.
2.2 cDNA文库构建与酵母双杂交检测
为了从拟南芥中筛选和报告载体pAbAi-HYT相互作用的蛋白质因子,构建了拟南芥幼苗cDNA文库。提取拟南芥总RNA,总RNA经1%琼脂糖凝胶电泳检测后,反转录获得双链cDNA,LD-PCR扩增后利用柱层析的方法纯化PCR产物,纯化后的产物贮存于-20 ℃下保存备用。
提取重组报告载体质粒pAbAi-HYT,利用BstbⅠ进行单酶切线性化,利用LiAc/PEG法转化酵母菌株Y1H Gold,线性化的pAbAi-HYT进入酵母菌并整合到基因组中。然后将线性化的文库载体pGADT7-Rec和制备的双链cDNA片段利用LiAc/PEG法共同转化pAbAi-HYT酵母细胞。由于双链文库cDNA片段的两端和pGADT7-Rec的两端具有一定的同源性,因此,双链文库cDNA片段可以整合到pGADT7-Rec载体中,形成环状的结构,这样酵母就可以在缺乏亮氨酸的培养基中生存。
将含报告载体pAbAi-HYT、文库载体pGADT7-Rec和双链cDNA文库的酵母菌液涂布在含有100 ng/mL AbA的SD/-Leu固体培养基上,30 ℃培养5 d后,在平板上出现了阳性菌落。分别挑取阳性单菌落在含AbA抗性板上划线2~3次,初步确定其阳性克隆(图2)。结果表明,经过多次划线培养后长出的各酵母株系的菌落生长状态不同,可能是不同的酵母株系中表达的调控蛋白与报告载体的作用强弱不同,造成了酵母菌对AbA抗生素的抗性有所差别。
2.3 阳性克隆的筛选鉴定
将阳性菌落接种于含有100 ng/mL AbA的SD/-Leu固体培养基,培养4 d后,用引物pGAD-RecS和pGAD-RecX对文库载体所插入的cDNA片段进行PCR扩增,检测其插入片段的长度(图3)。
图2 阳性克隆的初步筛选Fig.2 The initial screening of positive clones
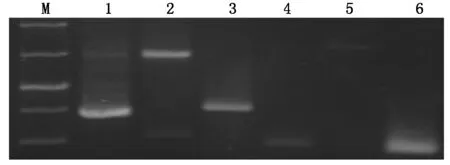
图3 阳性克隆的PCR检测Fig.3 PCR detection of positive clones
2.4 阳性克隆的复筛鉴定
为了进一步鉴定阳性克隆质粒,分别提取含有外源片段的阳性酵母菌文库质粒,转化到大肠杆菌DH5α。提取阳性克隆的质粒并纯化,转化含报告载体酵母菌,将其涂布到SD/-Leu和含有100 ng/mL AbA的SD/-Leu固体培养基上。以构建的含突变体的报告载体酵母菌为阴性对照,进行酵母单杂交的验证试验。结果表明,在含有AbA的培养基上,只有1~4号克隆能够生长(图4)。因此可以确定1~4号克隆为阳性克隆。

1~4. 利用pAbAi-HYT和阳性文库质粒转化的酵母菌;5. 阳性对照(p53-AbAi 和pGADT7-53转化的酵母菌);6. 阴性对照(含有突变的pMutant-AbAi载体的酵母菌)。
1-4.Yeast transformed with pAbAi-HYT and positive library vectors; 5. Positive control (yeast transformed with p53-AbAi and pGADT7-53 vectors); 6. Negative control (yeast transformed with pMutant-AbAi vector).
图4 酵母单杂交回复鉴定
Fig.4 Retest of the positive clones
把回复鉴定后的阳性克隆在上海生工进行测序,在NCBI网站进行比对。得到了4个可能参与AtSTK基因表达调控的拟南芥基因AT3G29810、ATCG00470、AT2G31600和AT3G32090。其中AT3G29810是与COBRA-like蛋白家族相关的基因,此家族基因编码糖基化磷脂酰肌醇锚定蛋白质(GPI),在细胞膜-细胞壁相互作用中扮演重要角色;ATCG00470基因编码ATP合成酶epsilon亚基,具有ATP酶活性。AT2G31600编码未知功能蛋白质。其中拟南芥基因AT3G32090含有WRKY转录因子保守结构域(图5),为WRKY类转录因子的一员。
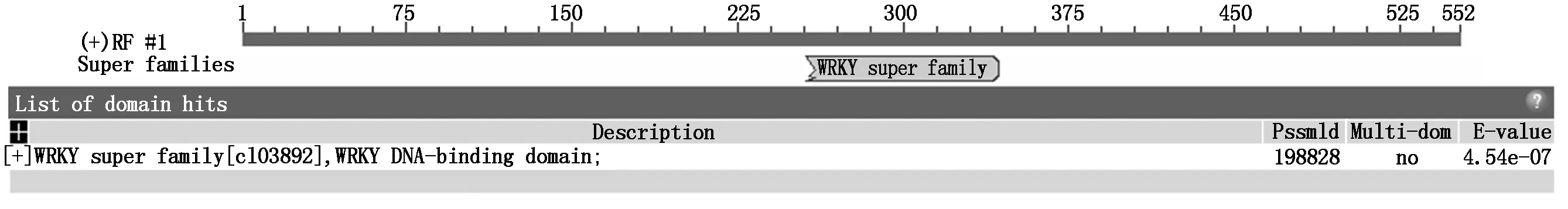
图5 AT3G32090 基因具有WRKY转录因子的保守结构域Fig.5 The AT3G32090 gene has a conserved domain of the WRKY transcription factor
3 讨论
研究DNA与蛋白质的相互作用,可以采用的方法包括DNA足迹法(Dnase I footprinting)、染色质免疫共沉淀(Chromatin immunoprecipitation,ChIP)、凝胶阻滞电泳法(Electrophoretic mobility shift assay,EMSA)和酵母单杂交(Yeast one hybrid system)。应用酵母单杂交系统作为研究蛋白质与DNA间相互作用,通过简单的试验操作,就能鉴定获得与DNA特异结合的蛋白质,同时还能够从基因文库中找到编码该蛋白的DNA序列,避免了分离纯化蛋白的过程。另外,酵母属于真核细胞,通过酵母系统得到的鉴定结果更能体现出真核细胞内基因表达调控的真实情况。
在实际操作中,由于Clontech酵母单杂交体系常常受所用报告基因AbA自泄漏表达等因素影响,在筛库过程中为降低背景表达,需要首先筛选报告子酵母菌AbA的最小抑制浓度,防止假阳性的出现。本研究最终确定选用100 ng/mL AbA作为酵母单杂交筛库的浓度。在诱饵序列的选择上,由于不能确定与盐诱导有关的顺式元件的确切位置。所以没有采用几个顺序同向相连的顺式作用元件,而是用整个启动子作为了诱饵序列。所以在筛选获得的蛋白质中会有一些和诱饵序列相结合的非转录因子蛋白,因此获得的结果还需进一步检测验证。
本次杂交试验共筛选获得4个阳性克隆,其中AT3G32090基因编码的蛋白质具有WRKY转录因子保守结构域。WRKY是一类植物家族性转录调控因子,含有1个或2个保守结构域,其核心序列为WRKYGQK[19]。WRKY蛋白可与含有(T)TGACC(A/T)核心序列(W-box)的DNA特异结合。迄今为止,拟南芥中已发现72~75个WRKY家族成员[20-22]。
WRKY转录因子与植物MAPK信号通路密切相关。Kim等[23]发现MAPK蛋白激酶可以调节某些WRKY转录因子的功能。在拟南芥逆境信号传导通路中AtWRKY22、AtWRKY29位于MPK3、MPK6的下游[24],AtWRKY25和AtWRKY33是MAPK信号通路中MPK4的底物[25]。
前期试验中,通过对AtSTK基因过表达转基因植株的RT-PCR检测,发现AtSTK基因的过表达,可以明显引起MAPK信号传导途径下游基因Esk表达量的增加,说明AtSTK基因可能通过该途径影响拟南芥植株的耐盐性[18]。eskimo1基因是拟南芥中与冷、旱、盐胁迫抗性密切相关的应答基因,处于MAPK信号传导途径下游。综上所述,AtSTK基因很可能通过MAPK信号传导通路中的AT3G32090基因编码的WRKY蛋白质调控表达量,从而影响到拟南芥的抗逆特性。
[1] 陈晓亚,汤章城. 植物生理与分子生物学[M]. 北京:高等教育出版社,2007:533-540.
[2] Muchate N S,Nikalje G C,Rajurkar N S,et al. Plant salt stress:adaptive responses,tolerance mechanism and bioengineering for salt tolerance[J]. Botanical Review,2016,82(4):371-406.
[3] Guo Q,Meng L,Mao P C,et al. Salt tolerance in two tall wheatgrass species is associated with selective capacity for K+over Na+[J]. Acta Physiologiae Plantarum,2015,37(1):1708.
[4] Hamel L P,Nicole M C,Sritubtim S,et al. Ancient signals:comparative genomics of plant MAPK and MAPKK gene families[J]. Trends in Plant Science,2006,11(4):192-198.
[5] Ahanger M A, Akram N A, Ashraf M, et al. Signal transduction and biotechnology in response to environmental stresses[J].Biologia Plantarum, 2017, 61(3): 401-416.
[6] Rodriguez M C,Petersen M,Mundy J. Mitogenactivated protein kinase signaling in plants[J]. Annual Review of Plant Biology,2010,61(1):621-649.
[7] Peng L X,Gu L K,Li D Q,et al. Relations between MAPK phosphorylation and ABA level inMalussieversiiunder water stress[J]. Russian Journal of Plant Physiology,2009,56(5):642-646.
[8] Guo Y M, Samans B, Chen S, et al. Drought-TolerantBrassicarapashows rapid expression of gene Networks for general stress responses and programmed cell death under simulated drought stress[J]. Plant Molecular Biology Reporter, 2017, 35(4): 416-430.
[9] Parmar N, Singh K H, Sharma D, et al. Genetic engineering strategies for biotic and abiotic stress tolerance and quality enhancement in horticultural crops: a comprehensive review[J]. 3 Biotech, 2017, 7(4):239.
[10] Ali F, Bano A, Fazal A, et al. Recent methods of drought stress tolerance in plants[J]. Plant Growth Regulation, 2017(1):1-13.
[11] John R, Anjum N A, Sopory S K, et al. Some key physiological and molecular processes of cold acclimation[J]. Biologia Plantarum, 2016, 60(4):603-618.
[12] Hadiarto T,Nanmori T,Matsuoka D,et al. Activation of arabidopsis MAPK kinase kinase (AtMEKK1) and induction of AtMEKK1-AtMEK1 pathway by wounding[J]. Planta,2006,223(4):708-713.
[13] Covic L,Silva N F,Lew R R. Functional characterization of ARAKIN(ATMEKK1):a possible mediator in an osmotic stress response pathway in higher plants[J]. Biochimica et Biophysica acta,1999,1451(2/3):242-254.
[14] Dubouzet J G,Sakuma Y,Ito Y,et al. OsDREB genes in rice,OryzasativaL.,encode transcription activators that function in drought-,high-salt- and cold-responsive gene expression[J]. Plant Journal,2003,33(4):751-763.
[15] Deokar A A, Kondawar V, Kohli D, et al. TheCarERFgenes in chickpea (CicerarietinumL.) and the identification of CarERF116 as abiotic stress responsive transcription factor[J]. Functional & Integrative Genomics, 2015, 15(1):27-46.
[16] Wang C L, Lu G Q, Hao Y Q, et al. ABP9, a maize bZIP transcription factor, enhances tolerance to salt and drought in transgenic cotton[J]. Planta, 2017, 1-17. doi: 10.1007/s00425-017-2704-x.
[17] Yu Y, Duan X B, Ding X D, et al. A novel AP2/ERF family transcription factor fromGlycinesoja, GsERF71, is a DNA binding protein that positively regulates alkaline stress tolerance inArabidopsis[J]. Plant Molecular Biology, 2017, 94(4-5):509-530.
[18] Bing L,Feng C C,Li J L,et al. Overexpression of theAtSTKgene increases salt,PEG and ABA tolerance inArabidopsis[J]. Journal of Plant Biology,2013,56(6):375-382.
[19] Rushton P J,Macdonald H,Huttly A K,et al. Members of a new family of DNA-binding proteins bind to a conserved cis-element in the promoters of alpha-Amy2 genes[J]. Plant Molecular Biology,1995,29(4):691-702.
[20] Liu Z,Fang H,Pei Y,et al. WRKY transcription factors down-regulate the expression of H2S-generating genes,LCD and DES inArabidopsisthaliana[J]. Science Bulletin,2015,60(11):995-1001.
[21] Encinas-Villarejo S,Maldonado A M,Amil-Ruiz F,et al. Evidence for a positive regulatory role of strawberry(Fragaria×ananassa)FaWRKY1 andArabidopsisAtWRKY75 proteins in resistance[J]. Journal of Experimental Botany,2009,60(11):3043-3065.
[22] Jiang L,Jian H Y,Qian J Z,et al.MAX4 gene is involved in the regulation of low inorganic phosphate stress responses inArabidopsisthaliana[J]. Acta Physiologiae Plantarum,2011,33(3):867-875.
[23] Kim C Y,Zhang S. Activation of a mitogen-activated protein kinase cascade induces WRKY family of transcription factors and defense genes in tobacco[J]. Plant Journal,2004,38(1):142-151.
[24] Asai T,Tena G,Plotnikova J,et al. MAP kinase signalling cascade inArabidopsisinnate immunity[J]. Nature,2002,415(6875):977-983.
[25] Andreasson E,Jenkins T,Brodersen P,et al. The MAP kinase substrate MKS1 is a regulator of plant defense responses[J]. The EMBO Journal,2005,24(14):2579-2589.
Study on the Expression Regulatory Proteins ofArabidopsisGeneAtSTKby Yeast One Hybrid System
YANG Ge1,HUI Ying2,ZHAO Cui1,TIAN Menghan1,REN Yuanyuan1,HUANG Zhanjing1,GE Rongchao1
(1.College of Life Sciences,Hebei Normal University,Shijiazhuang 050024,China;2.Zhongqi Pharmaceutical Ltd. CSPC,Shijiazhuang 050035,China)
The overexpression of Serine/Threonine protein kinase geneAtSTKcan significantly enhance the salt tolerance ofArabidopsisthaliana. In order to study the regulation mechanism ofAtSTKgene expression,the promoter sequences ofAtSTKwere amplified from genomic DNA and constructed into the reporter vector pAbAi. The recombinant plasmid pAbAi-HYT was linearized byBstb Ⅰ and transformed into the yeast strain Y1H Gold,the linear pAbAi-HYT integrated into the genomic DNA. Then,the purified double strand cDNA ofArabidopsisand the linearized library vector pGADT7-Rec were co-transformed into the yeast cell which containing reporter vector pAbAi-HYT. The positive clones were screened on the SD/-Leu medium containing 100 ng/mL AbA by the yeast one hybrid method. Through the identification,it was found that four genes might be involved in the regulation ofAtSTKgene expression. The sequencing results indicated that theArabidopsisthalianageneAT3G32090,which contained a conserved domain of WRKY transcription factor,was a member of the WRKY transcription factor. Therefore,the expression level ofAtSTKmight affect the salt tolerance ofArabidopsisplants through the MAPK signaling pathway transcription factor which coded by the geneAT3G32090.
AtSTK;Promoter;Expression regulatory proteins;Yeast one hybrid
2017-06-18
国家自然科学基金项目(30900104);河北省自然科学基金项目(C2016205158)
杨 歌(1993-),女,河北石家庄人,在读硕士,主要从事耐盐相关基因克隆与功能研究。杨歌、惠颖为同等贡献作者。
葛荣朝(1974-),男,河北衡水人,教授,博士,主要从事植物抗逆相关功能基因研究。
Q756
A
1000-7091(2017)04-0073-05
10.7668/hbnxb.2017.04.012
