大豆CHI1基因启动子的克隆及功能初探
2017-09-12赵春梅薛仁镐
赵春梅,范 习,薛仁镐
(青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109)
大豆CHI1基因启动子的克隆及功能初探
赵春梅,范 习,薛仁镐
(青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109)
为了解大豆Class Ⅰ几丁酶基因(Chitinase gene)对不同胁迫响应的分子机制。利用PCR技术克隆了大豆Class ⅠChitinase基因的启动子片段(GmCHI1p),序列分析表明,扩增片段(1 641 bp)与GenBank中的已知序列同源性达99.8%,且含有多个胁迫响应调控元件。利用GUS基因上游无启动子的表达载体pCAMBIA1391Z,构建GmCHI1p与GUS基因融合的植物表达载体pCAM-GmCHI1p,并通过农杆菌介导法导入烟草中。在转基因烟草愈伤组织中检测到GUS活性,表明该启动子具有启动活性。对转基因烟草中的GUS活性进行初步定性分析,结果表明,GmCHI1p可驱动GUS基因在转基因烟草的根部特异性表达,而且在伤害处理的叶片中检测到GUS的强烈表达,表现出明显的根组织特异性及伤害诱导性。这种伤害诱导仅在伤害组织部位及其附近高效表达而没有被长距离传递,预计该启动子在转基因抗虫分子育种中具有巨大的应用前景。
几丁质酶;启动子;根特异性;伤害诱导性
大豆(GlycinemaxL.Merrill)是重要的油料作物和经济作物。大豆生产中,各种真菌病及虫害是导致大豆品质和产量下降的重要原因。通过基因工程技术将相关抗性基因导入大豆,是当今提高大豆抗病性及生产力的有效策略。目前,有大量优良新基因被分离克隆,但植物基因工程中广泛使用的组成型启动子(比如CaMV35S启动子、Act1启动子及Ubi1启动子等),在应用中逐渐暴露出一些问题:靶基因的过量表达通常会严重影响植物的正常生长和发育[1-2]。因此,发掘能够对外源基因表达施行时、空、量三维调控的组织特异型启动子和诱导型启动子显得尤为重要[3]。
植物伤害或病原菌诱导型启动子的研究是植物生物技术领域的一个研究热点。病原菌侵染会诱导植物产生多种防卫反应,包括病程相关蛋白的合成(PR蛋白:Pathogenesis-related proteins)。几丁质酶(Chitinase,CHI)是主要的植物PR蛋白之一,广泛存在于各种植物中,在抵御真菌病害的防卫反应中发挥着重要作用[4-5]。研究表明,Chitinase在植物正常生长情况下表达量极低或不表达,但在受到病原菌、伤害及信号分子诱导时表达量迅速增加[6-7],快速而强烈的诱导特性暗示其启动子在植物基因工程中具有重要的实用价值。目前,已从拟南芥、辣椒、芥菜等几种植物中获得了Chitinase的启动子序列,并对其诱导调控特性进行了分析[8-11]。但到目前为止,对Chitinase启动子的调控机理所进行的遗传转化研究仅局限在少数模式植物上,对农作物的实用性研究却很少。
大豆Class IChitinase(GmCHI1)同样也受到病原菌、伤害及激发子等的诱导表达[12-13]。为了从大豆中发掘新型的病原菌或伤害诱导型启动子,本研究首先克隆了大豆GmCHI1基因的启动子序列(GmCHI1p),将其构建入无启动子的pCAMBIA1391Z表达载体中,获得GmCHI1p与GUS报告基因融合的重组表达载体,然后利用农杆菌介导法转化烟草,对转基因烟草中的GUS表达情况进行鉴定分析,结果表明GmCHI1p具有显著的根组织特异性及伤害诱导性。
1 材料和方法
1.1 试验材料
分离启动子的DNA供体材料为吉林小黄豆,遗传转化受体为烟草品种云烟87,大肠杆菌菌株(Escherichiacoli) 为DH5α,根癌农杆菌(Agrobacteriumtumefaciens)菌株为EHA105。植物表达载体pCAMBIA1391Z含有GUS结构基因,但不含调控GUS基因表达的启动子,为本实验室保存。pMD18-T vector、LATaqDNA聚合酶、T4DNA连接酶及各种限制性内切酶、试剂和试剂盒均购自宝生物工程(大连)有限公司(TaKaRa)。
1.2 PCR 扩增引物
本试验所需引物全部由上海生工生物工程有限公司合成,序列见表1。
1.3 试验方法
1. 3. 1GmCHI1p的克隆和序列分析 采用改良的CTAB 法[14],从大豆叶片中提取基因组DNA。参照已发表的大豆几丁质酶基因(Chitinase1,GmCHI1)序列(GenBank:AF202731.1),设计上游引物ChiPF和下游引物ChiPR进行PCR扩增,获得GmCHI1基因起始密码子上游约1.6 kb DNA片段。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 50 s,72 ℃ 2 min,30个循环;72 ℃ 5 min,4 ℃保存。
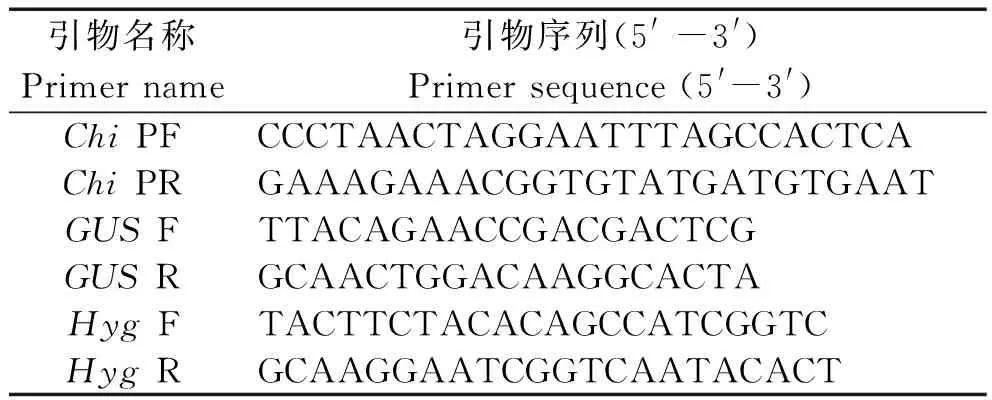
表1 PCR 扩增引物序列
利用TaKaRa公司的DNA凝胶纯化回收试剂盒,对PCR产物进行纯化回收,方法参照产品说明书。回收后的PCR产物连接到pMD18-T载体上,转化E.coliDH5α,筛选重组质粒,命名为pMD18-T-CHI1p。对插入片段的克隆由TaKaRa公司进行序列测定。测序结果的同源性分析采用DNAman序列分析软件(www.bio-soft.net)。利用生物信息学网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子的顺式作用元件进行分析。
1.3.2 植物表达载体的构建和烟草转化 利用pMD18-T的酶切位点,将pMD18-T-CHI1p质粒用Hind Ⅲ和EcoRⅠ酶切,回收GmCHI1p启动子片段,然后与Hind Ⅲ和EcoRⅠ酶切后的pCAMBIA1391Z载体片段连接,得到GmCHI1p与GUS基因融合的植物表达载体pCAM-GmCHI1p。对获得的阳性克隆进行Hind Ⅲ和EcoRⅠ双酶切鉴定。
用冻融法[15]将表达载体pCAM-GmCHI1p转入根癌农杆菌EHA105菌株中。叶圆盘法[16]转化烟草云烟87,获得的转基因烟草幼苗移至田间培育。同时,将pCAMBIA1391Z植物表达载体转化烟草作为阴性对照。
1.3.3 转基因烟草的PCR鉴定 对不同的转基因烟草独立转化系采用CTAB法提取叶片基因组DNA,分别使用GUSF / R 引物对和HygF / R 引物对进行PCR检测。PCR反应条件均为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 5 min,4 ℃保存。扩增出相应特异条带(GUS基因约706 bp;HPT基因约559 bp)的植株即为阳性株,可以用于后续的GUS酶活测定。
1.3.4 转基因烟草GUS表达分析 伤害处理:取温室培养条件下转基因烟草的整株小苗,用牙签在烟草叶片上扎孔,同一张叶片只在一半叶片上扎孔,另一半作对照,处理3 h后取样。
将上述材料置于小烧杯中,进行GUS活性的组织染色分析[17]。所需溶液:50 mmol/L磷酸钠缓冲液,pH值7.0;0.5 mmol/L K3Fe(CN)6;0.5 mmol/L K4Fe(CN)6;10 mmol/L EDTA;0.1%Triton X-100;2 mmol/L X-gluc。37 ℃染色16 h,组织用90%乙醇脱色,然后观察拍照。
2 结果与分析
2.1GmCHI1p的克隆及表达调控元件分析

生物信息学的发展及大豆基因组测序工作的完成,为本研究的顺利进行提供了条件。根据GenBank中发表的序列设计引物,扩增获得Chitinase1基因起始密码子上游1 641 bp的DNA片段,命名为GmCHI1p(图1,泳道2)。将克隆片段进行T载体连接,对重组载体pMD18-T-CHI1p分别进行酶切验证(图1,泳道1)和测序验证。测序结果表明,克隆的GmCHI1p序列与大豆基因库中的序列相似度达99.8%。M.Wide range DNA Marker (500~12 000 bp);1.pMD18-T-GmCHI1p酶切验证;2.GmCHI1pPCR 扩增;3.pCAM-GmCHI1p酶切验证。
M.Wide range DNA Marker (500-12 000 bp);1.EcoRⅠ+Hind Ⅲ digestion of pMD18-T-GmCHI1p;2.PCR amplification ofGmCHI1p;3.EcoRⅠ+Hind Ⅲdigestion of pCAM-GmCHI1p.
图1GmCHI1p的克隆及载体构建
Fig. 1 The cloning ofGmCHI1pand construction of promoter binary vector
利用PlantCARE数据库对GmCHI1p启动子序列进行生物信息学分析,结果显示,在GmCHI1p序列中除包含基本的启动元件TATA-box及大量的CAAT-box(与增强转录效率有关)外,还含有多个对水杨酸、茉莉酸等激素响应的元件,以及一些对其他胁迫响应的转录元件(表2),由此推测该启动子可能具有胁迫诱导响应特性。
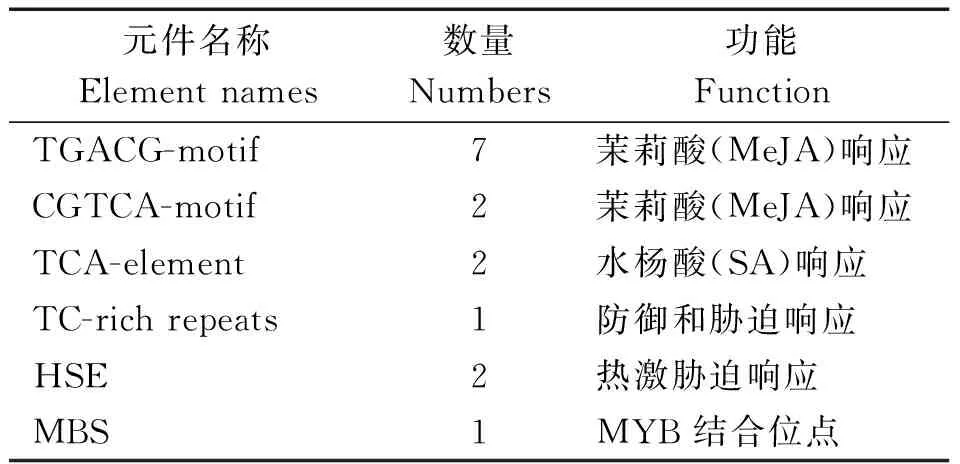
表2 启动子顺式作用元件统计
2.2GmCHI1p∷GUS融合基因表达载体的构建
pCAMBIA1391Z表达载体的GUS基因上游不携带启动子,为多克隆酶切位点(MCS)区,方便其他外源启动子的插入,为启动子的效率验证提供了非常好的载体系统。用HindⅢ和EcoR Ⅰ双酶切pMD18-T-CHI1p重组质粒,回收GmCHI1p启动子片段,然后与Hind Ⅲ和EcoR Ⅰ双酶切后的pCAMBIA1391Z载体片段连接,得到GmCHI1p与GUS基因融合的植物表达载体pCAM-GmCHI1p(图2),并通过冻融法将重组表达载体pCAM-GmCHI1p转化农杆菌EHA105。
2.3 转GmCHI1p∷GUS融合基因烟草的获得及分子鉴定
利用农杆菌介导法将植物表达载体pCAM-GmCHI1p转化烟草,共获得56株具有潮霉素抗性的GmCHI1p∷GUS融合基因转化株系。随机选取其中33个转化株系,提取烟草叶片基因组DNA,分别用GUS基因和HPT基因特异性引物进行PCR分析,整合有外源基因的植株应在PCR产物中含有相应大小的片段(GUS基因约706 bp;HPT基因约559 bp),结果表明,33个转化株系均获得相应的特异条带(图3),初步证明外源基因已整合到这些植物的基因组中。

35Sp.CaMV35S启动子;GUS.β-葡萄糖苷酶基因;HPT.潮霉素磷酸转移酶基因;MCS.多克隆位点;GmCHI1p.大豆GmCHI1基因启动子。35Sp.CaMV35S promoter;GUS. β-glucuronidase gene;HPT.Hygromycin phosphotransferase gene;MCS.Multiple cloning sites;GmCHI1p.GmCHI1 gene promoter.
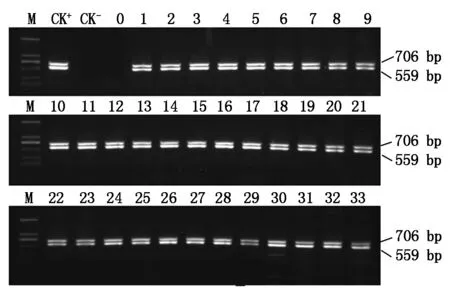
M.DNA Marker 2000;CK+.质粒pCAM-GmCHI1p阳性对照;CK-.ddH2O;0.未转基因烟草阴性对照;1~33. 转基因烟草植株。M.DNA Marker 2000;CK+.Plasmid pCAM-GmCHI1p;CK-.ddH2O;0.Untransgenic tobacco (negative control);1-33.Transgenic tobacco plants.
2.4GUS融合基因在转基因烟草中的表达分析
为检测GmCHI1p的启动活性,首先对烟草抗性愈伤组织进行GUS组织化学染色。结果显示,转化pCAM-GmCHI1p且具有潮霉素抗性的愈伤组织中有强烈的GUS表达,而无启动子的空载体(pCAMBIA1391Z)转化获得的抗性愈伤组织中未检测到GUS活性(图4),表明GmCHI1p具有启动GUS表达的功能。

A.转pCAM-GmCHI1p的抗性愈伤组织;B.转空载体的抗性愈伤组织。 A.Calli (HygR) transformed with pCAM-GmCHI1p;B.Calli (HygR) transformed with pCAMBIA1391Z.
对转基因烟草小苗进行GUS染色分析表明,在未伤害处理的烟草植株的茎、叶处没有检测到GUS蛋白的表达,而根部则具有明显的GUS染色(图5-A);在伤害处理下,受伤叶片的伤口处及其附近出现明显的GUS染色,包括叶片切口处和叶片刺伤处,而其他未受伤部位和对照叶片均未检测到GUS蛋白的表达(图5-B、C),表明该启动子的伤害诱导信号没有被长距离传递,因此,预计该启动子在转基因抗虫分子育种中具有巨大的应用前景。
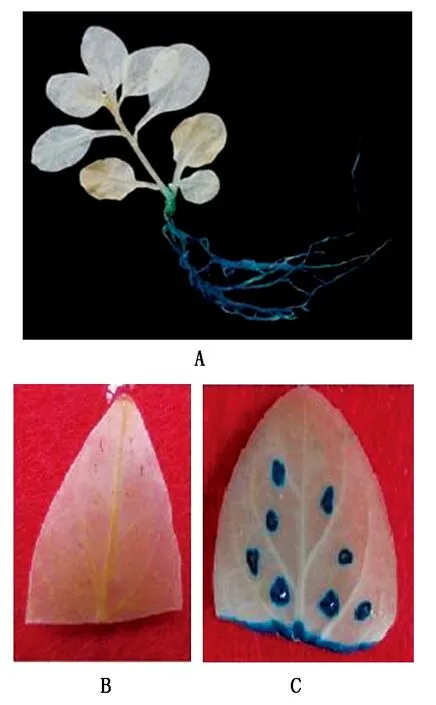
图5 转基因烟草中的GUS表达分析Fig.5 The expression analysis of GUS in transgenic tobacco
3 讨论
植物几丁质酶启动子受伤害、病原菌、激发子等的快速强烈诱导。Wu等[10]发现芥菜ClassⅠ几丁质酶基因BjCHI1启动子能驱动GUS基因在转基因烟草和拟南芥中表达,并受伤害、MeJA等生物和非生物因素的强烈诱导,并首次证明BjCHI1启动子中的T/G-box(AACGTG)序列赋予启动子的MeJA诱导特性。Hong等[11]证明辣椒classⅡ几丁质酶基因CAChi2启动子驱动的GUS基因受病菌侵染、渗透胁迫和SA的诱导强烈表达。本研究发现,大豆几丁质酶基因启动子GmCHI1p能够驱动GUS基因的表达。对GmCHI1p序列进行生物信息学分析发现,序列中含有多个对水杨酸、茉莉酸等激素响应的元件,推测该启动子可能具有伤害诱导特性。而对转基因烟草的组织化学染色也证明了GmCHI1p启动子被伤害强烈诱导表达。
根部特异启动子在植物抗病以及抗逆性改良和植物品质改良中有良好的应用价值。近年来,一些植物根特异的启动子相继被克隆分析[18-21]。Park等[22]证明在营养生长阶段,水稻根部特异启动子HPX1主要活跃在根部伸长区。大豆GmPRP2启动子驱动GUS报告基因在转基因拟南芥和大豆根中优先表达[23]。Kong等[24]将根特异启动子LjNRT2和AtNRT2.1驱动下的人工合成几丁质酶基因(NIC)进行番茄和烟草的转化,证明根部特异启动子驱动的NIC基因只在转基因植物的根部有表达,并且转基因植物对根部病原菌-尖刀镰孢菌的抗性水平显著增加。几丁质酶启动子的表达也具有一定的组织特异性,如山葡萄ClassⅢ 几丁质酶基因VCH3启动子受外源施加SA诱导在植物维管组织中特异性的高效表达[9]。本研究发现,大豆GmChi1p启动子能够驱动GUS基因在转基因烟草的根部特异性高效表达。
在大豆的高产、品质改良及抗病虫害基因工程中能够选用的植物内源的组织特异或诱导型启动子仍然较少。因此,从大豆中发掘更多的根特异和/或伤害诱导型启动子对基础研究和生产应用具有重要的意义。本试验证明GmCHI1p启动子具有明显的根组织特异性,且可受伤害强烈诱导表达,因此,能用于植物源的根特异性兼伤害诱导型表达载体的构建,预计该启动子在农作物品质改良及抗病虫害基因工程中有很好的应用前景。
[1] Kasuga M,Liu Q,Miura S,et al. Improving plant drought,salt,and freezing tolerance by gene transfer of a single stress-inducible transcription factor[J]. Nature Biotechnology,1999,17(3):287-291.
[2] Hammond-Kosack K E,Parker J E. Deciphering plant-pathogen communication:fresh perspectives for molecular resistance breeding[J]. Current Opinion in Biotechnology,2003,14(2):177-193.
[3] Venter M. Synthetic promoters:genetic control through cis engineering[J]. Trends in Plant Science,2007,12(3):118-124.
[4] Boller T,Gehri A,Mauch F,et al. Chitinase in bean leaves:induction by ethylene,purification,properties,and possible function[J]. Planta,1983,157(1):22-31.
[5] Kasprzewska A. Plant chitinases-regulation and function[J]. Cellular & Molecular Biology Letters,2003,8(3):809-824.
[6] Xu F,Fan C,He Y. Chitinases inOryzasativassp. japonica andArabidopsisthaliana[J]. Journal of Genetics and Genomics,2007,34(2):138-150.
[7] Whipps J M,Hand P,Pink D,et al. Phyllosphere microbiology with special reference to diversity and plant genotype[J]. Journal of Applied Microbiology,2008,105(6):1744-1755.
[8] Samac D A,Shah D M. Developmental and Pathogen-Induced activation of theArabidopsisacidic chitinase promoter[J]. The Plant Cell,1991,3(10):1063-1072.
[9] Li H Y,Qi J,Shu H R,et al. Isolation and characterization of a chitinase geneVCH3 promoter from grapevine (Vitisamurensis) [J]. Journal of Plant Physiology and Molecular Biology,2005,31(5):485-491.
[10] Wu X F,Wang C L,Xie E B,et al. Molecular cloning and characterization of the promoter for the multiple stress-inducible geneBjCHI1 fromBrassicajuncea[J]. Planta,2009,229(6):1231-1242.
[11] Hong J K,Hwang B K. Promoter activation of pepper class Ⅱ basic chitinase gene,CAChi2,and enhanced bacterial disease resistance and osmotic stress tolerance in the CAChi2-overexpressingArabidopsis[J]. Planta,2006,223(3):433-448.
[12] Liuba K S. The influence ofFusariumoxysporuminfection and low temperatures on the activity of soybean esterase and PR proteins [J]. Icelandic Agricultural Sciences,2001,14:67-73.
[13] Gijzen M,Kuflu K,Qutob D,et al. A class I chitinase from soybean seed coat[J]. Journal of Experimental Botany,2001,52(365):2283-2289.
[14] 王关林,方宏筠. 植物基因工程原理与技术[M]. 北京:科学出版社,2002:428-432.
[15] Holsters M,De Waele D,Depicker A,et al. Transfection and transformation ofAgrobacteriumtumefaciens[J]. Molecular & General Genetics,1978,163(2):181-187.
[16] Jin T E,Kim I G,Kim W S,et al. Expression of chromium (VI) reductase gene of heavy metal reducing bacteria in tobacco plants [J]. Plant Biotechnology Journal,2001,3(1):13-17.
[17] Jefferson R A,Kavanagh T A,Bevan M W. Gus fusions-beta-glucuronidase as a sensitive and versatile gene fusion marker in higher-plants[J]. EMBO Journal,1987,6(13):3901-3907.
[18] Noh S A,Lee H S,Huh G H,et al. A sweetpotato SRD1 promoter confers strong root-,taproot-,and tuber-specific expression inArabidopsis,carrot,and potato[J]. Transgenic Research,2012,21(2):265-278.
[19] Xu X,Guo S,Chen K,et al. A 796 bpPsPR10 gene promoter fragment increased root-specific expression of the GUS reporter gene under the abiotic stresses and signal molecules in tobacco[J]. Biotechnology Letters,2010,32(10):1533-1539.
[20] Arango J,Salazar B,Welsch R,et al. Putative storage root specific promoters from cassava and yam:cloning and evaluation in transgenic carrots as a model system[J]. Plant Cell Reports,2010,29(6):651-659.
[21] Vijaybhaskar V,Subbiah V,Kaur J,et al. Identification of a root-specific glycosyltransferase fromArabidopsisand characterization of its promoter[J]. Journal of Biosciences,2008,33(2):185-193.
[22] Park S H,Jeong J S,Han E H,et al. Characterization of the root-predominant gene promoter HPX1 in transgenic rice plants[J]. Plant Biotechnology Reports,2013,7(3):339-344.
[23] Chen L,Jiang B,Wu C,et al.GmPRP2 promoter drives root-preferential expression in transgenicArabidopsisand soybean hairy roots[J]. BMC Plant Biology,2014,14(1):245.
[24] Kong K,Makabe S,Ntui V O,et al. Synthetic chitinase gene driven by root-specific LjNRT2 and AtNRT2.1 promoters confers resistance toFusariumoxysporumin transgenic tobacco and tomato[J]. Plant Biotechnol Reports,2014,8(2):151-159.
Molecular Cloning and Function Analysis of aGmCHI1 Promoter
ZHAO Chunmei,FAN Xi,XUE Rengao
(College of Life Science,Qingdao Agriculture University,Key Lab of Plant Biotechnology in Universities of Shandong Province,Qingdao 266109,China)
To investigate the molecular mechanism of the Class Ⅰ Chitinase gene response to virous stresses,the Class IChitinasepromoter was isolated from soybean by PCR and its sequencing analysis indicated that the amplified fragment (1 641 bp) was 99.8% homologous to the ones reported in the GenBank database. The results showed that it included several conserved stress-responsive elements. By using the expression vector pCAMBIA1391Z without promoter upstream ofGUSgene,GmCHI1pwas fused in the frame with theGUSreporter gene and the resulting construct pCAM-GmCHI1pwas introduced into tobacco byAgrobacterium-mediated method.GUSactivity can be detected in theGmCHI1p-transfomants but not untransformed calli (control). The determinations of the GUS activities in the transgenic tobacco plants indicated thatGmCHI1pcould drive theGUSreporter gene to express in the roots specifically and could be significantly induced by wounding. TheGmCHI1 promoter was root tissue-specific and wounding-inducible in its expression. The wounding-inducible expression was occurred only in the wounding tissue or at round it but not transmitted for a long distance. It is expected to have great application prospects in the molecular breeding of transgenic insect resistance.
Chitinase;Promoter;Root-specific;Hurt-inducible
2017-07-01
转基因生物新品种培育重大专项资助项目(2014ZX08010002-003-002);山东省自然科学基金项目(ZR2013CM025)
赵春梅(1974-),女,山东临沂人,副教授,博士,主要从事植物逆境生理与分子生物学研究。
薛仁镐(1965-),男,吉林汪清人,教授,博士,主要从事植物分子生物学研究。
Q78;S565.03
A
1000-7091(2017)04-0032-05
10.7668/hbnxb.2017.04.005
