中华结缕草对潮霉素的敏感性研究
2017-09-12刘建华裴福云宋凤鸣雷江丽
刘建华,裴福云,宋凤鸣,雷江丽
(1.广东省深圳市铁汉生态环境股份有限公司,广东 深圳 518040;2.广东省深圳市中科院仙湖植物园/广东省深圳市南亚热带植物多样性重点实验室,广东 深圳 518004)
中华结缕草对潮霉素的敏感性研究
刘建华1,裴福云1,宋凤鸣1,雷江丽2*
(1.广东省深圳市铁汉生态环境股份有限公司,广东 深圳 518040;2.广东省深圳市中科院仙湖植物园/广东省深圳市南亚热带植物多样性重点实验室,广东 深圳 518004)
研究了中华结缕草3种不同外植体对不同浓度潮霉素溶液的敏感性。结果表明:中华结缕草不同外植体对潮霉素的敏感性存在差异,其中种子经50 mg/L潮霉素处理3周后,发芽率极显著减少,只有6%;愈伤组织经20 mg/L潮霉素处理3周后褐化率达到62%;离体叶片经50 mg/L潮霉素处理7 d后,黄化面积率超过85%。故中华结缕草的种子、愈伤组织、离体叶片在遗传转化中适宜的潮霉素筛选浓度分别为50、20、50 mg/L。
中华结缕草;潮霉素;敏感性;外植体
中华结缕草(ZoysiasinicaHance)作为我国的乡土品种,在枝条密度、抗寒性、耐热性、抗旱性、叶子质地等方面均位于同类暖季型草种的前列[1],而且分布区域广泛,管理成本低,其中需水量更是只有草地早熟禾的50%左右,因而无论是在北方还是在南方均有大面积种植[2]。随着对中华结缕草研究的深入和应用范围的扩大,越来越多的学者开始关注中华结缕草的转基因育种,在遗传转化的报道中遗传介导的载体包含种子[3-4]、愈伤组织[5-6]等,且目前主要集中在耐寒[6-7]的研究。
在植物遗传转化中,选择合适的筛选标记基因往往能达到事半功倍的效果。用抗生素进行转基因植物阳性材料筛选,已是一种较为快速有效的措施,在前期筛选和后代材料鉴定上使用广泛,目前已在小麦[8]、大豆[9]、杨树[10]等上成功应用。潮霉素B (Hygromycin B)是一种氨基糖苷类抗生素,可破坏各种细胞中核糖体的功能,使敏感组织褐化死亡。潮霉素B因其具有选择率高、假阳性率低、重复性好、对转化细胞毒害作用小等优点而被重视[11-14],在单子叶植物上得到了广泛应用[15-17]。目前国家对转基因植物安全性的重视也促使育种工作者选用更安全的筛选标记基因。HPT编码蛋白对人体潜在致敏性很低[18],是一种较安全的标记基因。本文采用愈伤组织、种子、离体叶片这3种不同的外植体,研究了它们对潮霉素的敏感性,以期为中华结缕草转基因各阶段的筛选提供参考。
1 材料与方法
1.1 植物材料
中华结缕草草籽:采集于山西省沂蒙山区。中华结缕草植株:苗龄在3个月左右。潮霉素B:生产厂家为罗氏制药,储存液浓度为50 mg/mL。
1.2 培养基与培养条件
人工气候箱的培养条件为:温度(25±2)℃、光照强度2000~2500 lx、光照时数16 h/d。愈伤组织的诱导培养基配方为MS+2 mg/L 2,4-D+30 g/L蔗糖+7 g/L琼脂,并用NaOH调节pH至5.8。
1.3 实验方法
1.3.1 潮霉素对种子的处理方法 挑选饱满成熟的种子,各处理均先进行催芽处理:用10%的NaOH处理20 min,再用清水冲洗5遍。然后进行消毒处理:用75%的酒精消毒1 min,然后用0.1%升汞消毒10 min,最后用无菌水清洗5遍左右。将经消毒的种子置于铺有滤纸的培养皿中,并加入相应浓度的潮霉素溶液,最后放入人工气候箱中培养。在试验处理中每3 d更换1次相应浓度的潮霉素溶液。本试验共设计了5个潮霉素浓度,分别为0、10、30、50、80 mg/L,每个处理100粒种子,均10次重复,其中0 mg/L为对照组。参照国标牧草种子检验规范的判定标准[19],在第3周记录发芽数并按下列公式计算发芽势和发芽率。
发芽势(%)=第2周的发芽数/种子数×100;
发芽率(%)=第3周的发芽数/种子数×100。
1.3.2 潮霉素对愈伤组织的处理方法 对供试种子进行消毒并将其接种到诱导培养基中,每3周转接1次;到第3次时,将愈伤组织放入含有潮霉素溶液的诱导培养基中,其中潮霉素浓度分别为0、20、50、80、100 mg/L。每个处理5个样品,均10次重复,其中0 mg/L为对照组。每周进行观察记录,3周后统计相关数据并计算分化率、存活率和褐化率,其中褐化率的计算公式如下:
褐化率(%)=褐化数/样品数×100。
1.3.3 潮霉素对离体叶片的处理方法 经过预实验可知,离体条件下叶片在0.5 mg/L的6-BA溶液中能保证1周不明显变黄,故处理时均加入6-BA以增加其绿叶时间。试验开始时,共设置5个潮霉素浓度处理,分别为0、50、100、150、200 mg/L,溶剂为含6-BA的蒸馏水,其中0 mg/L为对照组。取正常生长的成熟叶片(在新叶后的第1~2片真叶),用剪刀剪去叶片两端并留取宽度在1.0~1.5 cm的叶片片段,最后把叶片段随机放置到各个处理溶液中,放入人工气候箱培养。每2 d观察记录1次,并在第6天统计每张叶片段的黄化面积率。
黄化面积率(%)=黄化面积/叶面积×100。
1.4 数据统计与分析
采用Excel 2013进行图表制作,采用SPSS 23.0软件对发芽率、存活率、黄化率等进行单因素方差分析,选用Duncan法进行多重比较,显著性水平设置为0.01。
2 结果与分析
2.1 潮霉素对中华结缕草种子发芽势、发芽率的影响
发芽势是测试种子发芽速度和整齐度的一个指标。从图1可以看出,经过潮霉素处理后,中华结缕草种子的发芽势和发芽率都不同程度的降低;10 mg/L潮霉素处理的影响不显著;当潮霉素浓度达到30 mg/L时发芽率只有22%,与对照有极显著差异;当潮霉素浓度达到50 mg/L时,发芽率为6%,发芽势为4%,说明此时种子发芽已受到严重抑制;当潮霉素浓度继续升高至80 mg/L时,发芽率和发芽势均趋近于0%。故为了防止药剂浓度过高导致的生长毒害作用且为了满足较高的筛选效率,选用50 mg/L的潮霉素浓度作为种子的筛选标准。

图中不同大写英文字母表示处理间差异达P<0.01的显著水平。下同。
2.2 潮霉素对中华结缕草愈伤组织的影响
合适的潮霉素筛选浓度是保证基于组培途径的植物转基因技术成功的关键因子之一,直接影响后期的遗传转化效果和工作量。由图2可知:随着潮霉素浓度的提高和处理时间的延长,外植体的褐化率总体上呈上升趋势。具体来说,在第2周时,除20 mg/L潮霉素处理外其他浓度处理均达到半致死浓度,而对照组变化不显著。在处理3周后,20 mg/L潮霉素处理的愈伤组织达到半致死浓度;而50 mg/L处理下褐化率达到90%;随着浓度继续升高,褐化率虽小幅度下降但均保持在80%左右。实际观察(图3)发现:在50 mg/L潮霉素处理下,愈伤组织长势急剧下降,几乎停滞生长且愈伤组织质地变软,颗粒不明显,后续也不能继续增殖和分化,毒害作用较大;在潮霉素处理下,前期愈伤组织的褐化识别较难,需经过3周左右才能结合颜色和愈伤组织大小进行综合区分。故基于试剂成本与筛选效率的考虑,在实际应用时,可选取20 mg/L为愈伤组织培养的潮霉素筛选浓度。

图2 不同潮霉素浓度对愈伤组织的影响
2.3 潮霉素对中华结缕草离体叶片的影响
经不同浓度的潮霉素处理7 d后,对各处理离体叶片的试验数据进行统计和分析,结果如图3所示。从图3可以看出:各处理与对照间的黄化面积率均存在极显著差异;当潮霉素浓度达到50 mg/L时,黄化面积率已经超过85%,药害症状明显(参见图4);当潮霉素浓度超过50 mg/L后,叶片黄化面积较50 mg/L处理略有减少。综上分析,认为50 mg/L的潮霉素浓度较适合作为转基因后代耐药性筛选的条件,它可以在节省成本的同时得出一个辨识度高的结果,方便得出结论。

左图:潮霉素浓度0 mg/L;右图:潮霉素浓度50 mg/L。
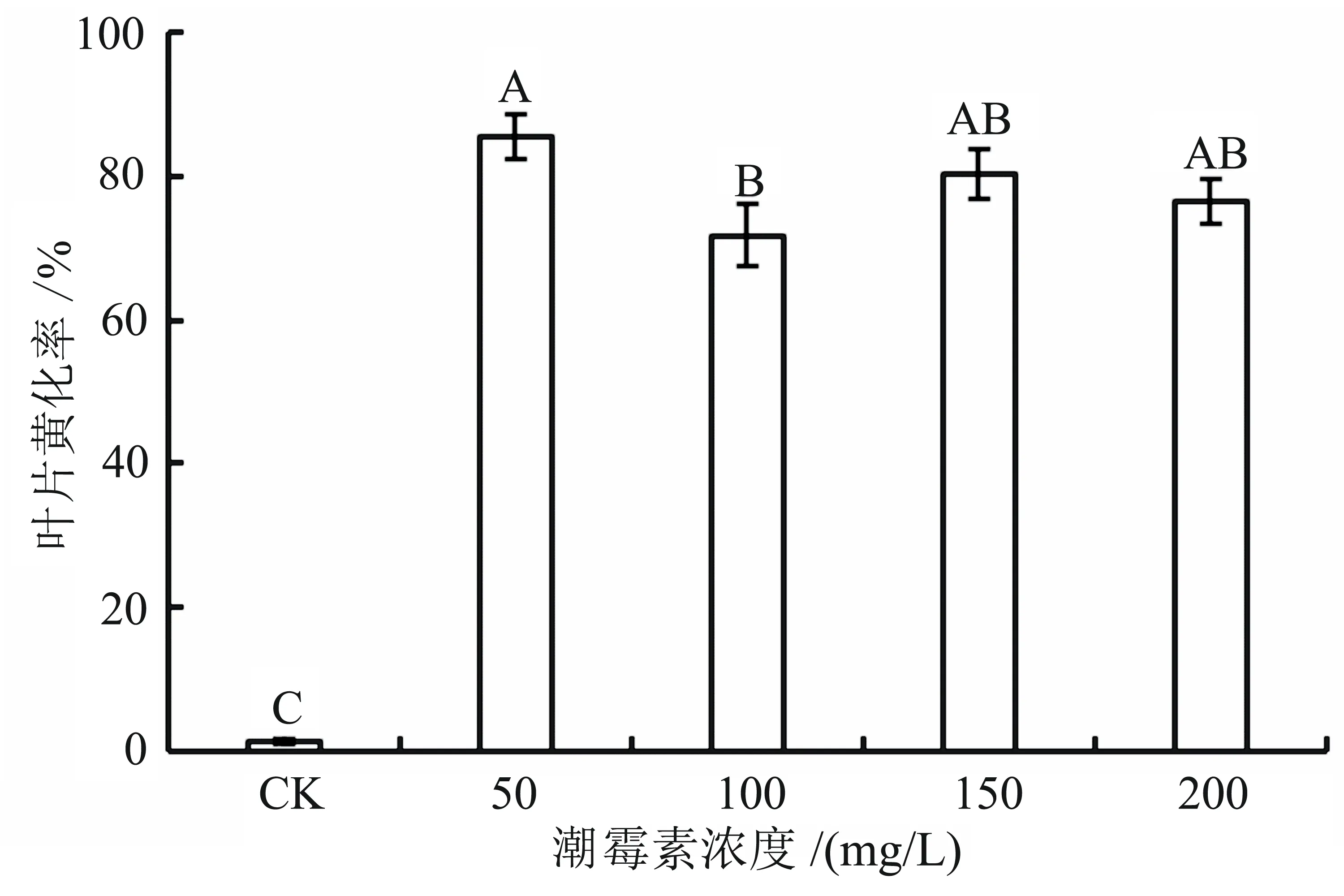
图4 不同潮霉素浓度处理下叶片的黄化面积率

从左到右依次为潮霉素浓度0、50、100、150、200 mg/L。
3 讨论与结论
本研究结果表明,中华结缕草对潮霉素有一定抗性,且不同外植体的耐性不同,其中种子、愈伤组织、离体叶片的筛选浓度分别为50、20、50 mg/L。前人的研究表明,种子的筛选浓度稍高于叶片、茎段、愈伤组织等外植体的[20]。本文中中华结缕草叶片和种子的筛选浓度相近,可能是由于叶片的疏水作用且切口较小,故减轻了药剂的毒害;叶片处理时间较短,故对浓度要求较高。种子作为转基因后代材料,往往需其萌发成苗后才能进行检测。通过抗生素对种子进行检测,有效地缩短了检测时间间隔,也显著降低了工作量[15]。离体叶片检测由于取材方便、效果直观、检测成本小、可信度较高[21],可作为转基因后代检测的一种辅助方法。愈伤组织检测由于其培养时间长、对外界条件敏感,故还需根据实际情况对潮霉素的筛选浓度和筛选时间进行优化,防止其细胞大量死亡而无法正常增殖、分化。
[1] 董厚德,宫莉君.中国结缕草生态学及其资源开发与应用[M].第一版.北京:中国林业出版社,2001.
[2] 宣继萍.结缕草属(ZoysiaWilld.)植物种质资源多样性研究[D].南京:南京农业大学,2008.
[3] 雷江丽,王丹,吴燕民,等.农杆菌浸种法介导中华结缕草遗传转化体系的建立[J].农业生物技术学报,2009(5):865-871.
[4] 王丹.用农杆菌浸种法建立白三叶和中华结缕草遗传转化体系的研究[D].兰州:甘肃农业大学,2008.
[5] 张振霞.几种牧草和草坪草植物遗传转化体系的建立及其转基因研究[D].兰州:甘肃农业大学,2002.
[6] 韦善君.结缕草抗寒性及转录因子CBF1的转化研究[D].武汉:华中科技大学,2006.
[7] 章家长.P_(SAG12)-ipt基因导入延缓中华结楼草衰老研究[D].北京:中国农业大学,2005.
[8] 奚亚军,范学科,侯文胜,等.小麦遗传转化中潮霉素适宜筛选浓度的研究[J].西北农林科技大学学报:自然科学版,2003(1):39-42.
[9] 邹莉,文艺,张匀华,等.大豆子叶节对潮霉素敏感性研究[J].大豆科学,2008(2):267-269.
[10] 王丹,邹莉,王义,等.杨树对潮霉素的敏感性研究[J].吉林农业大学学报,2010(1):47-50.
[11] 于波,刘金梅,刘晓荣,等.两种抗生素对阿拉巴马花烛植株再生的影响[J].广东农业科学,2014(7):53-56.
[12] 刘京,刘建巍,韩天富,等.潮霉素作为筛选剂对大豆发状根诱导的影响[J].大豆科学,2013(4):449-454.
[13] 乔宁宁,邹爱兰,陈崇顺.番茄宝大906高频再生系统的建立及其潮霉素选择压的测定[J].江苏农业科学,2013,41(2):39-42.
[14] 汪玲.725杨再生体系的建立及转Bt基因的研究[D].合肥:安徽农业大学,2012.
[15] 杨桥,蔺自敏,侯详文,等.小麦遗传转化中潮霉素筛选体系的建立及应用[J].麦类作物学报,2014(3):304-310.
[16] 闫美玲.日本结缕草再生体系优化和根癌农杆菌介导PSAG12-IPT基因的转化研究[D].武汉:华中农业大学,2007.
[17] 张磊.几种草坪草转基因及体细胞无性系变异的研究[D].合肥:安徽农业大学,2005.
[18] 许文涛,芦云,罗云波,等.潮霉素磷酸转移酶的致敏性评价研究[J].食品科学,2009,30(1):261-264.
[19] 农业部牧草与草坪种子质量监督检验测试中心.牧草种子检验规程:发芽试验[M].北京:2001.
[20] 于永明,王军辉,麻文俊,等.不同浓度卡那霉素、潮霉素对楸树试管苗生长的影响[J].生物技术通讯,2014(6):832-836.
[21] 殷奎德,张兴梅,郑桂萍,等.一种快速检测转基因水稻潮霉素抗性标记的方法[J].黑龙江八一农垦大学学报,2010(1):45-48.
(责任编辑:黄荣华)
Study on Sensitivity ofZoysiasinensisto Hygromycin
LIU Jian-hua1, PEI Fu-yun1, SONG Feng-ming1, LEI Jiang-li2*
(1. Shenzhen Techand Ecology & Environment Company Limited in Guangdong Province, Shenzhen 518040, China; 2. Fairylake Botanical Garden, Shenzhen & Chinese Academy of Sciences / Shenzhen Key Laboratory of Southern Subtropical Plant Diversity, Shenzhen 518004, China)
The sensitivities of 3 types of explants ofZoysiasinensisto different concentrations of hygromycin solution were studied. The results showed that the sensitivities of different explants ofZ.sinensisto hygromycin were different. Three weeks after the seeds were treated with 50 mg/L hygromycin, their germination rate was very significantly reduced to only 6%. Three weeks after the calluses were treated with 20 mg/L hygromycin, their browning rate reached 62%. Seven days after the isolated leaves were treated with 50 mg/L hygromycin, their yellowing area rate exceeded 85%. Therefore, the optimum concentration of hygromycin for the screening of seed, callus and isolated leaf ofZ.sinensisin genetic transformation was 50, 20 and 50 mg/L, respectively.
Zoysiasinensis; Hygromycin; Sensitivity; Explant
2017-05-16
广东省生态修复技术工程实验室项目(粤发改高技术[2015]162号);立体绿化轻型基质研究工程实验室项目(深发改 [2016]1023号)。
刘建华(1989─),男,重庆人,工程师,从事抗逆植物选育研究。*通讯作者:雷江丽。
S688.4
A
1001-8581(2017)09-0041-04
