大黄素对脑出血大鼠血肿周围脑组织含水量、肿瘤坏死因子-α和谷氨酸表达水平的影响*
2017-09-12彭绍鹏刘建雄崔庆荣周东春
彭绍鹏,刘建雄,崔庆荣,周东春,周 广,王 超
(1.甘肃省人民医院,甘肃 兰州 730000; 2.甘肃省中医药管理局,甘肃 兰州 730000;3.甘肃中医药大学,甘肃 兰州 730000)
·实验研究·
大黄素对脑出血大鼠血肿周围脑组织含水量、肿瘤坏死因子-α和谷氨酸表达水平的影响*
彭绍鹏1,刘建雄1,崔庆荣2,周东春1,周 广3,王 超3
(1.甘肃省人民医院,甘肃 兰州 730000; 2.甘肃省中医药管理局,甘肃 兰州 730000;3.甘肃中医药大学,甘肃 兰州 730000)
目的:探讨大黄素对脑出血大鼠血肿周围脑组织含水量、肿瘤坏死因子-α和谷氨酸表达水平的影响及其治疗脑水肿的可能机制。方法:取自体股动脉血约100 μL,注入大鼠纹状体区域,采用随机分组法分为大黄素治疗组、假手术组和模型对照组3组,每组30只。假手术组和模型对照组以生理盐水灌胃,每次给药剂量为6 μL /g体质量,1 d 2次;大黄素治疗组在造模成功后以6 g/L大黄素混悬液灌胃,给药剂量为100 μg/g体质量,1 d 1次。术后通过大鼠改良Bederson评分进行行为学评定,干湿重法测脑组织含水量,双抗体夹心ELISA法检测脑组织肿瘤坏死因子-α(TNF-α)含量,免疫组化法检测脑组织中谷氨酸(glutamate,Glu)表达。结果:模型对照组的改良Bederson评分明显高于同时间点的假手术组(P<0.05);各时间点的大黄素治疗组的改良Bederson评分均低于同时间点的模型对照组(P<0.05)。模型对照组血肿周围脑组织含水量、TNF-α和Glu与同时间点的假手术组对比,差别均有统计学意义(P<0.05);造模后第5天脑组织含水量、TNF-α和Glu表达均达最高值,3个指标之间呈正相关性。大黄素治疗组血肿周围脑组织含水量、TNF-α和Glu较同时间点的模型对照组均降低,差别均有统计学意义(P<0.05),且3个指标在第5天均达最高值,3者之间呈正相关性。结论:脑出血大鼠出现明显的脑水肿和神经功能损伤,且出血后TNF-α和Glu在第5天达到最高值,可能的生物学效应机制是大黄素抑制炎性因子的释放、降低谷氨酸的表达水平。
大黄素/作用;脑出血;脑水肿;肿瘤坏死因子-α;谷氨酸;动物;大鼠
脑出血(intracerebral hemorrhage,ICH)是脑血管病中发病急、病情严重、致残率和致死率非常高的非外伤性脑实质内出血性疾病[1-2]。病理学研究[3-4]发现:出血后血肿周围脑组织因脑血流改变、脑组织水肿、炎症刺激和细胞凋亡等很容易引起氨基酸的释放,最终导致抑制性和兴奋性氨基酸平衡失调。研究[5]发现:炎性因子可导致脑出血后脑水肿和继发性神经损伤。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)属于前炎性细胞因子,在诱导炎症反应过程中起重要作用[6];谷氨酸(glutamate,Glu) 是凝血酶受体重要的激动剂,在脑细胞的能量代谢中具有加速代谢障碍、诱导细胞凋亡的作用[7]。本研究采用自体血脑内注射法制备脑出血大鼠模型,予以大黄素干预,检测了不同时间点血肿周围脑组织含水量、TNF-α及谷氨酸的表达水平。
1 材料与方法
本实验采用随机对照动物实验,于2016年1月—2016年6月在甘肃中医药大学科研实验中心完成。饲养温度控制在20~25 ℃,光照充足,自由饮食、饮水,所有的实验动物操作程序符合《实验动物管理和使用指南》规定,并经甘肃中医药大学医学伦理委员会批准。
1.1 动 物
SPF级6周龄SD大鼠90只,体质量(200±20) g,雌雄各半,由甘肃中医药大学科研实验动物中心提供,批号SYXK(甘)2015-0001-62001000000038。
1.2 药品、试剂与仪器
大黄素标准品, 20 mg/支,中国药品生物制品检定所提供,批号110756。称取大黄素0.6 g,加90 mL 双蒸馏水、10 mL吐温-80,配置成质量分数6 g/L 的大黄素混悬液,无菌玻璃瓶盛装,封口膜封闭瓶口,置4 ℃冰箱备用,使用前复温至37 ℃且摇匀。小鼠抗大鼠AQP4单克隆抗体,美国Santa Cruz公司产品,批号20100364;改进型柠檬酸钠抗原修复液(50×),上海碧云天公司产品,批号20151026;SAP法检测试剂盒,北京中杉金桥公司产品,批号20160325;BCIP/NBT碱性磷酸酯酶显色试剂盒,上海碧云天公司产品,批号20151018;RT-PCR试剂盒,武汉博士德公司产品,批号20100364。FA 1104型电子分析天平,上海天平仪器厂产品;动物缺氧活动箱,深圳瑞沃德公司产品,批号20151112;BM-E型生物研究显微镜,德国Leica公司产品;Olypums-45型显微生物照相显微镜,日本Olypums公司产品;ND-1000型紫外分光光度计,美国Thermo公司产品;C1000型普通PCR仪、CFX-96型实时定量PCR仪,均为美国BIO-RAD公司产品。
1.3 自体脑出血模型的建立
采用自体血脑内注射法。参照王哲等[8]设计的自体脑出血模型造模方法,具体方法如下:以水合氯醛(100 μg/g)腹腔注射麻醉大鼠;固定于脑立体定位仪上;常规消毒后取中位线位置切开大鼠头皮,去骨膜,暴露前囟,压迫止血;用高速牙科颅钻在颅骨上钻孔(直径约2 mm)至硬脑膜,可见坐标为前囟前0.2 mm、旁开3.5 mm、深5.5 mm,即大鼠纹状体区域;使用胰岛素针取股动脉血约100 μL,立即缓慢匀速(20 μL/min)注射至大鼠纹状体区域;注射完毕停留20 min,缓慢拔出胰岛素针头;骨蜡封闭骨孔;消毒并缝合切口。
1.4 动物分组与给药
将动物随机分为大黄素治疗组、假手术组和模型对照组3组,每组30只。所有的大鼠在脑立体定位后6 h进行首次灌胃,其后按设计频率灌胃直至脑立体定位后7 d时给药结束。假手术组和模型对照组以生理盐水灌胃,每次给药剂量为6 μL /g体质量,1 d 2次;大黄素治疗组在造模成功后以6 g/L大黄素混悬液灌胃,1 d 1次,给药剂量为100 μg/g体质量。
1.5 检测指标
选取出血后5个观察点,即造模成功后的第1,2,3,5,7 天,每个观察点观察6只大鼠。各组均进行行为学检测,检测后处死大鼠,取材,石蜡包埋或流式细胞术检测。
1.5.1 行为学评定
按照改良Bederson法[9],在造模成功后的第1,2,3,5,7天分别观察大鼠的神经功能情况,并给出评分。该评分的高低与神经损伤程度的严重性呈正相关。0分:神经功能基本正常。0.5分:四肢均出现屈曲情况,提尾悬空实验(+)。1分:前肢存在屈曲。1.5分:仅一侧前肢存在屈曲。2分:侧向推力实验(+),前肢可出现屈曲现象。2.5分:抵抗侧推能力下降,同时出现后肢屈曲现象,但大鼠转圈行为不出现。3分:除可以观察到的2分行为以外,还出现自发性旋转现象。
1.5.2 脑组织含水量
按照参考文献[10]测定方法,在相应的时间点常规处死大鼠,去除额极后取病变侧脑组织约2 mm厚,采用干湿重法测定脑出血灶周围脑组织含水量。①脑组织湿重测定: 将脑组织放入事先已称重的锡纸(A表示)中,然后立即称量其质量(B表示),B-A即是脑组织湿重。②脑组织干重测定:将脑组织用A包裹,放入电烤箱内,温度100 ℃ 烘干 24 h后取出,待温度恢复到室温时称量质量(C表示),C-A=干重。③脑组织含水量计算:脑组织含水量=(脑组织湿重-脑组织干重)/脑组织湿重×100%,字母表示为:(B-C)/(B-A)×100%。
1.5.3 脑组织TNF-α含量
在术后不同时间点,以手术针眼为中心取厚约2 mm、质量约200 mg的脑组织;充分磨碎使脑组织浆化,制成400 g/L 组织匀浆;4 ℃ 4 000 r/min离心15 min后取上清液,采用双抗体夹心ELISA法检测脑组织TNF-α含量,严格根据试剂盒说明书进行。
1.5.4 脑组织Glu表达水平
以手术针眼为中心取厚约2 mm、质量约 200 mg 的脑组织,-70 ℃保存;将组织放入质量分数为40 g/L的多聚甲醛(pH 值7.4)固定液固定4 h;转入100,200,300 g/L 蔗糖PBS浸泡以防冰晶;用0.01 mol/L PBS稍作冲洗;在切片机里连续切成厚约10 μm的组织切片,甲苯胺蓝液显色定位。采用免疫组化法检测脑组织中Glu表达,严格按照试剂盒说明书进行操作。采用阳性细胞计数法,每张切片在400倍物镜下分别选取血肿周围不重复的5个视野(HP),计数Glu阳性细胞数,取平均值。
1.6 统计学方法
2 结 果
2.1 各组大鼠改良Bederson评分对比
模型对照组改良Bederson评分明显高于同时间点的假手术组,差别有统计学意义(P<0.05)。各时间点的大黄素治疗组的改良Bederson评分均低于同时间点模型对照组,差别有统计学意义(P<0.05)。见表1。
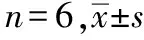
表1 各组大鼠改良Bederson评分对比 分,
注:与同时间点假手术组对比,*P<0.05;与同时间点模型对照组对比,#P<0.05。
2.2 各组大鼠脑组织含水量、TNF-α及Glu表达对比
模型对照组血肿周围脑组织含水量、TNF-α及Glu与同时间点的假手术组对比,差别均有统计学意义(P<0.05);造模后第5天脑组织含水量、TNF-α和Glu表达均达到最高值,3个指标之间呈正相关性。大黄素治疗组血肿周围脑组织含水量、TNF-α和Glu较同时间点模型对照组均降低,差别均有统计学意义(P<0.05),且3个指标在第5天均达最高值,3者之间呈正相关性。见表2。
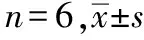
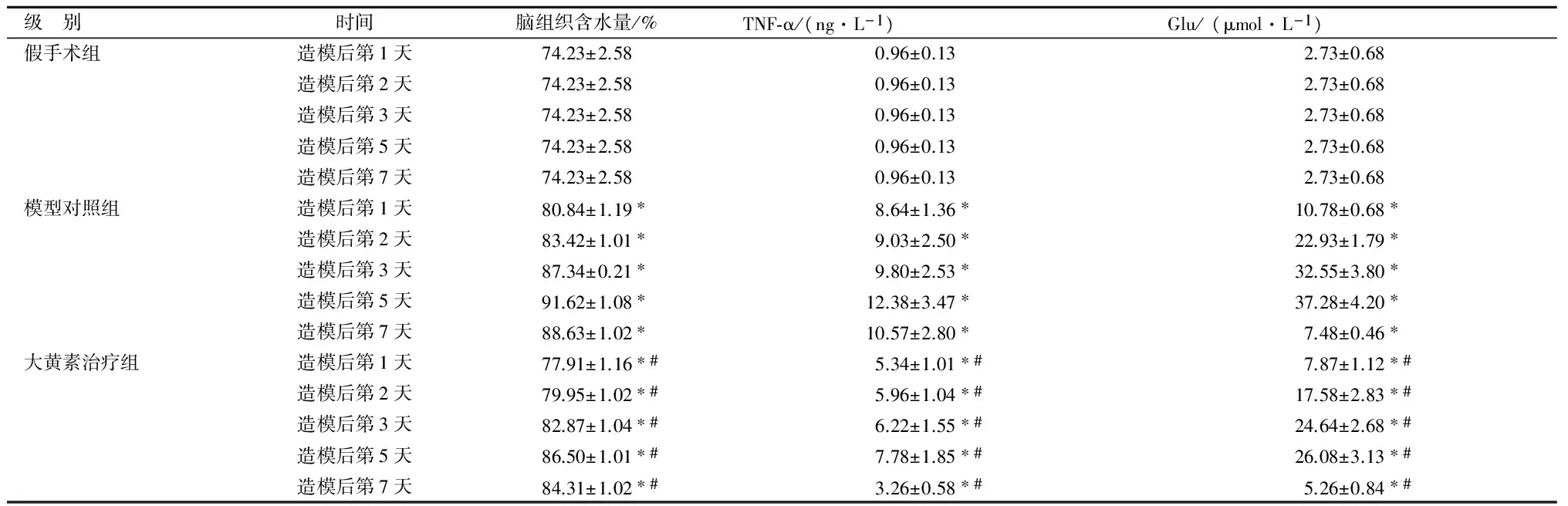
级 别时间脑组织含水量/%TNF⁃α/(ng·L-1)Glu/(μmol·L-1)假手术组造模后第1天74.23±2.580.96±0.132.73±0.68造模后第2天74.23±2.580.96±0.132.73±0.68造模后第3天74.23±2.580.96±0.132.73±0.68造模后第5天74.23±2.580.96±0.132.73±0.68造模后第7天74.23±2.580.96±0.132.73±0.68模型对照组造模后第1天80.84±1.19∗8.64±1.36∗10.78±0.68∗造模后第2天83.42±1.01∗9.03±2.50∗22.93±1.79∗造模后第3天87.34±0.21∗9.80±2.53∗32.55±3.80∗造模后第5天91.62±1.08∗12.38±3.47∗37.28±4.20∗造模后第7天88.63±1.02∗10.57±2.80∗7.48±0.46∗大黄素治疗组造模后第1天77.91±1.16∗#5.34±1.01∗#7.87±1.12∗#造模后第2天79.95±1.02∗#5.96±1.04∗#17.58±2.83∗#造模后第3天82.87±1.04∗#6.22±1.55∗#24.64±2.68∗#造模后第5天86.50±1.01∗#7.78±1.85∗#26.08±3.13∗#造模后第7天84.31±1.02∗#3.26±0.58∗#5.26±0.84∗#
注:与同时间点假手术组对比,*P<0.05;与同时间点模型对照组对比,#P<0.05。
3 讨 论
脑出血严重危害人类的健康,流行病学研究[11]发现:我国每年新发病ICH患者约200万人,每年的发病患者约600万人,死亡率40%~60%,存活患者中伴有不同程度后遗症者约占80%,给患者家庭及社会造成巨大的经济负担和精神负担。研究[12]表明:脑出血时多伴有不同程度的脑水肿和炎性因子释放。TNF-α是前炎性细胞因子,可直接促进中性粒细胞向病灶区聚集,诱导受损细胞释放较多的炎性细胞因子,这与脑出血后周围脑组织水分含量呈正相关性[13]。Glu主要存在于中枢神经系统,是最强的神经兴奋性递质[14]。在机体正常情况下,Glu作用于突触后膜的特异性受体,完成兴奋性突触传递的生理性作用,常常与抑制性神经递质保持着动态平衡。研究[15]发现:Glu含量过高,组织间平衡性被打破,神经毒性释放过度,加重继发性脑损伤的程度。因此,探讨TNF-α和Glu表达水平在脑水肿的发病机制中有着重要意义。脑出血属中医学“出血性中风”范畴,病因较为复杂,属本虚标实之证。相关研究显示痰热腑实证占中风中医分型的74.17%,因此在治疗中给予通腑疗法是十分重要的[16]。近年来,大黄作为泻下药的代表性药物,在脑卒中治疗中的应用引起了国内外研究者的重视[17],但大黄在ICH后病理生理过程中的作用机制并不明确;因此,探讨大黄素对脑出血后脑水肿及血肿周围TNF-α和Glu表达水平的影响,对揭示大黄治疗脑出血的机制有一定意义。《素问·生气通天论》曰:“阳气者,大怒则行气绝、而血菀于上,使人薄厥。”此充分说明了气血并走于上、逆乱犯脑是中风的基本病机。治以通降之法,给予大黄能起到釜底抽薪的作用,使浊气通降、气机疏通、气血下行,最终使神明复苏,气复返则生。大黄素主要存在蓼科植物大黄、虎杖、何首乌等的根茎中,是一种蒽醌类物质。目前,人们对大黄素认知的主要药理作用为抗肿瘤、免疫抑制、解痉止咳、利尿、降压、泻下等,其中脑中的血药浓度约为血中药物浓度的1/5[18]。
从本实验结果可以看出,TNF-α和Glu参与了ICH后脑水肿的形成,随着病情的变化、病程的进展,TNF-α呈动态发展,呈现先上升后下降的趋势,大黄素治疗组的TNF-α在第5天达最高值,此可提示大鼠ICH后脑水肿症状减轻,血肿的TNF-α随之降低,呈正相关性。其可能的机制是:TNF-α在ICH后诱导对其敏感的细胞发生细胞毒性作用,加速细胞凋亡并诱导细胞毒性脑水肿的出现和自由基形成。ICH后脑内血肿压迫局域组织造成局部组织的缺血性再灌注,产生大量的超氧阴离子和炎性反应,激活病灶区的多形白细胞产生大量氧自由基,自由基导致脑组织微血管内皮细胞坏死,引起脑血管通透性增加,进一步加重脑水肿,形成脑组织损伤的恶性循环。从本实验结果可以看出,大黄素干预组大鼠血肿周围Glu含量变化与模型对照组对比差别有统计学意义(P<0.05),与脑组织含水量变化一致,因此,可推断大黄素通过抑制脑出血血肿周围组织中Glu的含量来减轻脑出血后脑水肿程度。
综上所述,TNF-α和Glu在ICH患者的血清中呈高表达,两者的异常增高提示ICH后血肿的严重程度,提示血清中TNF-α和Glu的表达可以作为预测ICH脑水肿病情轻重的重要客观指标。采用大黄素治疗ICH,在缩短血肿吸收时间、减轻脑出血后脑水肿方面作用明确,可能的机制是大黄素抑制TNF-α和Glu的表达。
[1]MAZYA M,EGIDO JA,FORD GA,et al. Predicting the risk of symptomatic intracerebral hemorrhage in ischemic stroke treated with intravenousalteplase: safe Implementation of Treatments in Stroke (SITS) symptomatic intracerebral hemorrhage riskscore[J].Stroke,2012,43(6):1524-1531.
[2]DELCOURT C,ZHANG S,ARIMA H,et al.Significance of Hematoma Shape and Density in Intracerebral Hemorrhage:The Intensive Blood Pressure Reduction in Acute Intracerebral Hemorrhage Trial Study[J].Stroke,2016,47(5):1227-1232.
[3]BROUWERS HB,GOLDSTEIN JN.Therapeutic strategies in acute intracerebral hemorrhage[J].Neurotherapeutics,2011,9(1):87-98.
[4]罗章坤,赵睿,李作孝.重组人红细胞生成素对脑出血大鼠血肿周围肿瘤坏死因子-α的影响[J].国际神经病学神经外科学杂志,2016,43(1):34-38.
[5]陈秀,李作孝,陈忠伦,等.姜黄素对脑出血大鼠血肿周围脑组织肿瘤坏死因子水平的影响[J].中国临床康复,2004,8(31):6920-6922.
[6]崔向宁,李玉波,李妍,等.活血、利水中药对脑出血大鼠脑组织肿瘤坏死因子-α、核转录因子-κB及水通道蛋白-4表达的影响[J].中国中西医结合杂志,2012,32(2):203-208.
[7]贺燕,戴宏伟,姬林,等.脑出血大鼠血肿周围脑组织含水量与基质金属蛋白酶-9、组织基质金属蛋白酶抑制剂1及谷氨酸表达水平的关系[J].临床神经病学杂志,2012,25(5):350-353.
[8]王哲,刘震,刘昕,等.两种实验性大鼠脑出血模型的对比研究[J].第三军医大学学报,2016,38(13):1494-1500.
[9]MACHADO LS,SAZONOVA IY,KOZAK A, et al. Minocyclineand tissue-type plasminogen activator for stroke: assessment of interaction potential[J].Stroke,2009,40 (9):3028-3033.
[10]BAREYRE F,WAHL F,MCINTOSH TK, et al.Time couse of cerebral edema after traumatic brain injury in rats: effects of riluzole and mannitol[J].J Neurotrauma,1997,14(11): 839-849.
[11]杨平,张莉,何英,等.经济欠发达地区老年高血压脑出血患者的现状[J].中国老年学杂志,2013,33(17):4227-4229.
[12]关雪莲,侯丽淳,王辰,等.大鼠脑出血周边组织谷氨酸、脑水含量和细胞凋亡的变化及碱性成纤维生长因子的影响[J].中风与神经疾病杂志,2013,30(4):325-328.
[13]EWQN T,QIUTING L,CHAOGANG T,et al. Neuroprotective Effect of Atorvastatin Involves Suppression of TNF-α and Upregulation of IL-10 in a Rat Model of Intracerebral Hemorrhage[J].Cell Biochem Biophys,2013,66(2):337-346.
[14]XU X,ZHANG J,CHEN X,et al.The increased expression of metabotropic glutamate receptor 5 in subventricular zone neural progenitor cells and enhanced neurogenesis in a rat model of intracerebral hemorrhage[J].Neuroscience,2011,207(202):474-483.
[15]SHARP F,LIU DZ,ZHAN X,et al.Intracerebral hemorrhage injury mechanisms: glutamate neurotoxicity, thrombin, and Src[J].Acta Neurochirurgica,2008,10(5):43-46.
[16]曾大方.略谈腑气不通在中风病中的地位及临床意义[J].吉林中医药,1984, 7(1):14-15.
[17]CHEN CF,SHUM YC,YANG SP.The modernization of traditional Chinese medicine in Taiwan past, present and future[J]. Adv Exp Med Biol,2004,54(6):35-42.
[18]杨世颖,刘淑聪,杜冠华,等.大黄中药材及其醇、水提取物中大黄素成分分析标准物质研究[J].中国中药杂志,2016,41(3):456-462.
(编辑 陶 珠)
1001-6910(2017)08-0063-05
R743.34
B
10.3969/j.issn.1001-6910.2017.08.28
刘建雄,教授,主任医师,医学博士,ljx-512@163.com
甘肃省中医药管理局立项课题(GZK-2016-7)
2016-11-21;
2017-07-03
