六钼酸/苄基三乙基氯化铵催化合成氧杂蒽二酮类衍生物
2017-09-11连朝美朱育林
方 宇, 罗 君, 连朝美, 朱育林, 曾 卓
(华南师范大学化学与环境学院, 广州 510006)
六钼酸/苄基三乙基氯化铵催化合成氧杂蒽二酮类衍生物
方 宇, 罗 君, 连朝美, 朱育林*, 曾 卓
(华南师范大学化学与环境学院, 广州 510006)
在六钼酸和苄基三乙基氯化铵(BTEAC)的复合催化作用下,以芳香醛为原料,分别与1,3-环己二酮和5,5-二甲基-1,3-环己二酮在乙腈溶剂中,通过缩合反应得到一系列高产率氧杂蒽二酮类衍生物;并在此基础上探讨了合成该类化合物的最佳反应溶剂、最佳催化剂、最佳稳定剂及其用量等,同时验证了该催化体系可重复使用5次而催化活性无明显降低. 最后提出了可能的反应机理.
六钼酸; 氧杂蒽二酮类衍生物; 芳香醛; 缩合反应
氧杂蒽类化合物是一类重要的蒽环类衍生物. 其中,二苯并氧杂蒽类衍生物和氧杂蒽酮类衍生物的研究相对较多[1]. 由于氧杂蒽二酮类化合物具有刚性的碳骨架结构,因此常常被用来构建具有催化作用的手性二齿配体[2]. 此外,氧杂蒽二酮类衍生物具有重要的生理和药理活性,如抗菌[3]、抗癌[4]、抗病毒[5]、抗过敏、抗发育不良[6]、降血糖,并可用于治疗过敏性气管炎[7]等. 因此得到许多药物化学家和有机化学家的重视[8].
国内外关于氧杂蒽二酮类化合物合成方法的报道不断推陈出新. 经典的合成方法是通过芳香醛与含活泼亚甲基的羰基化合物在酸或碱催化条件下进行. 常用的催化剂包括无机酸、路易斯酸,如InCl3[9]、BF3-Et2O[10]、SnCl4[11]、I2[12]、P2O5/Al2O3[13]、KAl(SO4)2·12H2O[14]、NaHSO4-SiO2[15]、SbCl3/SiO2[16]、HCO2H/H2O[17]等. 但是在上述酸性催化环境中,副反应较多、后处理操作复杂、设备腐蚀严重、环境污染严重. 因此,寻找价廉、高效、反应条件温和的催化剂具有重要意义.
近些年来,多酸在材料化学、生物化学、医药化学等领域都发挥着巨大的作用. 杂多酸在不对称催化反应、缩合反应、水合和脱水反应、Diels-Alder[18]反应等有机反应中有着独特的催化效果[19]. 在探究反应的过程中,本课题组发现季铵盐和多酸作为催化体系的两部分,对反应的催化起到了良性的相互促进作用,具有催化剂用量少、条件温和、产率与选择性高、后处理简单等诸多优点. 因此,本文选用六钼酸和季铵盐作用形成复合催化剂,引入芳香醛和1,3-环己二酮(5,5-二甲基-1,3-环己二酮)的反应中,通过Knoevenagel缩合、Michael加成和环缩合反应,得到一系列的氧杂蒽二酮衍生物.
1 实验部分
1.1 仪器和试剂
显微熔点仪(XT-5型,上海精科实业有限公司)、薄层层析硅胶板(青岛市基亿达硅胶试剂厂)、三用紫外仪(上海安亭仪器厂)显色等.
苯甲醛、4-氟苯甲醛、2-氯苯甲醛、3-氯苯甲醛、4-氯苯甲醛、2-溴苯甲醛、3-溴苯甲醛、4-溴苯甲醛、3-硝基苯甲醛、4-硝基苯甲醛、4-甲基苯甲醛、2-甲氧基苯甲醛、4-甲氧基苯甲醛、2,4-二氯苯甲醛、4-羟基苯甲醛、1,3-环己二酮、5,5-二甲基-1,3-环己二酮、二氯甲烷、丙酮、无水乙醇、乙腈、甲醇、二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、氯化钯、溴化钯、碘化钯、双三苯基磷二氯化钯、三(二亚苄基丙酮)二钯、二(2,4-戊二酮)二氧钼、苄基三乙基氯化铵(BTEAC)、四乙基溴化铵、四丁基溴化铵、四甲基碘化铵、四丁基碘化铵均为市售化学纯或分析纯. 六钼酸为实验室自制. 其中液体芳香醛反应前经重蒸;固体芳香醛经重结晶,乙醇等有机溶剂经干燥纯化处理.
1.2 合成方法
在50 mL圆底烧瓶内依次加入芳香醛1(2.5 mmol),1,3-环己二酮2a(5 mmol)或5,5-二甲基-1,3-环己二酮2b(5 mmol),溶剂乙腈3(10 mL),催化剂六钼酸4(0.20 g)和BTEAC 5(0.06 g),70 ℃反应2~10 h,利用薄层层析技术检测反应进程. 待反应完全后冷却至室温,抽滤,滤饼用无水甲醇重结晶,洗涤干燥,得到产物6或7(图1).
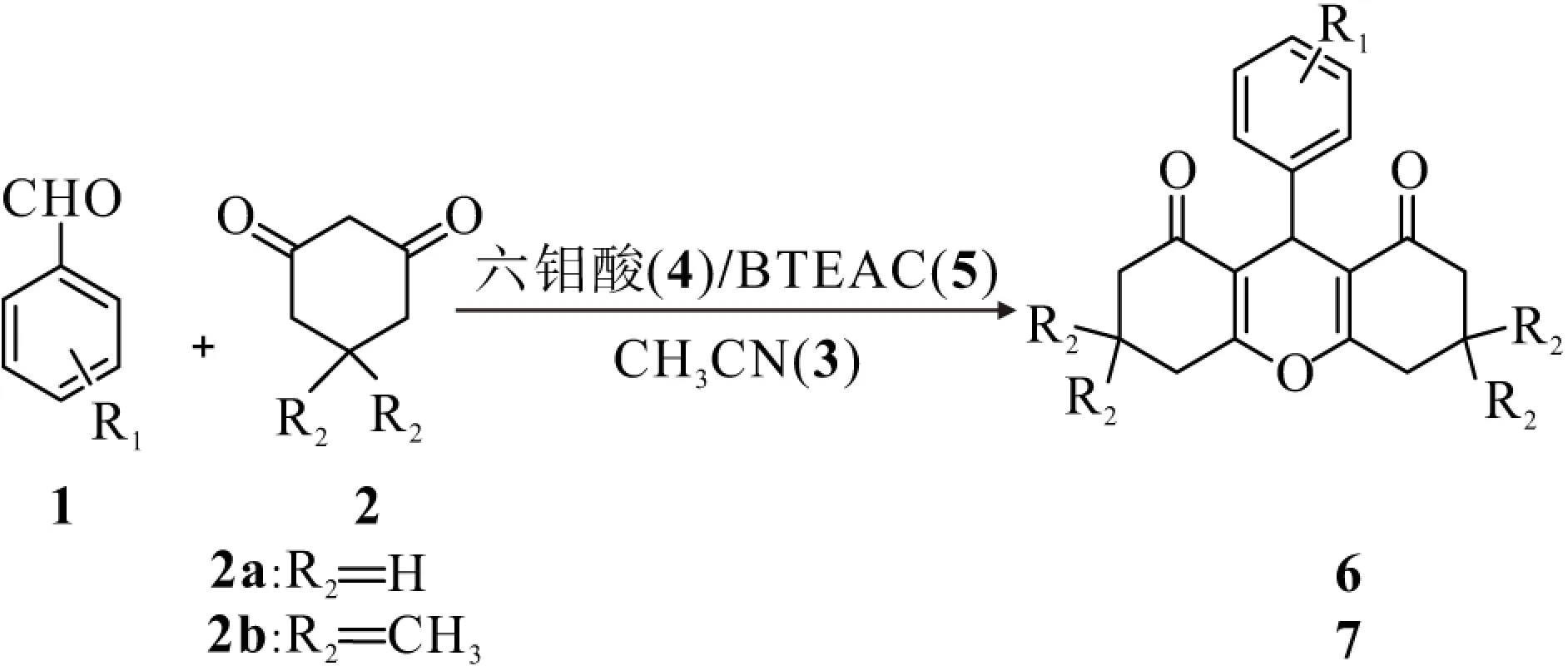
图1 反应方程式
1.3 实验条件对反应的影响1.3.1 溶剂的影响 实验以对硝基苯甲醛1(2.5 mmol)、1,3-环己二酮2(5 mmol)、六钼酸4(0.20 g)、BTEAC 5 (0.06 g)为标准反应,反应时间为2~12 h,温度为70 ℃,分别采用不同极性的溶剂(CH2Cl2、丙酮、乙醇、CH3CN、CH3OH、二甲基甲酰胺、二甲基亚砜、CH3CN/DMF、CH3CN/DMSO)做对比实验,研究溶剂对合成反应的影响. 1.3.2 催化剂的影响 探究实验以对硝基苯甲醛1(2.5 mmol)、1,3-环己二酮2(5 mmol)为原料,在乙腈溶剂中反应4 h,分别采用多种催化剂(PdCl2、PdBr2、PdI2、Pd(OAc)2、Pd(PPh3)2Cl2、Pd2(dba)3、Mo(acac)2O2、六钼酸)做对比实验,从而探究本实验的最佳催化剂.
1.3.3 复合催化剂种类及用量的影响 为了探讨复合催化剂的种类和用量对反应的影响,以对硝基苯甲醛1(2.5 mmol)、1,3-环己二酮2(5 mmol)、溶剂乙腈3(10 mL)为标准反应,反应时间为4 h,反应温度为70 ℃,在反应中分别加入不同的季铵盐,以探究不同的复合催化剂及其用量对反应的影响.
1.3.4 催化剂的重复使用 研究六钼酸/BTEAC的重复使用,以对硝基苯甲醛1(2.5 mmol)、1,3-环己二酮2(5 mmol)、溶剂乙腈3(10 mL)、六钼酸4(0.20 g)、BTEAC 5(0.06 g)为标准反应,反应时间为4 h,反应温度为70 ℃. 待反应完全,将反应体系放入冰箱中冷却结晶,抽滤得到产品. 此时母液中含有六钼酸/苄基三乙基氯化铵复合催化剂,可以循环使用,向上述母液中加入n(对硝基苯甲醛)∶n(1,3-环己二酮)为1∶2的原料,重复上述标准反应,研究复合催化剂重复使用的催化活性的变化.
1.3.5 底物的拓展 按照优化的反应条件,选用多种取代基的芳香醛、1,3-环己二酮或5,5-二甲基-1,3-环己二酮为底物,以六钼酸/BTEAC为复合催化剂,乙腈为溶剂,加热回流反应2~12 h,根据反应产物及其产率结果探索该复合催化剂的适用范围.
2 结果与讨论
2.1 溶剂种类对反应的影响
由于溶剂的极性对反应物的溶解性、催化剂的催化活性等均有影响,因此采用多种常用溶剂反应,从而探究反应的最佳溶剂(表1). 以CH2Cl2为溶剂时,产率无法测出,说明催化剂六钼酸很难溶解,反应几乎无法发生;在丙酮、甲醇、乙醇中产率有所提高,但是反应时间较长;而当使用极性更大的溶剂DMF、DMSO时,催化剂溶解性良好,产率也相对较高,但反应时间较长,同时会有另外一种四酮类结构的副产物生成. 探究发现以乙腈作为溶剂时,产物产率可以达到95%,反应时间也较短. 此外,当使用复合溶剂时并没有使用单一溶剂乙腈时效果好,因此,综合考虑乙腈是该反应体系最适宜的溶剂.
2.2 催化剂的种类对反应的影响
在其它条件均相同的情况下,采用不同的催化剂催化同一反应时,反应的收率大有不同,其中采用六钼酸作为催化剂时反应收率最高,催化效果最好(表2). 因此,本实验采用六钼酸作为催化剂.
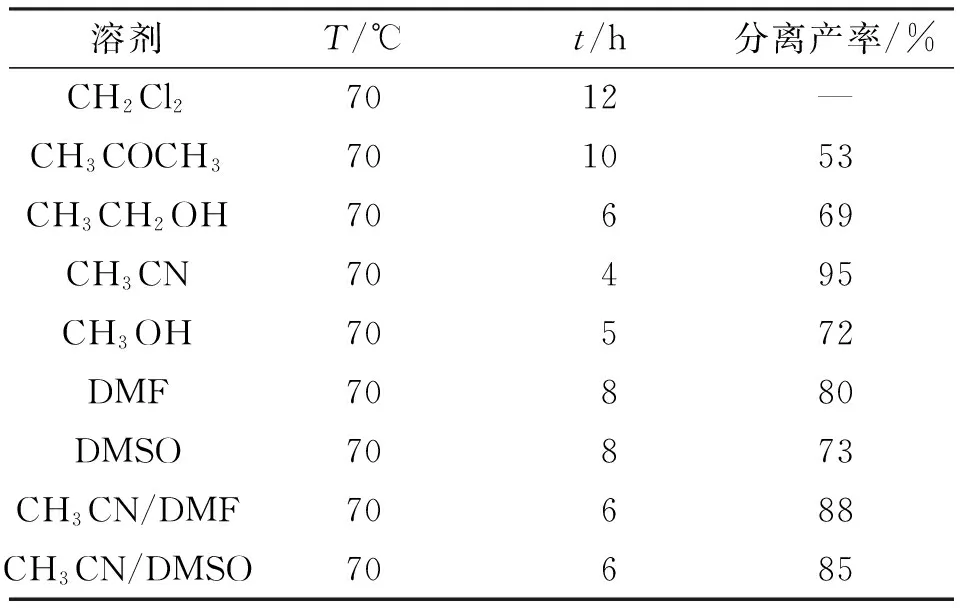
表1 溶剂种类对反应的影响Table 1 Impact of solvents on the reaction
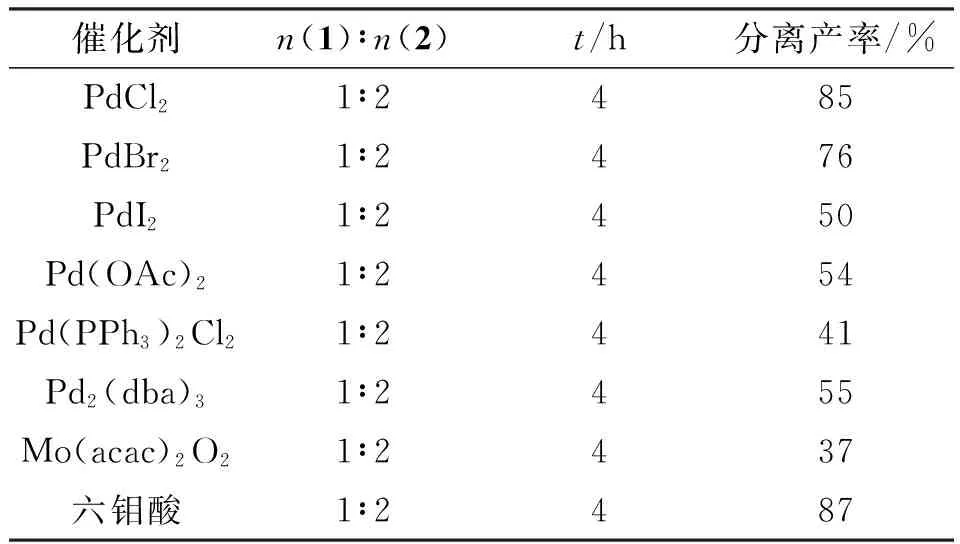
表2 催化剂种类对反应的影响Table 2 Impact of catalysts on the reaction
2.3 复合催化剂种类及用量对反应的影响
采用季铵盐作为反应的促进剂,将其与六钼酸作用形成复合催化剂(表3). 不加入季铵盐形成复合催化剂,反应可以发生,但是产率较低;分别加入不同类型的季铵盐,产物的产率各不相同. 综上可知,复合催化剂对本反应的产率影响很大,最佳的促进剂是苄基三乙基氯化铵.
表3 复合催化剂种类及用量对反应的影响
Table 3 Impact of composite catalysts and the doses on the reaction
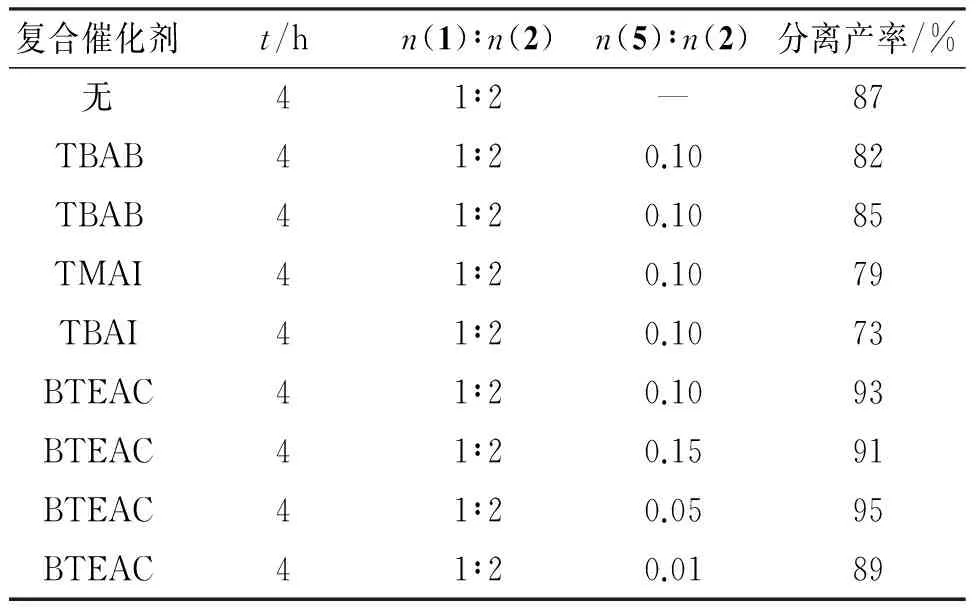
复合催化剂t/hn(1)∶n(2)n(5)∶n(2)分离产率/%无41∶2—87TBAB41∶20.1082TBAB41∶20.1085TMAI41∶20.1079TBAI41∶20.1073BTEAC41∶20.1093BTEAC41∶20.1591BTEAC41∶20.0595BTEAC41∶20.0189
进一步探究复合催化剂的用量对产率的影响,由表3结果可知,当n(BTEAC)超过二酮类原料的5%后,对产率(95%)的影响不大;当其物质的量低于二酮类原料的5%时,反应不完全,产率较低;因此,综合经济效益和反应完成程度考虑,反应中所加的稳定剂BTEAC最佳物质的量为二酮类原料的5%.
2.4 催化剂的重复使用
复合催化剂六钼酸/ BTEAC的重复使用5次仍然可以得到产品. 在循环使用过程中,无需重新添加复合催化剂,且催化活性没有明显降低(表4). 反应循环5次,反应的产率仍然保持在较高的水平,而且复合催化剂的回收量也没有明显减少,催化剂在5次循环使用后仍能保持较好的催化效果. 因此,催化剂六钼酸/BTEAC是一种用量少、高效、可循环使用的催化体系.
表4 六钼酸/BTEAC体系循环催化的产率
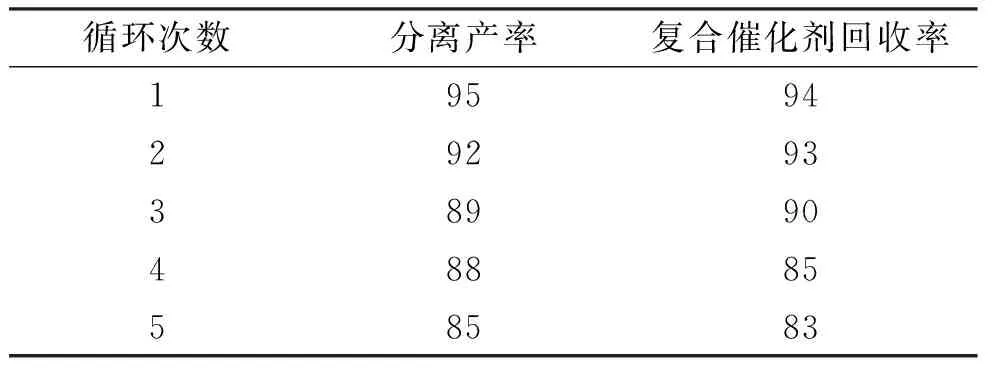
Table 4 Yields of cycliccatalytic reactions with hexamolybdate/BTEAC %
2.5 底物的拓展
为了探索本复合催化剂的适用范围,按照上述的优化反应条件,选用多种取代基的芳香醛、1,3-环己二酮或5,5-二甲基-1,3-环己二酮为底物,以六钼酸/BTEAC为复合催化剂,乙腈为溶剂,加热回流反应2~12 h,底物拓展合成的化合物结构式如图2所示,反应条件及其分离产率如表5所示. 无论芳香醛的取代基为供电子取代基或吸电子取代基,均可以得到高产率高纯度的一系列氧杂蒽二酮类化合物,通过对比可知,含有吸电子取代基的芳香醛较含有供电子取代基的芳香醛更易反应,产率更高(表5中序号10~11),推测原因可能在于芳香醛上连有吸电子取代基可以增加羰基碳原子的亲电性,从而有利于反应发生;另外,取代基的位次对于反应的难易程度和产率也有影响,对比可知当取代基位于对位时,反应较取代基位于邻、间更易发生,产率也相对较高(表5中序号6~8),推测原因在于当取代基位于邻、间位时位阻较大,反应活性降低. 综上可知,本催化体系的底物适用范围广泛、条件温和、操作简单、价廉高效.
2.6 实验机理推测
通过分析实验结果,对合成氧杂蒽衍生物的机理进行研究,认为首先1 mol 5,5-二甲基-1,3-环己二酮与1 mol芳香醛在六钼酸/BTEAC的催化下发生 Knoevenagel 缩合,后与1 mol 5,5-二甲基-1,3-环己二酮发生 Michael 加成,再结合1 mol质子氢,最后迅速脱水环化得到最终产物(图3).
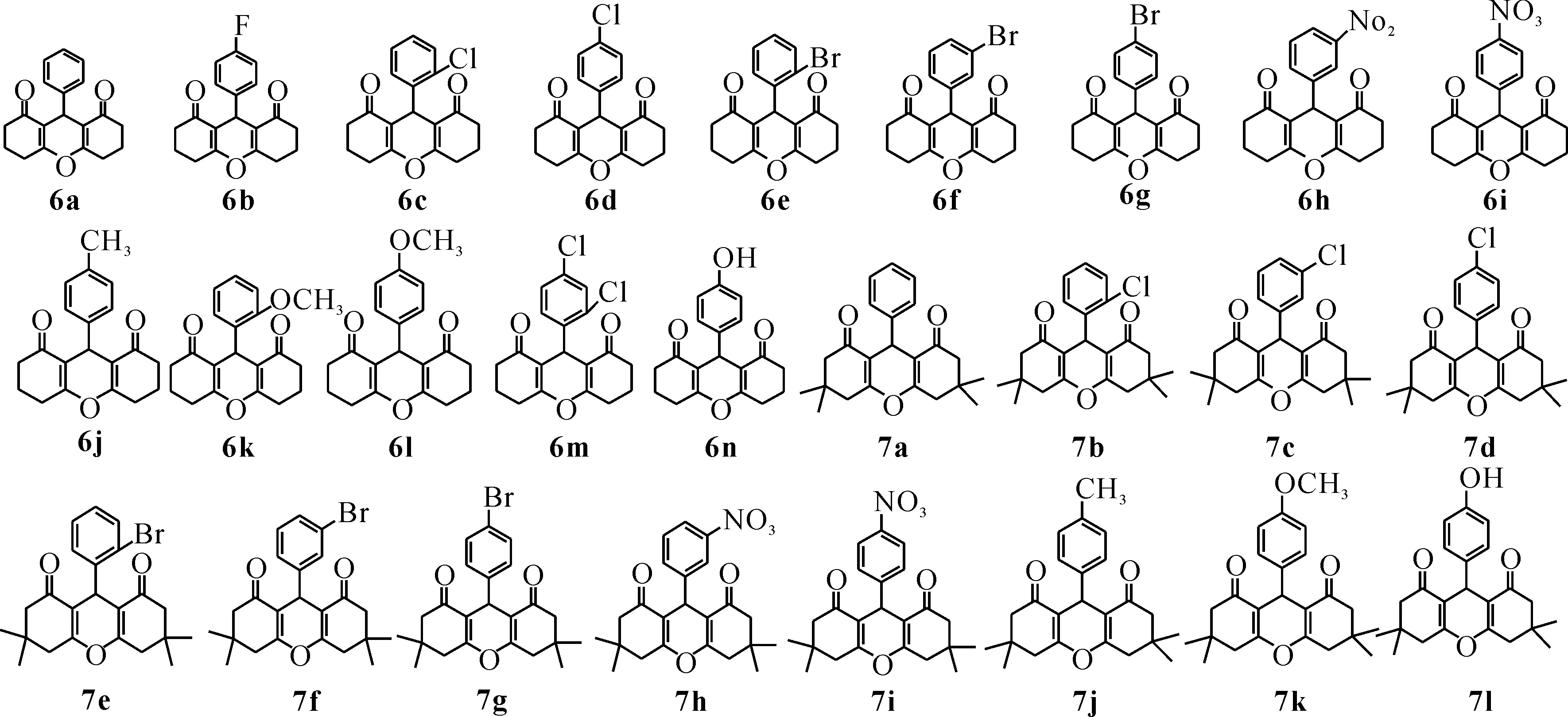
图2 化合物的结构式
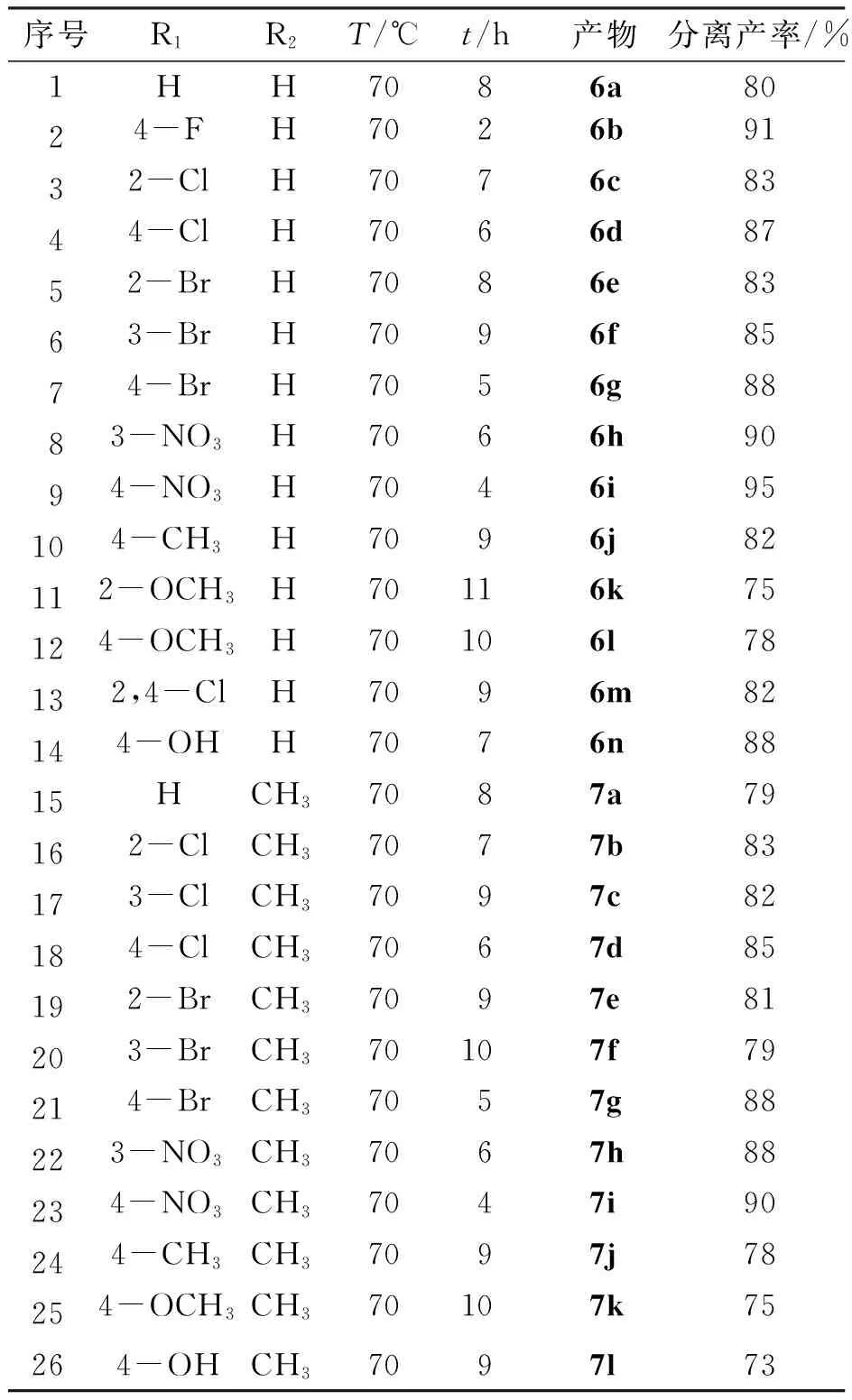
序号R1R2T/℃t/h产物分离产率/%1HH7086a8024-FH7026b9132-ClH7076c8344-ClH7066d8752-BrH7086e8363-BrH7096f8574-BrH7056g8883-NO3H7066h9094-NO3H7046i95104-CH3H7096j82112-OCH3H70116k75124-OCH3H70106l78132,4-ClH7096m82144-OHH7076n8815HCH37087a79162-ClCH37077b83173-ClCH37097c82184-ClCH37067d85192-BrCH37097e81203-BrCH370107f79214-BrCH37057g88223-NO3CH37067h88234-NO3CH37047i90244-CH3CH37097j78254-OCH3CH370107k75264-OHCH37097l73
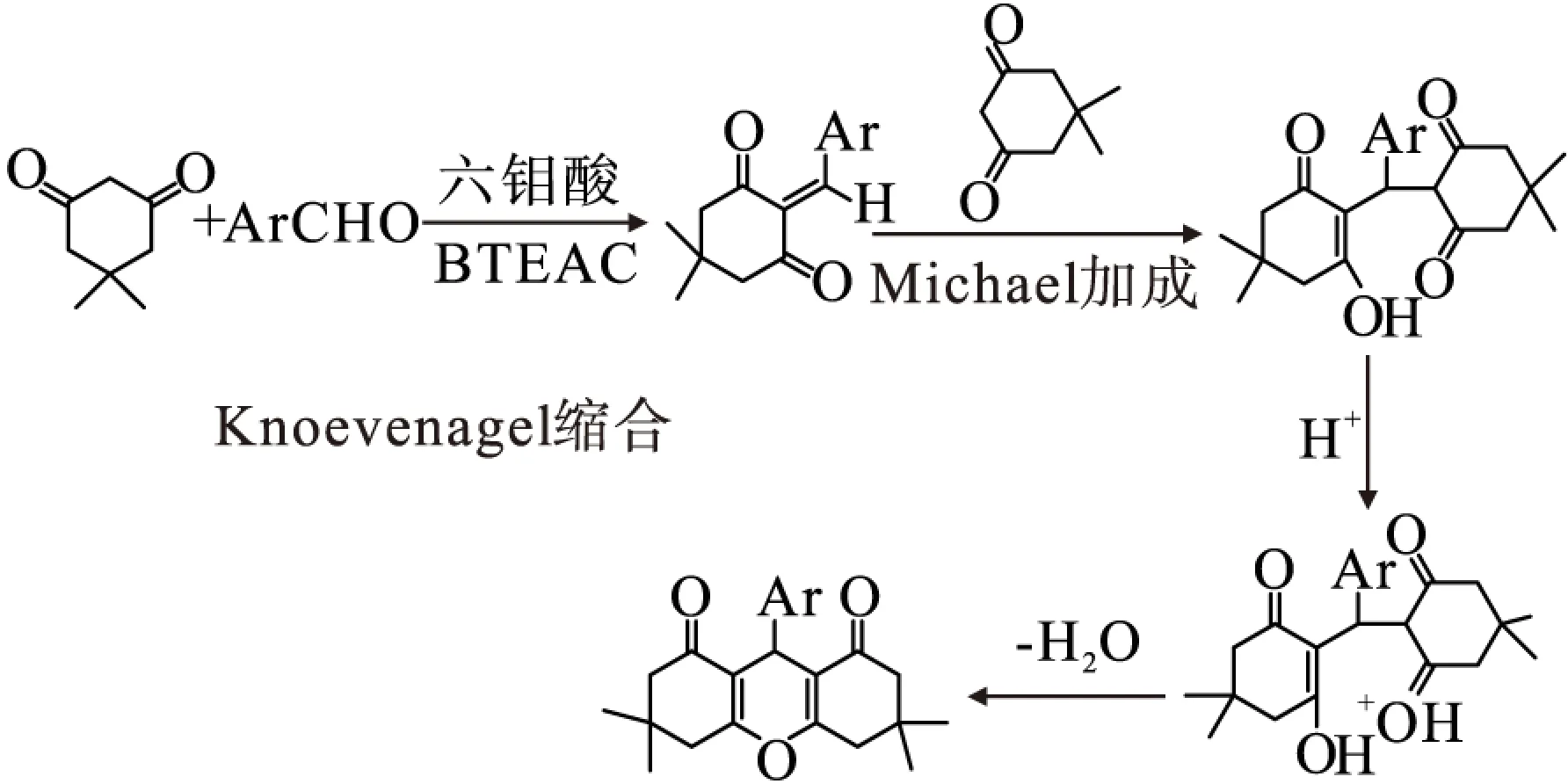
图3 反应机理
另一方面,在本催化体系中季铵盐并没有参与反应过程,而是作为促进剂和六钼酸共同作用,六钼酸部分提供催化活性,季铵盐部分提供相转移能力,两部分结合在一起对催化起到协同作用.
3 结论
以六钼酸/BTEAC为复合催化剂,通过Knoevenagel缩合、Michael加成和环缩合反应高效率的合成了一系列氧杂蒽二酮类衍生物. 反应体系中所使用的复合催化剂可以循环利用,对污染环境小,从经济效益和环境友好角度均为较优的选择. 该方法克服了其他合成方法中存在的不同程度的条件苛刻、催化效率低、副产物较多、等缺点,具有催化剂用量少、条件温和、后处理简单、催化剂可循环利用等优点. 也通过对比试验确定出反应的优化条件,为氧杂蒽二酮类化合物的合成提供了一种新的方法.
[1] 宋永彬,刘波. 新型氧杂蒽和呋喃衍生物的合成及其抗肿瘤活性研究[D]. 哈尔滨: 哈尔滨工业大学,2013.
[2] 赵新海,李燕萍,刘晨江. 嘧啶酮和氧杂蒽化合物的合成研究[D]. 乌鲁木齐: 新疆大学,2010.
[3] EL-BRASHY A M,METWALLY E S,EISEPAI F A. Spectrophotometric determination of someuoroquinolone antibacterials by binary complex formation with xanthene dyes[J]. Farmaco,2004,59(10): 809-817.
[4] MULAKAYALA N,MURTHY P V N S,RAMBABU D,et al. Catalysis by molecular iodine: a rapid synthesis of 1,8-dioxo-octahydroxanthenes and their evaluation as potential anticancer agents[J]. Bioorganic & Medicinal Chemistry Letters,2012,22(6): 2186-2191.
[5] CHIBALE K,VISSER M R,SCHALKWYK DV,et al. Exploring the potential of xanthene derivatives as trypanothione reductase inhibitors and chloroquine potentiating agents[J]. Tetrahedron,2003,59:2289-2296.
[6] BROOKS G T,OTTRIDGE A P,MACE D W. The effect of some furochromene and benzochromene analogues of 2,2-dimethyl-7-methoxychromene (precocene I) and benzofuran precursors on Oncopeltus fasciatus (dallas) and Locusta migratoria migratorioides (R&F)[J]. Pesticide Science,2006,22(1):41-50.
[7] ION R M. The photodynamic therapy of cancer-a photosensitization or a photocatalytic process[J]. Progress in Catalysis,1997,2:55-76.
[8] SATO N,JITSUOKA M,SHIBATA T,et al. (9S)-9-(2-Hydroxy-4,4-dimethyl-6-oxo-1-cyclohexen-1-yl)-3,3-dimethyl-2,3,4,9-tetrahydro-1H-xanthen-1-one,a Selective and Orally Active Neuropeptide Y Y5 Receptor Antagonist[J]. Journal of Medicinal Chemistry,2008,51(15):4765-4770.
[9] VERMA G K,RAGHUVANSHI K,VERVIA R K,et al. An efficient one-pot solvent-free synthesis and photophysical properties of 9-aryl/alkyl-octahydroxanthene-1,8-diones[J]. Tetrahedron,2011,67(20):3698-3704.
[10]SHUKLA Q VERMA R K,VERMA G K,et al. Solvent-free sonochemical one-pot three-component synthesis of 2H-Indazolo[2,1-b]Phthalazine-1,6,11-Triones and 1 H-Pyrazolo[1,2-b]Phthalazine- 5,10-Diones[J]. Tetrahedron Letters,2011,52(52):7195-7198.
[11]LIANG B O,KALIDINDI S,PORCO J A,et al. Multicomponent reaction discovery: three-component synthesis of spirooxindoles[J]. Organic Letters,2010,12(3): 572-575.
[12]WANG R Z,ZHANG L F,CUI Z S. Iodine-catalyzed synthesis of 12-aryl-8,9,10,12-tetrahydro-benzo[a]xanthen-11-one derivatives via multi-component reaction[J]. Synthetic Communications,2009,39: 2101-2107.
[13]ZAREI A,HAJIPOUR A R,KHAZDOOZ L. The one-pot synthesis of 14-aryl/alkyl-14H-dibenzo[a,j]xanthenes catalyzed by P2O5/Al2O3under microwave irradiation[J]. Dyes Pigments,2010,85(1): 133-138.
[14]DABIRI M,BAGHBANZADEH M,NIKCHEH M S,et al. Eco-friendly and efcient one-pot synthesis of alkyl-or aryl-14H-dibenzo[a,j]xanthenes in water[J]. Bioorga-nic & Medicinal Chemistry Letters,2008,18(1):436-438.
[15]DAS B,THIRUPATHI P,RAVINDER R K,et al. An efficient synthesis of 1,8-dioxo-octahydroxanthenes using heterogeneous catalysts[J]. Catalysis Communications,2007,8:535-538.
[16]ZHANG Z H,LIU Y H. Antimony trichloride/SiO2promoted synthesis of 9-ary-3,4,5,6,7,9-hexahydroxanthene-1,8-diones[J]. Catalysis Communications,2008,9(1):1715-1719.
[17]张美月,刘敏,李越敏. 无相转移剂水相中3,3,6,6-四甲基-9-芳基-1,2,3,4,5,6,7,8-八氢化氧杂蒽-1,8-二酮的合成[J]. 化学试剂,2009,31(12):1026-1028.
[18] 王广健,刘广卿,杨振兴,等. Keggin 杂多酸负载型催化剂研究及在有机合成中的应用[J]. 有机化学,2009,29(7):1039-1047.
WANG G J,LIU G Q,YANG Z X,et al. Catalysis loaded with kegging heteropolyacids and their application to organic synthesis[J]. Chinese Journal of Organic Chemistry,2009,29(7):1039-1047.
[19]ZHANG F M,YUAN C S,WANG J,et al. Synthesis of fructone over dealmuinated USY supported heteropoly acid and its salt catalysts[J]. Journal of Molecular Catalysis A Chemical,2006,247(1/2):130-137.
【中文责编:谭春林 英文审校:李海航】
Hexamolybdate / BTEAC Composite Catalyzed Synthesis of Xanthenedione Derivatives
FANG Yu, LUO Jun, LIAN Chaomei, ZHU Yulin*, ZENG Zhuo
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006,China)
A series of xanthenedione derivatives were efficiently synthesized by condensation reaction from aromatic aldehydes and 1,3-cyclohexanedione or 5,5-dimethyl-1,3-cyclohexane dione which were co-catalyzed by hexamolybdate and benzyl triethyl ammonium chloride (BTEAC). In addition, the reaction solvent, composite catalyst and its dosage were studied. The catalytic system can be easily separated and reused for up to four times without loss of catalytic activities. The possible reaction mechanism is proposed.
hexamolybdate; xanthenedione derivatives; aromatic aldehyde; condensation reaction
2015-10-28 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(21272080)
O621
A
1000-5463(2017)04-0034-05
*通讯作者:朱育林,副教授,Email: labzhu@aliyun.com.
