间苯三酚栓剂在家兔体内的药动学研究
2017-09-11廖昌军凌保东王茜廖丽云陈秀明
廖昌军,凌保东,王茜,廖丽云,陈秀明
(1.四川省高校结构特异性小分子药物重点实验室,四川成都610083;2.成都医学院药学院,四川成都610083)
间苯三酚栓剂在家兔体内的药动学研究
廖昌军1,2,凌保东1,2,王茜2,廖丽云2,陈秀明2
(1.四川省高校结构特异性小分子药物重点实验室,四川成都610083;2.成都医学院药学院,四川成都610083)
建立液相色谱-质谱联用(LC-MS)测定间苯三酚血药浓度的方法,并研究间苯三酚栓剂在家兔体内的药动学特征。取6只健康家兔直肠给予间苯三酚栓剂,于给药前和给药后5,10,15,18,20,25,30,45,60,90,120,180 min分别自耳动脉采血0.5mL。采用LC-MS检测其血药浓度,安捷伦C18柱(4.6mm×50mm,1.7μm),流动相甲醇-水(含0.1%甲酸)梯度洗脱,三重串联四级杆质谱电喷雾(ESI)离子源,多反应监测(MRM)方式进行检测,离子化方式为正模式,进样量为2μL。采用DAS3.0药动学软件计算其在家兔体内的药动力学参数。间苯三酚在0.1725~5.52mg/L质量浓度范围内与其峰面积与内标峰面积的比值呈良好的线性关系。间苯三酚在家兔体内的药动学参数t1/2,Tmax,Cmax,AUC0-∞分别为65.733min,15min,1.2773mg/L,39.993(mg·min)/L。该方法专属性强、精密度好,可用于间苯三酚家兔体内的药动学研究。间苯三酚栓剂在家兔体内代谢过程符合一室模型。
间苯三酚;栓剂;液相色谱-质谱联用;药动学
0 引言
间苯三酚是目前应用较广泛的新型平滑肌解痉药[1-2],能直接作用于胃肠道和泌尿生殖道的平滑肌,对正常平滑肌影响较小[3-4],解痉效果快,疗效显著,临床应用非常广泛[5-8]。目前间苯三酚市售的剂型有注射剂、颗粒剂、注射粉末和口服冻干片等,主要用于消化科和妇科上的痉挛性疾病[9-10]。关于间苯三酚制剂和原料药等的体外含量测定研究报道较多,体内药代动力学研究国内报道甚少。杨瑞玲等[11]进行了间苯三酚颗粒口服给药在家兔体内的药动学研究,而间苯三酚直肠给药后体内药动学研究文献国内未见报道。本文在杨瑞玲[11]建立的家兔血浆中LC-MS含量测定方法的基础上,对间苯三酚栓剂直肠给药后体内药动学特征进行了研究,为间苯三酚栓剂的进一步开发与利用提供理论依据。
1 材料与仪器
1.1 仪器
电子天平(CP225D,德国赛多利斯科学仪器有限公司);旋涡混合器(XW-80A,上海青浦泸西仪器厂);离心机(Heraeus Pico 17,ThermoFisher);氮吹仪(MTN-2800D,天津奥特塞恩斯仪器有限公司);液质联用仪(6410B,安捷伦三重串联四级杆质谱)。
1.2 试剂
间苯三酚栓剂(实验室自制,批号:2015121001),间苯三酚对照品(康邦生物科技有限公司,批号:110807-201505,质量分数99.5%);内标物咖啡因(成都康邦生物科技有限公司,批号:110773-201512,质量分数99.6%);甲醇、甲酸为色谱纯,其余试剂为分析纯,水为实验室超纯水。
1.3 动物
健康家兔(雌雄各半),体重(2.5±0.5)kg,由四川省中医药科学院实验动物中心提供,许可证号为SCXK(川)2008-19。动物实验均按照实验动物医学伦理审查委员会批准的动物协议和指南进行。
2 方法与结果
2.1 色谱和质谱条件
安捷伦C18柱(4.6mm×50mm,1.7μm);流动相A为甲醇,B为水(0.1%甲酸),梯度洗脱(程序见表1),流量0.8mL/min,柱温40℃。安捷伦三重串联四级杆质谱,干燥气为氮气,干燥气温度:350℃,干燥气流量:11 L/min;电喷雾离子源(ESI),毛细管电压:4 kV,雾化气压力:40 psi(1 psi=6.89 kPa),裂解电压:105V,离子化方式为正模式。碰撞能量:100V(咖啡因)、60V(间苯三酚),Cell Accelerato Voltage:3 V,检测方式为多重反应监测(MRM)方法,用于定量分析的离子反应分别为m/z 194.9→m/z 138.0(咖啡因,[M+H]+),m/z 127.0→m/z 81.2(间苯三酚,[M+H]+),进样量2μL。

表1 梯度洗脱程序
2.2 对照品溶液配制
精密称取间苯三酚对照品13.8mg,流动相B定容至50mL,再取0.5mL该溶液定容至10mL容量瓶中,得到质量浓度为13.8mg/L对照品贮备液。分别取对照品贮备液0.125,0.250,0.500,1.000,2.00,4.00mL于6个5mL容量瓶中,流动相B定容,得到质量浓度为0.345,0.690,1.380,2.760,5.520,11.040mg/L的系列对照品溶液,冷藏于4℃冰箱备用。
2.3 内标溶液配制
精密称取咖啡因对照品10mg,流动相B定容至10mL,再取0.5mL该溶液定容至50mL容量瓶中,得到质量浓度为10mg/L内标贮备液。冷藏于4℃冰箱备用。
2.4 血浆样品处理
健康家兔,禁食12h后,在耳动脉埋入1枚留置针,用胶带固定,取血浆0.2 mL,加入0.1 mL咖啡因内标贮备液和5mL乙酸乙酯,摇匀,涡旋振荡5min,离心(10 000 r/min)10 min,分取乙酸乙酯层,氮吹仪挥干,0.2mL甲醇复溶,离心(10 000 r/min)10min后取上清液待测。
2.5 方法专属性考察
分别取空白血浆和含药血浆按照2.1项条件进样2μL,结果间苯三酚的保留时间约为4.0 min,内标物咖啡因的保留时间约为6.5min。血浆内源性成分不干扰样品的测定(见图1~图5)。
2.6 标准曲线的制备
取家兔空白血浆0.1mL 6份,置6个10mL容量瓶中,均加入0.1mL内标贮备液与5mL乙酸乙酯,分别加入系列浓度间苯三酚对照品溶液0.1 mL,摇匀,涡旋振荡5min,离心(10000r/min)10min,取上清液,氮吹仪挥干,0.2mL甲醇复溶,离心(10000r/min)10min后取上清液,分别进样2μL。记录间苯三酚及内标物峰面积。以间苯三酚的峰面积分别与内标物峰面积的比值为纵坐标,以间苯三酚质量浓度为横坐标,进行线性回归,得到间苯三酚的标准曲线方程为y=0.5206x-0.0007,r2=0.9983。结果表明:间苯三酚在0.1725~5.52mg/L的范围内线性关系良好。
2.7 稳定性试验
取家兔空白血浆,按照2.6项下方法操作,制备成间苯三酚质量浓度分别为0.20,1.38,4.40mg/L的血浆溶液,4℃放置0,1,2,4,8,12,24 h,按照2.1项下分析条件分别进样2 μL,结果间苯三酚低、中、高浓度RSD分别为2.89%、2.99%和2.56%,表明家兔血浆样品在24h内稳定。
图3 血浆样品+内标

图4 血浆样品间苯三酚质谱图
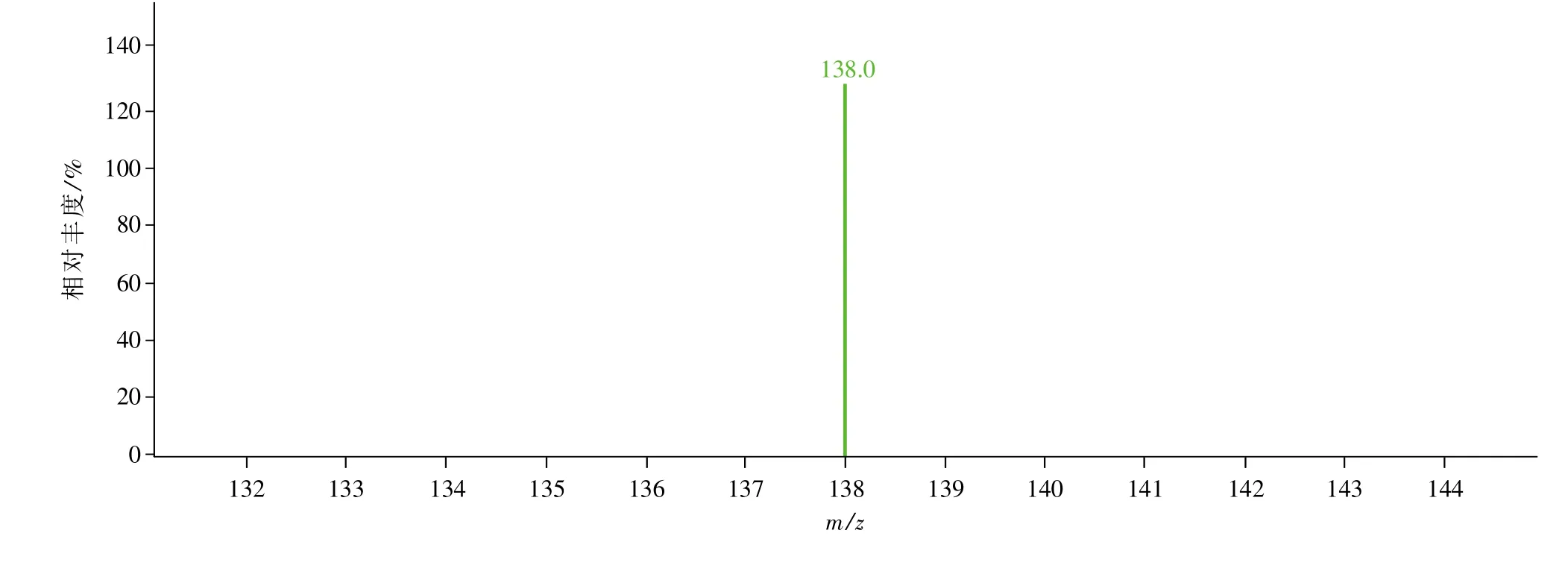
图5 血浆样品咖啡因内标质谱图
2.8 冻融稳定性
精密吸取间苯三酚对照品溶液,加入空白血浆和内标溶液,按2.4项处理,并反复冻融3次,按2.1项下分析条件测定,结果间苯三酚质量浓度的RSD为3.06%(n=6),说明家兔血浆样品反复冻融3次基本稳定。
2.9 密度试验
取2.7项下质量浓度分别为0.20,1.38,4.40mg/L的间苯三酚血浆溶液进行测定,同日内每份样品测定3次,考察日内精密度;3d内同法平行制备上述血浆溶液,处理后,进样测定,考察日间精密度。结果显示,日内RSD分别为4.9%,4.6%,4.4%(n=3),日间RSD分别为5.1%,4.8%,5.2%(n=3)。
2.10 回收率试验
取2.7项下质量浓度分别为0.20,1.38,4.40mg/L(低、中、高质量浓度)的间苯三酚血浆样品,各3份,进样测定,记录峰面积,代入回归方程计算血药浓度;以其与相应质量浓度的间苯三酚对照品溶液测得量进行比较,计算提取回收率。结果见表2。
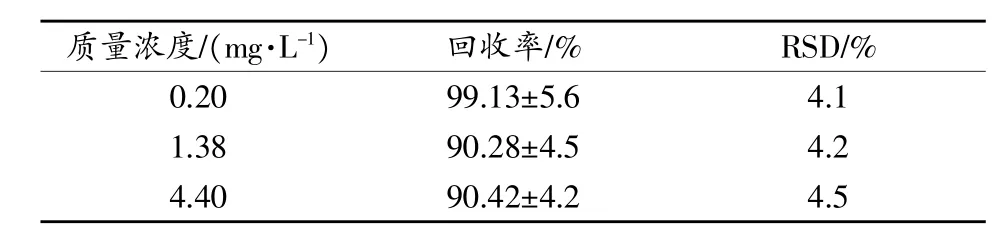
表2 间苯三酚在家兔血浆中的回收率(n=3)
2.11 药动学实验
取健康家兔6只(雌雄各半),禁食12h后,在耳动脉埋入1枚留置针,用胶带固定,分别直肠给药间苯三酚栓剂1粒,于给药前和给药5,10,15,18,20,25,30,45,60,90,120,180min从留置针中取血0.5mL,置于肝素抗凝的EP管中,10000r/min离心10min,取上层血浆,按照2.4项下方法处理样品,进样2μL。不同时间点的间苯三酚的血药浓度见表3,将表中6组血药浓度-时间数据代入DAS3.0药动学软件进行拟合处理后,间苯三酚的平均药-时曲线见图6,药代动力学参数见表4。

表3 家兔直肠给药不同时间点的间苯三酚的血药浓度(n=6)

图6 家兔直肠给药间苯三酚栓剂平均药-时曲线(n=6)

表4 间苯三酚主要药代动力学参数(n=6)
结果显示,直肠给药后间苯三酚在15 min左右血药浓度达到高峰,平均达峰浓度约为1.2773mg/L,消除半衰期约为65.733min,表明间苯三酚直肠给药后在家兔体内吸收迅速,达峰时间较短,在家兔体内的代谢过程符合一室模型。
3 结束语
本实验预先在家兔耳动脉埋入留置针,每次取血时只需用注射器从留置针抽取所需血量,采血时间较短、血流顺畅,对实验动物创伤性小,提高了实验动物的依从性,可反复多次取血,降低了采血的误差。
目前研究大多进行的是间苯三酚口服制剂给药后血浆样品测定方法的建立和体内药动学参数研究,而间苯三酚栓剂给药后药动学研究未见报道。本文进行间苯三酚栓剂直肠吸收的药物动力学研究,与间苯三酚口服制剂给药相比较,结果证明,直肠给药后有效成分的吸收比口服给药快,峰浓度、吸收总量和生物利用度均高于口服给药[11]。间苯三酚栓剂直肠给药能防止或减少肝脏和胃肠消化液对药物的破坏,使间苯三酚的生物利用度更高。本文建立的LC-MS测定血浆样品中间苯三酚含量的方法,能够快速、准确地测定血浆样品中间苯三酚含量。
[1]RAHIM A,SETIAWAN B,DEWI F,et al.Regulation by phloroglucinol of Nrf2/Maf-mediated expression of antioxidant enzymes and inhibition of osteoclastogenesis viatheRANKL/RANKsignalingpathway:Insilico study[J].Acta Informatica Medica,2015,23(4):228.
[2]MENDES V,VILACA R,DE FREITAS V,et al.Effect ofmyricetinpyrogallolandphloroglucinolonyeast resistance to oxidative stress[J].Oxidative Medicine&Cellular Longevity,2015:782504.
[3]李健和,易利丹,彭六保,等.间苯三酚的药理作用与临床应用[J].中国新药与临床杂志,2011(7):494-499.
[4]王辉,孙庆荣,章家伟,等.高效液相色谱法测定间苯三酚原料药有关物质[J].中南药学,2013,11(4):306-309.
[5]KANGMH,KIMIH,NAMT J.Phloroglucinol induces apoptosis through the regulation of insulin-like growth factor 1 receptor signaling pathways in human colon cancer HT-29 cells[J].Int J Oncol,2014,45(3):1036-1042.
[6]KANGMH,KIMIH,NAMT J.Phloroglucinol induces apoptosis via apoptotic signaling pathways in HT-29coloncancer cells[J].Oncol Rep,2014,32(4):1341-1346.
[7]KIM R K,SUH Y,YOO K C,et al.Phloroglucinol suppresses metastatic ability of breast cancer cells by inhibition of epithelial-mesenchymal cell transition[J].Cancer Sci,2015,106(1):94-101.
[8]YANGE,AHNS,RYUJ,etal.Phloroglucinol attenuates the cognitive deficits of the 5XFAD mouse model of alzheimer's disease[J].Plos One,2015,10(8):135686.
[9]姚毓筠,曾祥娥.间苯三酚在妇产科的应用[J].医学综述,2011,17(14):2170-2171.
[10]陈念钧,程斌廖,家智,等.间苯三酚在食管疾病特殊内镜诊治中的应用价值[J].世办华人消化杂志,2011,19(17):1834-1838.
[11]杨瑞玲,刘宏,陈丹,等.间苯三酚颗粒在家兔体内的药动学研究[J].中国药房,2015(7):939-941.
(编辑:莫婕)
Pharmacokinetic study of phloroglucinol suppository in rabbits in vivo
LIAO Changjun1,2,LING Baodong1,2,WANG Qian2,LIAO Liyun2,CHEN Xiuming2
(1.Key Laboratory of Small Molecule Special Structure Drugs,Sichuan Institution of Higher Education,
Chengdu 610083,China;2.School of Pharmacy,Chengdu Medical College,Chengdu 610083,China)
The paper established a method to determine the plasma concentration of phloroglucinol with LC-MS and studied the pharmacokinetic characteristics of phloroglucinol suppository in rabbits in vivo.In total of 0.5 mL ear arterial blood of 6 healthy rabbits was collected 5,10,15,18,20,25,30,45,60,90,120,180min before and after phloroglucinol suppository was applied to them through rectum.LC-MS was conducted to determine the drug concentration and the Agilent C18 column(4.6mm×50mm,1.7μm),mobile phase of methanol-water(0.1%formic acid)gradient elution,triple quadrupole mass spectrometry electrospray ionization(ESI)ion source and multiple reaction monitoring(MRM)mode were used for testing.The ionization mode was positive mode and the injection volume was 2μL.The pharmacokinetics parameters were calculated by DAS 3.0.There was a good linear relationship between phloroglucinol and the peak area and internal standard peak area in the range of 0.172 5-5.52mg/L.The pharmacokinetic parameters of phloroglucinol t1/2,Tmax,Cmax,AUC0-∞were 65.733 min,15 min,1.277 3 mg/L,39.993(mg·min)/L.This method has advantagesinstrongspecificityandgoodprecision,whichcanbeusedforstudyingthepharmacokinetics of phloroglucinol in rabbits.The metabolism process of phloroglucinol suppository in rabbits is consistent with the single compartment model.
phloroglucinol;suppository;LC-MS;pharmacokinetic
A
1674-5124(2017)08-0055-05
2016-12-09;
2017-02-07
四川省教育厅重大培育项目资助(16CZ0029)
廖昌军(1981-),男,四川自贡市人,高级实验师,主要从事药物代谢研究工作。
10.11857/j.issn.1674-5124.2017.08.012
