754例I期-IIIa期可手术切除非小细胞肺癌患者EGFR和KRAS基因突变状态及其临床意义
2017-09-10赵静高洁郭李平胡晓许刘琦赵金银刘利成姜君王孟昭梁智勇徐燕陈闽江张力李龙芸钟巍
赵静 高洁 郭李平 胡晓许 刘琦 赵金银 刘利成 姜君 王孟昭 梁智勇 徐燕 陈闽江 张力李龙芸 钟巍
非小细胞肺癌(non-small cell lung cancer, NSCLC)发病率越来越高,已成为全球癌症死亡的首要原因[1-3].近20年来,NSCLC的治疗取得了飞速发展,涌现出大量新的药物和治疗手段,如分子靶向治疗[4-7]、免疫治疗[8-10]等,使患者预后大为改善.在分子靶向治疗方面,研究最成熟的当属表皮生长因子受体(epidermal growth factor receptor,EGFR).具有EGFR敏感突变的患者,使用吉非替尼、厄洛替尼和阿法替尼具有更高的客观缓解率(objective response rate, ORR)、更长的无进展生存期(progressionfree survival, PFS)以及更高的生活质量.当这些一、二代EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitors,EGFR-TKIs)耐药后,若耐药机制由EGFR T790M介导,使用三代EGFR-TKIs(Osimertinib, AZD9291)亦能再次产生显著疗效.因此,对EGFR突变的准确检测显得尤为重要.目前研究主要集中在晚期NSCLC组织和血浆标本的EGFR检测.PIONEER研究[11]显示,在晚期亚裔腺癌患者EGFR突变率高达51.4%.在另外一项IGNITE研究,再次确认了晚期亚裔NSCLC腺癌EGFR突变率为49.2%,与PIONEER结果一致,非腺癌患者EGFR突变率也高达14.1%,与欧美人群中腺癌患者突变率相当.然而,对于真实世界中,可手术切除的I期-IIIa期NSCLC组织标本的EGFR突变情况尚不清楚[12,13].
另外,并非所有具有EGFR敏感突变的NSCLC患者对EGFR-TKIs表现出良好疗效.KRAS基因编码的P21蛋白位于EGFR信号通路下游,KRAS基因突变会使下游信号通路配体非依赖性持续性激活,不受上游靶向药物对EGFR的影响,导致细胞持续恶性增殖.KRAS基因突变会使NSCLC患者对EGFR-TKIs产生耐药[14],同时患者预后更差[15].多数研究认为EGFR和KRAS基因突变是相互排斥的[16-19],但是一些临床研究表明KRAS基因突变可以发生在EGFR突变型患者中,但双突变发生率低于1%.因此,同时检测EGFR和KRAS对指导NSCLC患者个体化治疗具有重要临床意义[20].
EGFR基因突变多位于外显子18-21,其中以外显子19缺失突变和外显子21L858R错义突变最为常见,约占总突变率的90%[21].KRAS基因最常见的突变方式为点突变,90%的KRAS基因突变位于外显子2的第12和13密码子位点.本研究目的旨在使用Modified AMRS PCR荧光探针法检测真实世界下,未加选择的可手术切除I期-IIIa期的NSCLC患者组织标本中EGFR和KRAS基因的热点突变状态,是否存在双突变以及基因突变与临床因素的相关性.
1 材料与方法
1.1 材料 标本来自北京协和医院病理科于2013年1月-2013年12月收集NSCLC标本,标本类型仅限于手术完整切除的标本,除外电子气管镜和穿刺活检标本,去除重复标本,共纳入754例,其中男性374例,女性380例;年龄24岁-92岁,中位年龄60岁;年龄分组:40岁以下、40岁-49岁、50岁-59岁、60岁-69岁、70岁以上患者样本分别为15例(2.0%)、53例(7.0%)、282例(37.4%)、240例(31.8%)和164例(21.7%);病理分型:腺癌623例(82.5%)、鳞癌91例(12.1%)、腺鳞癌1例(0.1%)、其他39例(5.3%).所有标本均经10%中性福尔马林固定、石蜡包埋、切片及HE染色,由病理医师复阅切片明确诊断,并确定有足够的肿瘤细胞再行后续检测.
1.2 方法
1.2.1 DNA提取用 无菌刀片刮取5张-10张4 μm厚的连续石蜡切片中癌组织区域,保证肿瘤细胞含量在30%以上.石蜡组织脱蜡后用石蜡包埋组织DNA快速提取试剂盒(天根生化科技(北京)有限公司)提取基因组DNA.用NanoDrop 2000荧光分光光度计检测DNA的质量和浓度,所有DNA吸光度值A260/280均在1.8-2.0之间,用无DNase水将DNA稀释至0.5 ng/μL-10 ng/μL备用.
1.2.2 突变扩增系统(amplification refractory mutation system, ARMS) 荧光PCR检测以所提取石蜡样本DNA为模板,按照EGFR基因和KRAS基因突变检测试剂盒(购自于北京华大吉比爱生物技术有限公司)操作说明书步骤,应用实时荧光定量PCR仪(ABI 7300, USA)检测EGFR和KRAS基因的常见突变,所检突变包括EGFR基因L858R和exon 19del突变及KRAS基因12和13密码子突变.检测结果由两位专业的研究人员判读和分析.如果判读结果不一致,再由第三位研究员分析得出最终决定.按照双盲试验的设计原则,试验数据的记录和获得由不同的研究员独立进行.研究员对患者组织检测结果并不知晓直到统计分析.
1.2.3 测序分析 若检出EGFR和KRAS双突变的标本,采用直接测序法进行验证.针对EGFR基因19、21号外显子和KRAS基因第2号外显子设计扩增引物且在扩增引物的5'端加上M13测序引物,其中EGFR基因第19号外显子上下游引物分别为:5'-TGTAAAACGACGGCCAGTAATTCCCGTC GCTATC-3';5'-GGAAACAGCTATGACCGTGGGCCTGA GGTTCAGAG-3',EGFR基因第21号外显子上下游引物分别为:5'-TGTAAAACGACGGCCAGTTACTTGGAGGACCGT CGCTT-3';5'-CAGGAAACAGCTATGACCGCTGACCTA AAGCCACCTCC-3',KRAS基因第2号外显子上下游引物分别为:5'-TGTAAAACGACGGCCAGTCGATACACGTCTG CAGTCAACT-3';5'-CAGGAAACAGCTATGACCGCATA TTACTGGTGCAGGACC-3'.以所提取石蜡样本DNA为模板进行PCR扩增,反应条件:95oC预变性7 min;95oC变性30 s,56oC 30 s,72oC延伸45 s,40个循环,最后72oC延伸10 min.将所得PCR产物送上海生工生物公司进行测序,使用DNAStar软件对测序结果进行比对和分析.
1.3 统计学分析 应用SPSS 18.0软件进行统计学分析.针对连续变量采用独立样本t检验,针对计数变量采用卡方检验,P<0.05为差异有统计学意义.
2 结果
2.1 样本中EGFR、KRAS突变情况 本次检测涉及754例样本,共260例检出EGFR突变(34.5%),其中,外显子21 L858R突变124例(16.4%),外显子19缺失突变(exon 19del)142例(18.8%),有6例(0.8%)样本同时发生了L858R和19del突变.有320例样本同时进行了KRAS基因突变检测,共检出42例KRAS突变(13.1%),且全部为12号密码子突变,未检出13号密码子突变.有3例(0.9%)样本出现双突变,其中,2例为EGFR(L858R)和KRAS(G12)双突变,1例为EGFR(Exon 19del)和KRAS(G12)突变,将此3例双突变样本使用常规测序验证,结果如图1.
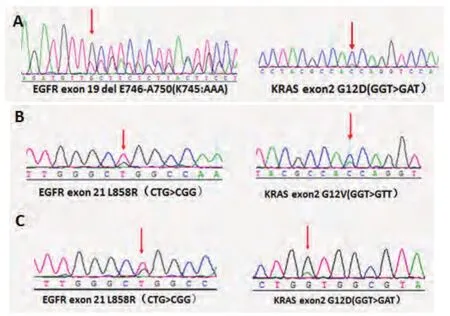
图 1 3例EGFR-KRAS双突变样本的DNA测序分析Fig 1 DNA sequencing data of 3 specimens with EGFR-KRAS double mutations. EGFR: epidermal growth factor receptor.
2.2 EGFR和KRAS基因突变与NSCLC临床病理特征的关系 在754例NSCLC样本中,女性EGFR基因突变率(39.5%,150/380)高于男性(29.4%,110/374),但二者没有显著性差异(P=0.076).60岁以下患者和60岁以上患者EGFR基因突变率相当[36.3%(127/350)vs 32.9%(133/404)].腺癌(38.7%, 241/623)中EGFR基因突变率明显高于鳞癌(10.0%, 9/91)和其他类型癌(25.6%, 10/39)的突变率.在其中320例NSCLC样本中,男性KRAS基因突变率(16.6%,29/175)高于女性(9.0%, 13/145),且二者具有显著差异(P=0.048).60岁以下患者和60岁以上患者KRAS基因突变率相当[17.1%(28/164)vs 15.4%(24/156)].腺癌(14.1%,36/255)中KRAS基因突变率高于鳞癌(7.7%, 2/26)和其他类型癌(10.5%, 4/38),详见表1.
2.3 基于EGFR和KRAS基因分型的单因素分析 在EGFR或KRAS基因突变阳性的样本中,EGFR阳性组的中位初诊年龄为58岁,平均年龄为(58.6±10.1)岁,KRAS阳性组的中位初诊年龄为61.5岁,平均年龄为(62.4±8.4)岁,EGFR阳性组患者年龄分布较KRAS阳性组具有年轻化趋势(P=0.031,5).在性别分布方面,KRAS阳性组的男性分布比例明显高于EGFR组(69% vs 42.3%, P<0.01).在病理类型分布方面,两组均以腺癌为主,并未发现有显著差异(P=0.228)(图2).
3 讨论
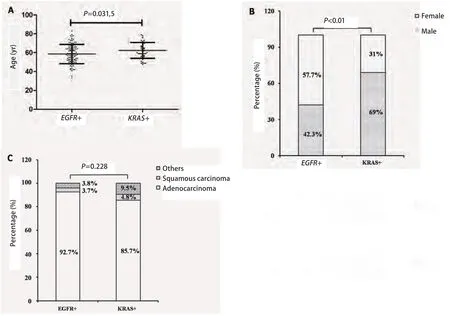
图 2 基于EGFR和KRAS基因分型的单因素分析.A: 基于EGFR和KRAS分型的年龄分布情况;B:基于EGFR和KRAS分型的性别分布情况;C:基于EGFR和KRAS分型的病理类型分布情况.Fig 2 Single factor analysis based on EGFR and KRAS genotype.A: Age distribution based on EGFR and KRAS genotype; B:Gender distribution based on EGFR and KRAS genotype; C:Pathological type based on EGFR and KRAS genotype.
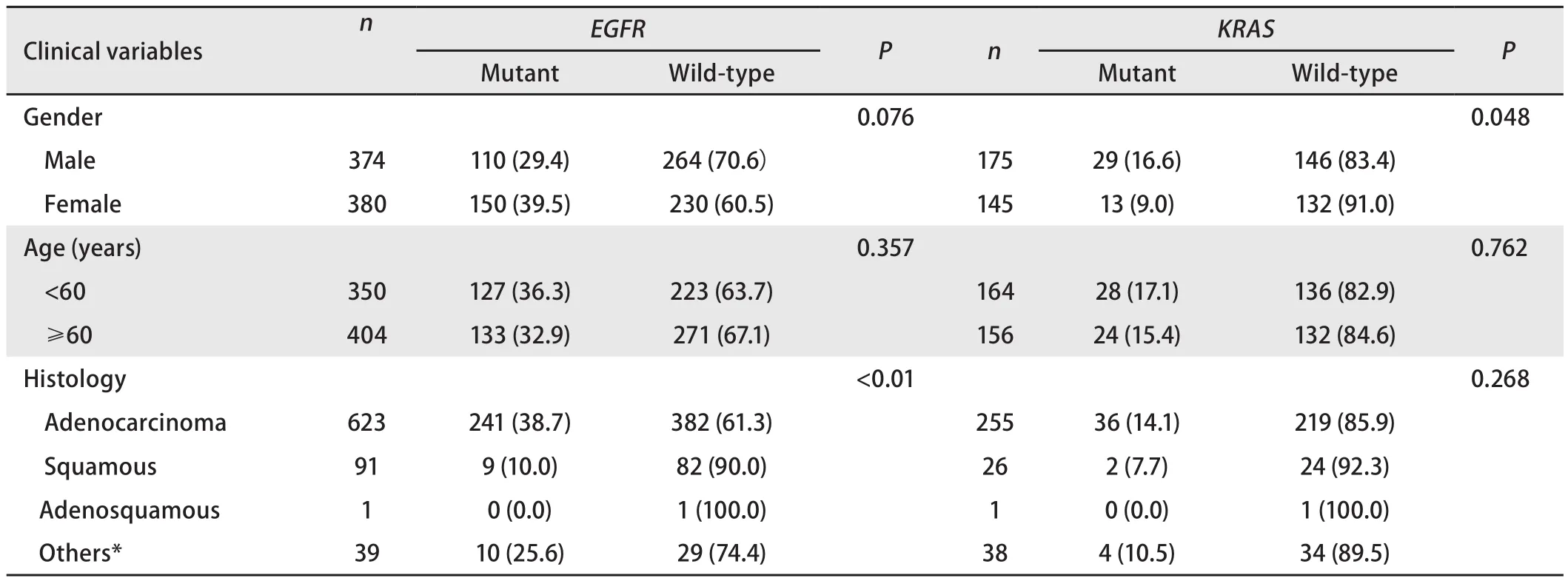
表 1 EGFR及KRAS基因突变情况与患者临床病理特征之间的关系Tab 1 The relationship between EGFR and KRAS mutations and clinical variables of patients
本研究是一项专门针对I期-IIIa期可手术切除NSCLC患者EGFR和KRAS基因突变状况的调查研究.研究显示,在未加选择可切除的I期-IIIa期NSCLC患者,EGFR基因突变率为34.5%,这与早期文献[22,23]所报道的一致.但对于腺癌,此研究EGFR突变率仅为38.7%,明显低于PIONEER和IGNITE研究所报道的50%左右[11].在PIONEER和IGNITE研究中,均是纳入的IV期腺癌患者,而我们的标本为I期-IIIa期,这种早晚期标本差异可能是导致突变率不同的一个重要原因.在一项EGFR-TKIs术后辅助治疗的随机III期临床研究中(BR.19研究)[20],研究者亦发现手术标本中EGFR的突变率明显低于晚期患者,仅3%(15/503),而且分期越早的标本,其EGFR突变率越低,这些发现似乎也在一定程度上支持我们的结论.这也反映早期NSCLC和晚期NSCLC可能具有不同的生物学行为,EGFR基因在其中所起的作用不同,因此制定综合治疗策略需考虑这种差异[24,25].
既往研究[26,27]表明,EGFR突变与患者性别、种族、吸烟、病理类型有关,其在亚裔、女性、不吸烟、腺癌的患者中发生率较高.本研究在754例I期-IIIa期NSCLC样本中也发现,EGFR基因突变率在腺癌中较高,同时女性较男性也有升高趋势(39.5% vs 29.4%, P=0.076),这与既往研究结果一致.
KRAS基因是EGFR信号转导通路下游的重要节点,该基因的突变可以导致EGFR-TKI原发性耐药,同时它亦是判断NSCLC患者预后的重要指标.KRAS基因突变具有明显的地域差异,西方人群中KRAS突变率约25%,明显高于东亚人群10%,且KRAS基因突变多见于男性,吸烟以及肺腺癌[27].在本研究中,KRAS基因的突变率为13.1%,且腺癌的突变率(14.1%)高于鳞癌(7.7%)和其他类型癌(10.5%).这些发现也与既往研究[27,28]一致.
在NSCLC中同时存在EGFR和KRAS突变非常罕见,一直以来研究者认为两者互斥[16-18].但在本研究中,共有3例样本在EGFR和KRAS基因上同时发生了突变,均为女性肺腺癌患者,且经直接测序法验证,说明EGFR和KRAS双突变可以同时存在,KRAS的突变可能会导致具有EGFR敏感突变患者对EGFR-TKIs耐药.在临床中,约30% EGFR阳性NSCLC患者对EGFR-TKIs靶向治疗无应答,即发生原发性耐药[29].本研究,在320例检测EGFR和KRAS突变的样本中,EGFR的突变率为30.3%(97/320),其中在EGFR突变阳性样本中,KRAS的突变率为3.1%(3/97),其远远低于30%,说明EGFR-TKIs原发耐药除了KRAS突变外,还有很多其他机制参与,如BIM表达水平等[29].
总之,本研究提示在I期-IIIa期可手术的NSCLC样本中EGFR基因突变率低,EGFR基因突变和KRAS基因突变可同时存在.但该研究仍有较多缺陷,它是一项回顾性研究,所得结论是与其他研究结果进行比较得出,未纳入IV期标本做为对照,部分临床资料收集不完善以及EGFR检测内容不全,这些均需要在后续研究中改进和完善,并进一步验证研究结论的可靠性.
