HPLC法测定利培酮片有关物质的优化
2017-09-08张悦杨刘峰
张悦杨 刘峰
(四川省食品药品检验检测院,四川 成都 611731)
HPLC法测定利培酮片有关物质的优化
张悦杨 刘峰
(四川省食品药品检验检测院,四川 成都 611731)
目的:建立HPLC梯度洗脱法测定利培酮片的有关物质。方法:采用Sepax GP-C18(4.6×100 mm,3 μm)为色谱柱;以流动相A:水-乙腈-三氟乙酸(80:19.5:0.1)(用氨水调节pH值至3.0)与流动相B:水-甲醇-三氟乙酸(61:39:0.1)(用氨水调节pH值至3.0),进行梯度洗脱;柱温35℃,流速1.0 mL·min-1,检测波长275 nm。结果:利培酮在0.5088 μg·ml-1~1017.6 μg·ml-1浓度范围内与相应峰面积线性关系良好;检测限(S/N=3)为0.5088 ng·mL-1。结论:优化后的方法更有利于利培酮片杂质的检出。
利培酮片;高效液相色谱法;有关物质;梯度洗脱
利培酮片为非典型抗精神病药,比利时杨森制药公司于1984年研发,1997年在我国完成进口注册申请并上市,2002年完成仿制药申请,现已被广泛应用于临床。主要用于治疗急性和慢性精神分裂症以及其他各种伴精神病性症状的疾病,其不良反应主要为锥体外系症状,如心动过速、肌紧张、流涎、运动迟缓等。利培酮原料药纯度较高,杂质检出率低,但制剂中杂质均有不同程度增加。利培酮片在ChP2015[1]、USP36版[2]与日本药典16版[3]均已有收载,但色谱条件及限度设置有较大差异。本研究参考USP36版,优化了有关物质测定的色谱条件,为提高利培酮片的杂质检查方法和统一限度建立了基础。
1 材料与方法
1.1 仪器与试药
仪器:Waters e2695系列高效液相色谱仪,Waters 2489 紫外检测器,Waters 2998 二极管阵列检测器;试剂试药:利培酮系统适用性对照品(来源:EP,批号:003AO8),利培酮对照品(来源:中检所,批号:100570-201102,纯度:99.9%),乙腈、甲醇为色谱纯;三氟乙酸、氨水均为分析纯;水为超纯水。
1.2 方法
1.2.1 色谱条件与系统适应性试验
色谱柱Sepax GP-C18(4.6×100 mm,3 μm)及Thermo ODS HYPERSIL(4.6×100 mm,3 μm);柱温为35℃;流速为1.0 mL·min-1;流动相A为水-乙腈-三氟乙酸(80:19.5:0.1)(用氨水调节pH值至3.0),流动相B为水-甲醇-三氟乙酸(61:39:0.1)(用氨水调节pH值至3.0),梯度洗脱(0~8 min、100%A,8~16 min、100%~0%A,16~24 min、0%A,24~30 min、0%~100%A,30~40 min、100%A);检测波长275 nm;进样体积20 μL。
1.2.2 溶液的配制
系统适用性溶液的配制:精密称取利培酮系统适用性对照品约10 mg,置10 ml量瓶中,加1.54%醋酸铵溶液(用冰醋酸调节pH值至6.5)-水-甲醇(1:9:10)使溶解并稀释至刻度、摇匀,作为系统适用性溶液(1);另精密称取利培酮对照品约10 mg,置100 ml量瓶中,加稀氢氧化钠溶液(取水适量,用0.1 mol/L氢氧化钠溶液调节pH值至8.5)10 ml,置90℃烘箱中放置24 h,冷却至室温,加稀过氧化氢溶液(取30%过氧化氢溶液1 ml,加水稀释至500 ml)10 ml,置90℃烘箱中放置2 h,冷却至室温,加甲醇稀释至刻度,作为系统适用性溶液(2);分别精密量取系统适用性溶液(1)和系统适用性溶液(2)各1 ml,混匀,作为系统适用性溶液。
供试品溶液的配制:取本品的细粉适量(约相当于利培酮2 mg),置10 ml量瓶中,加水2 ml,置60℃水浴中振摇30 min,放冷,加6 ml甲醇,超声20 min使利培酮溶解,用甲醇稀释至刻度,摇匀,即得;对照溶液的配制:精密量取供试品溶液1 ml,置100 ml量瓶中,用80%甲醇稀释至刻度,摇匀,即得;空白辅料溶液的配制:称取适量空白混合辅料,按供试液配制法同法制备。
2 结果
2.1 专属性实验
取系统适用性试验溶液20 μl注入液相色谱仪,在“1.2.1”项色谱条件下进样,记录色谱图,出峰顺序为依次为双环利培酮(相对保留时间为0.75),利培酮(相对保留时间为1.0),反式-N-氧化利培酮(相对保留时间为1.23)与顺式-N-氧化利培酮(相对保留时间为1.48),反式-N-氧化利培酮、顺式-N-氧化利培酮两峰的分离度应大于1.2。再分别精密量取流动相、空白辅料溶液和供试品溶液(样品批号06-131001)各 20 μL,在“1.2.1”项色谱条件下进样,记录色谱图,利培酮与杂质峰之间分离良好,空白辅料对测定无干扰(见图1和图2)。另取5 份供试液,第1份沸水浴中破坏10 h,作为热解样品;第2份样品强紫外灯(UV254 nm)破坏48 h,作为光降解样品;第3份样品加3 mol·L-1盐酸溶液3 ml,置沸水浴中加热破坏2 h,放冷,用3 mol· L-1氢氧化钠溶液调pH值至中性,作为酸解样品;第4份样品加3 mol· L-1NaOH溶液3ml,置沸水浴中加热破坏2 h,放冷,用3 mol·L-1盐酸溶液调pH值至近中性,作为碱解样品;第5份样品加30%双氧水0.5 ml,70℃水浴中加热破坏1 min,作为氧化降解样品。按“1.2.1”项方法测定上述各降解样品,记录色谱图。结果表明本品经热、光、酸、碱、氧化破坏后的杂质峰能够与主峰有效分离,该色谱条件满足利培酮片有关物质检测的专属性。
2.2 线性关系、检出限试验
精密称取利培酮对照品约20 mg,用80%甲醇溶解并稀释成0.5、1、10、50、100、150、200、500、800、1000 μg·mL-1的浓度,进样20 μL,以利培酮峰面积对浓度进行线性回归, 得方程Y=2.8654E+07X-2.5923E+04,R =1.0000。结果表明本品在0.5088 μg·mL-1~1017.6 μg·mL-1浓度范围内线性关系良好。精密称取利培酮对照品适量,加80%甲醇溶解并稀释制成0.02544 μg·mL-1的溶液,进样20μl分析,S/N约为3.1611,计算最低检测限为0.5088 ng,方法检出限能够满足有关物质的检测要求。

图1 空白辅料色谱图

图2 供试品溶液色谱图

图3 检出限色谱图
2.3 稳定性、重复性试验
取供试品溶液,分别在0 h、2 h、4 h、8 h、12 h、15 h、18 h测定,结果杂质数量均为2,单个杂质含量在0.13%~0.14%范围内,杂质总量在0.14%~0.16%范围内,表明供试液在室温下放置18 h是稳定的;取利培酮片(批号06-131001)细粉适量,按1.2.2方法配制6份供试液,依法测定,结果杂质数量均为2,单个杂质含量在0.11%~0.12%范围内,杂质总量在0.13%~0.14%范围内,表明本法重复性良好。
2.4 耐用性试验
本实验分别选取了Sepax GP-C18色谱柱(4.6×100 mm,3 μm)、Thermo ODS HYPERSIL色谱柱(4.6×100 mm,3 μm)按上述方法试验,发现采用Thermo ODS HYPERSIL色谱柱,各杂质峰及主峰均不出峰,因此本实验对色谱柱选择性高,推荐使用Sepax GP-C18(4.6×100 mm,3 μm)或性能相当的色谱柱。
2.5 样品的测定
取一家企业共9批利培酮片,按“1.2.1~2”项及该企业现行标准方法测定样品中的有关物质,见表1。
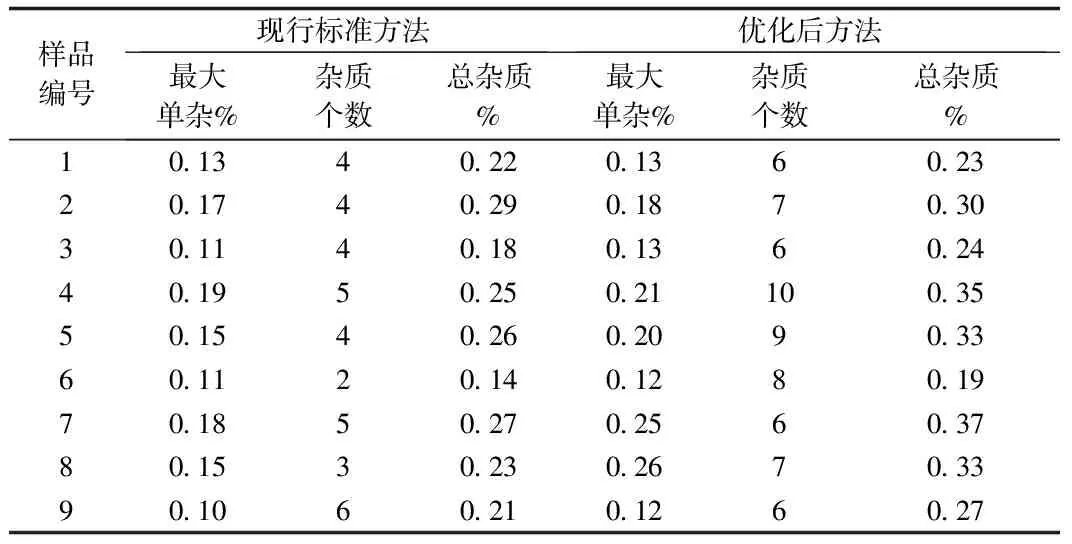
表1 样品有关物质测定结果
结果表明,优化后有关物质方法能够检出更多的杂质量及杂质个数。
3 讨论
利培酮原料纯度较高,杂质含量较少,但利培酮片中的杂质明显多于其原料药中的杂质个数,随着储存时间的增加,未见杂质有明显增加的趋势,说明杂质主要应由制剂生产过程中引入,有关物质的检测结果能够反映出生产过程可能出现的问题,应对本品的有关物质进行严格的控制。
我国现行标准[4]中均采用HPLC法对本品有关物质进行测定,限度较为宽泛,现行标准中主成分出峰时间较早,多在5~8 min,辅料峰较多,这种情况下易干扰杂质的测定,不利于杂质检出,且原研企业质量标准中未对有关物质进行考察。本品药理活性较强,不良反应频发,存在较高安全隐患,有关杂质的控制尤为重要,美国药典(USP36)与欧洲药典(EP7.0)[5]均对利培酮原料药与利培酮片中特定杂质及总杂有严格限定,其中USP36原料药收载、控制了5种特定杂质,均不得过0.2%;EP7.0原料药收载12种特定杂质,单独控制了其中6种;USP36利培酮片3种特定杂质,单独控制其中2种。根据文献资料原研企业根据其合成路线、生产工艺以及稳定性考察的结果,利培酮原料药中可能的引入杂质及降解产物有 9 种,利培酮片可能的降解产物有 5 种(不同于原料药)。
采用USP36中的色谱条件检测,主峰出峰时间快,色谱柱柱压较高,且系统适用性溶液中各杂质色谱峰之间未达到有效分离,通过对色谱条件进行优化,延长了主峰出峰时间,已知杂质得到更好的分离,提高了有关物质的检出量。
1 国家药典委员会. 中华人民共和国药典2015年版 (二部)[S].2015, 493-494.
2 U.S.Pharmacopeia 36[S].5065-5067.
3 The Japanese Pharmacopoeia XVI[S].1354-1355.
4 颜晓丹,高明,蔡振华,等.色谱技术分析利培酮含量及有关物质的研究进展[J].现代药物与临床,2012, l27(3):321-322.
5 European Pharmacopoeia[S].2861-2863.
6 王明跃,叶晓林. HPLC法同时测定对乙酰氨基酚、咖啡因、盐酸麻黄碱和维生素C的含量[J].四川生理科学, 2013, 35(2): 65-67.
7 魏莹,陈珍,马雪,等. HPLC法比较心脏釆血和颈总动脉釆血对家兔水杨酸钠血浆半衰期的影响[J].四川生理科学, 2016, 38(1): 18-20.
Optimization of determination of the related substances in Resperidone tablets by HPLC
Zhang Yue-yang, Liu Feng
(Sichuan Institute for Food and Drug Control, Sichuan Chengdu 611731)
Objective:To optimize an HPLC method for the determination of the related substances in Resperidone tablets.Methods: Analysis was carried out on a Sepax GP-C18(4.6×100 mm,3 μm); the column temperature was 35℃, the flow rate was 1.0 mL·min-1, the mobile phase A is water-methanol-TFA (89:19.5:0.1) (adding ammonia to adjust the pH to3.0), the mobile phase B is water-methanol-TFA (61:39:0.1)(adding ammonia to adjust the pH to3.0), the injection volume was 20 μL, and the detection wave length was 275 nm. Results: The linear ranges of Resperidone were 0.5088 μg·ml-1~1017.6 μg·ml-1, respectively. The limits of detection (S/N=3) was 0.5088 ng·mL-1. Conclusion: The optimized method is more propitious to detect the related substances in Resperidone tablets, and control the known impurities.
Resperidone tablets; HPLC; Related substance; Gradient elution
张悦杨,女,主管药师,主要从事药物分析及质量标准研究,Email:16055482@qq.com。
2017-5-22)
