Oridonin对急性肝衰竭小鼠肝细胞凋亡的影响及其机制研究*
2017-09-08邓怡林于合国施敏石翠翠范建高李光明
邓怡林,于合国,施敏,石翠翠,范建高,李光明
·实验性肝炎·
Oridonin对急性肝衰竭小鼠肝细胞凋亡的影响及其机制研究*
邓怡林,于合国,施敏,石翠翠,范建高,李光明
目的 探讨冬凌草甲素(oridonin)对脂多糖/D-氨基半乳糖氨(LPS/D-Gal)联合诱导的急性肝衰竭(ALF)小鼠肝细胞凋亡的影响,并探讨其可能的机制。方法 取25只小鼠,随机分成5组,每组5只。采用LPS/D-Gal腹腔注射建立小鼠ALF模型,设生理盐水对照组、LPS/D-Gal诱导模型组、LPS/D-Gal诱导和不同剂量oridonin干预组及oridonin处理组。采用末端转移酶介导的缺口末端标记法(TUNEL)检测肝细胞凋亡,采用real-time PCR法检测肝组织TNF-α mRNA水平,采用Western blot法检测凋亡相关蛋白的变化。结果 模型组小鼠肝细胞凋亡率为(36.4±1.8)%,显著高于两个oridonin干预组的[(19.4±3.3)%和(11.4±0.3)%,P<0.01];模型组小鼠肝组织TNF-α mRNA水平显著高于正常对照组(P<0.01),而两个oridonin干预组肝组织TNF-α mRNA水平显著低于模型组(P<0.01);模型组小鼠线粒体凋亡通路相关的促凋亡蛋白c-Jun氨基末端激酶(JNK)、bax、细胞色素C、cleaved caspase9/3活化水平显著高于两个oridonin干预组(P<0.01),模型组小鼠抗凋亡蛋白bcl-xl水平显著低于两个oridonin干预组(P<0.01),模型组小鼠死亡受体凋亡通路相关的促凋亡蛋白caspase8活化水平与两个oridonin干预组并无明显差异(P>0.01)。结论 Oridonin可抑制LPS/D-Gal诱导的ALF小鼠肝细胞凋亡,其机制可能与下调促凋亡细胞因子TNF-α水平和抑制JNK介导的线粒体凋亡信号通路有关。
急性肝衰竭;D-氨基半乳糖氨;冬凌草甲素;凋亡;小鼠
急性肝衰竭(acute liver failure,ALF)病情凶险,进展迅速[1],目前尚无有效治疗手段[2,3]。肝细胞凋亡是ALF早期一种重要的病理学表现[4],如能阻抑肝细胞凋亡,则有望延缓甚至阻断ALF的病情进展[5]。冬凌草甲素(oridonin)是从中药冬凌草中分离出来的活性双萜类化合物,具有广泛的抗肿瘤[6,7]、抗炎[8,9]等生物学活性。我们之前的研究已经表明oridonin对ALF小鼠具有保护作用,然而这种保护作用是否与其对肝细胞凋亡的阻抑作用有关尚不清楚。因此,本研究以LPS/D-Gal诱导的ALF小鼠作为模型,进一步探讨oridonin对ALF小鼠肝细胞凋亡的影响并探讨其可能的作用机制。
1 材料与方法
1.1 动物、试剂与药物 6~8周龄,雌性SPF级,体质量为20~22 g的C57/BL6小鼠购自中国科学院上海生命科学研究院,在清洁级动物实验中心喂养(标准动物饲料及饮水,环境温度为21±2℃,12 h明暗交替光照时间)。所有动物实验均符合本校动物伦理委员会的有关规定。D-Gal和LPS(E.Coli,菌株O111:B4)购自美国Sigma公司。Oridonin购自美国Selleck公司。RIPA裂解液(强)购自江苏凯基生物技术股份有限公司。蛋白酶抑制剂cocktail及末端转移酶介导的缺口末端标记法(TUNEL)染色试剂盒购自美国Roche公司。BCA试剂盒购自北京北方同正生物技术发展有限公司。ReverTra Ace qPCR RT Kit购自日本Toyobo公司,SYBR@Green Real-time PCR Master Mix购自上海ExCell Bio公司。抗c-Jun氨基末端激酶(JNK)、抗磷酸化c-Jun氨基末端激酶(P-JNK)、抗细胞色素c(cytochrome c)、抗含半胱氨酸的天冬氨酸水解酶8(caspase8)、caspase9、caspase3、抗 bax、抗 bcl-xl 抗体及抗GAPDH抗体均为美国CST公司产品;辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记的山羊抗兔IgG均购自上海Beyotime公司。
1.2 急性肝衰竭模型的建立及药物干预 取25只小鼠,随机分成5组,每组5只。a组(正常对照组):NaCl+NaCl,腹腔注射0.5 ml生理盐水,1 h后注射同等体积的生理盐水;b组(模型组):NaCl+LPS(40 μg/只)/D-Gal(5 mg/只),腹腔注射0.5 ml生理盐水,1 h后注射同等体积LPS/D-Gal的混合溶液;c组和 d组(药物干预组):oridonin(0.2 mg/只)+LPS(40μg/只)/D-Gal(5 mg/只),其中c组:腹腔注射0.5 m l oridonin(0.2 mg/只),1 h后腹腔注射同等体积的LPS/D-Gal混合溶液;d组:每4天腹腔注射一次0.5 ml oridonin,共 3次,最后一次给药后1 h腹腔注射同等体积的LPS/D-Gal混合溶液;e组
(药物对照组):oridonin+NaCl,腹腔注射 0.5 ml oridonin(0.2 mg/只,oridonin溶于生理盐水中),1 h后注射同等体积的生理盐水。LPS/D-Gal诱导6 h后,取部分肝组织浸泡于4%多聚甲醛溶液中。另取肝组织经液氮速冻后,置于-80℃冰箱保存,备检。1.3肝组织细胞凋亡检测 采用TUNEL染色法,取固定于多聚甲醛中的肝组织,经过常规脱水、浸蜡、包埋,制成5μM切片,按照试剂盒说明书进行TUNEL染色。
1.4 肝组织TNF-α mRNA水平检测 采用RT-PCR法,以Trizol法提取肝组织RNA,经紫外分光光度计测定RNA纯度,取吸光度A260/A280为1.8~2.0的RNA用于逆转录,采用Real-time PCR试剂盒行PCR扩增,每个反应体系共20μl,包括DNA 模板(10 ng/μl) 1.4μl,SYBR 10 μl,引物1.6μl(10μM)和ddH2O 7 μl。反应条件为95℃预变性 10 min,95℃变性 20s,58℃退火 30 s,72℃延伸25 s,40个循环。以GAPDH为内参照,运用2-△△CT法分析结果。所有引物均由美国Thermo Fisher Scientific公司合成,其序列分别为:TNF-α:正 义 链 ,5’-CTC CCA GGT ATA TGG GCT CA-3’, 反 义 链 :5’-CCA GGT TCT CTT CAA GGG AC-3’;GAPDH:正义链,5’-TCC AAG GAG TAA GAA ACC CTG GAC-3’,反义链,5’-GTT ATT ATG GGG GTC TGG GAT GG-3’。
1.5 肝组织凋亡相关蛋白表达检测 采用Western blot法,以含有蛋白酶抑制剂cocktail的RIPA裂解液(强)提取肝组织蛋白,在超声仪上充分裂解后,冰浴30 min。于4℃ 12000 g离心15 min。吸取上清,以BCA法进行蛋白定量,沸水煮沸5 min,使蛋白充分变性,行SDS-聚丙烯酰胺凝胶电泳(PAGE),检测促凋亡蛋白JNK/P-JNK、cytochrome C、caspase8/9/3、bax和抗凋亡蛋白 bcl-xl表达的变化。应用Image J系统分析电泳条带灰度值,计算蛋白相对表达量。
1.6 统计学处理 应用GraphPad Prism 6.0进行统计学分析,计量资料以±s表示,组间比较采取独立样本t检验。P<0.05和P<0.01表示差异具有显著和非常显著性统计学意义。
2 结果
2.1 ALF小鼠肝组织细胞凋亡的变化 经TUNEL染色,结果显示模型组小鼠肝细胞凋亡率为(36.4±1.8)%,显著高于正常对照组的[(1.4±0.5)%,P<0.01];oridonin干预的 c组和 d 组肝细胞凋亡率分别为(19.4±3.3)%和(11.4±0.3)%,显著低于模型组(P<0.01,图1)。
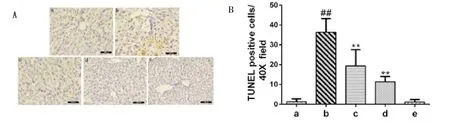
图1 肝组织细胞凋亡情况(TUNEL染色,200×)
2.2 ALF小鼠肝组织TNF-α mRNA水平变化 经Real-time PCR检测显示,模型组小鼠肝组织TNF-αmRNA水平显著高于正常对照组(P<0.01);oridonin干预的c组和d组肝组织TNF-α mRNA水平明显低于模型组(P<0.01,图 2),提示 oridonin可明显抑制LPS/D-Gal诱导的促凋亡细胞因子TNF-α mRNA水平的上调。
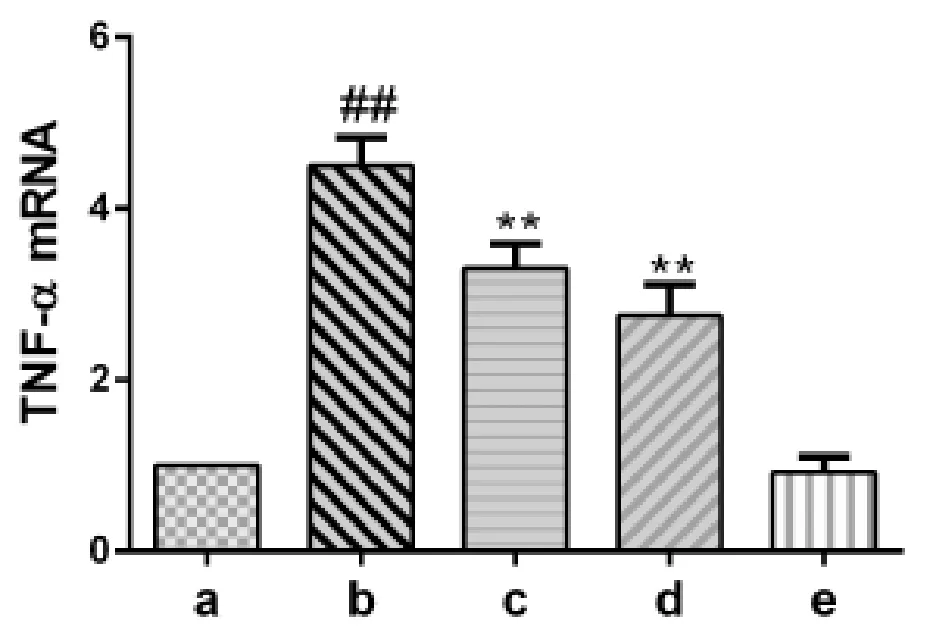
图2 ALF小鼠肝组织TNF-α mRNA水平的变化
2.3 ALF小鼠肝组织促凋亡蛋白JNK的变化 模型组小鼠肝组织P-JNK表达显著高于正常对照组(P<0.01);oridonin干预的 c组和 d组 P-JNK 表达水平显著低于模型组(P<0.01,图 3),提示 oridonin可明显抑制LPS/D-Gal诱导的促凋亡信号JNK的激活。

图3 肝组织促凋亡信号JNK的变化
2.4 ALF小鼠凋亡相关蛋白的变化 caspase8是死亡受体凋亡途径的关键蛋白,细胞色素C、caspase 9和bax是线粒体凋亡途径的关键蛋白[12],bcl-xl是bcl-2家族中的抗凋亡蛋白[13],caspase3是一种凋亡效应蛋白,cleaved caspase8/9/3/为caspase8/9/3的活化形式。经Western blot检测显示,模型组促凋亡蛋白caspase8、细胞色素 C、bax、caspase9 和 caspase3 活化水平明显增加,显著高于正常对照组(P<0.05,图4)。Oridonin预处理的c组和d组线粒体凋亡相关的促凋亡蛋白细胞色素C、bax、caspase9和caspase3活化水平明显下降,显著低于模型组(P<0.05,图4);同时,抗凋亡蛋白bcl-xl表达上调,显著高于模型组(P<0.05,图 4)。然而,oridonin预处理的 c组和 d组凋亡启动蛋白caspase8活化水平与模型组无明显差异。oridonin可抑制LPS/D-Gal的 ALF小鼠肝细胞凋亡,至少部分与抑制线粒体凋亡途径有关。
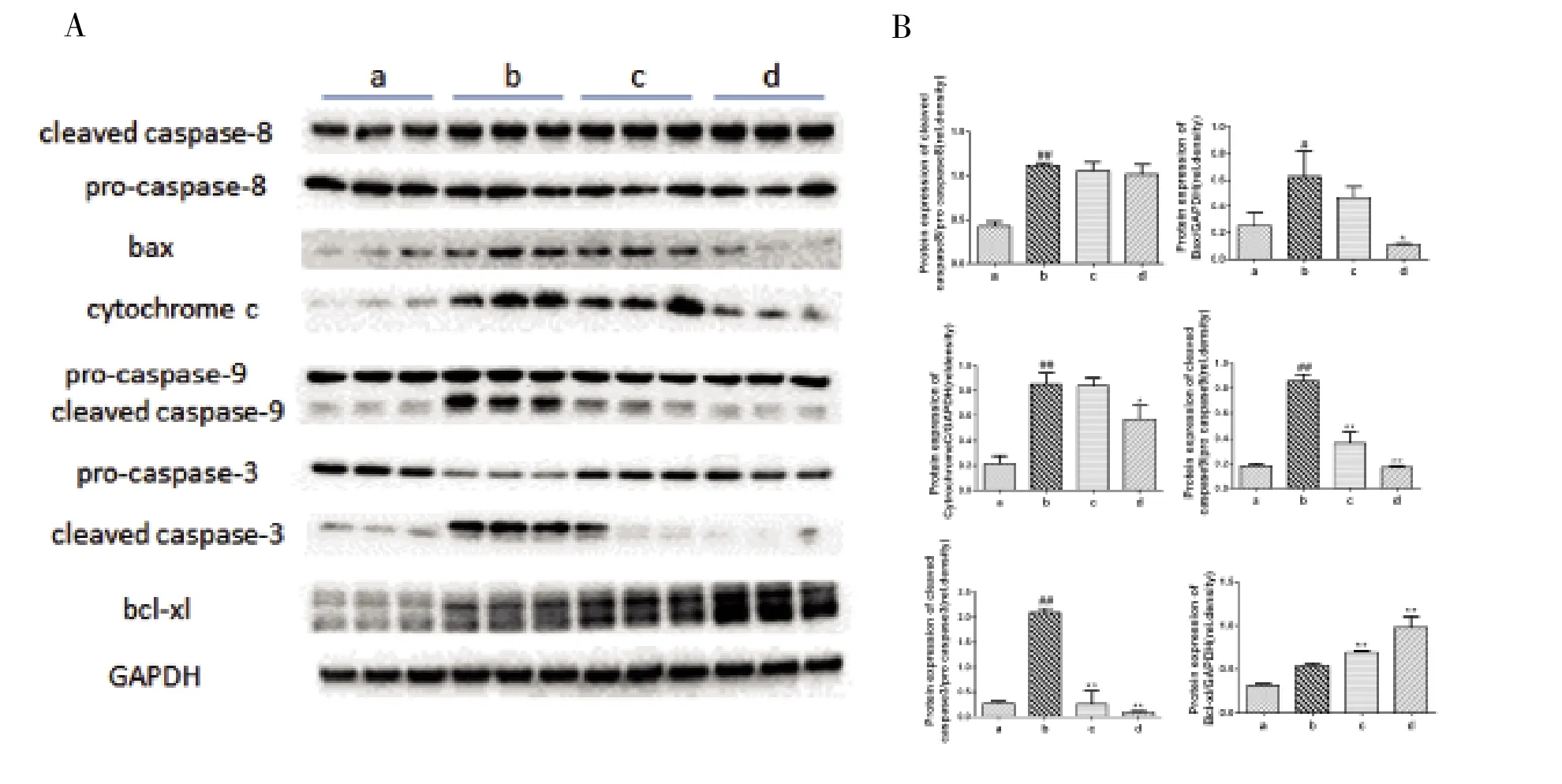
图4 ALF小鼠凋亡相关蛋白的变化
3 讨论
我们前期研究结果表明,oridonin对LPS/D-Gal诱导的ALF小鼠具有明显的保护作用,表现为ALF小鼠生存率的显著提高,肝组织病理学损伤的减轻及血清肝脏酶学指标的下调。肝细胞凋亡是一种短时相病理改变,是ALF早期的一种重要病理学表现,也是药物治疗的重要靶点[5,10]。我们的研究结果证实在LPS/D-Gal诱导小鼠ALF早期,存在广泛的肝细胞凋亡,oridonin干预可显著减轻LPS/D-Gal诱导的肝细胞凋亡,提示oridonin对ALF的保护作用可能部分与抑制肝细胞凋亡相关。
诱导肝细胞凋亡的刺激因素很多,包括炎症因子(如TNF-α)、线粒体损伤、缺氧等,在ALF发病进程中,它们常相互叠加,促进疾病进展[14,15]。死亡受体途径(由TNF-α及FasL启动)和线粒体凋亡途径(由Bcl-2家族蛋白调控)是介导细胞凋亡的两条经典途径[16]。TNF-α是LPS/D-Gal诱导ALF中主要的促凋亡因子[10]。TNF-α与TNFR1结合后招募一系列胞内蛋白而后激活凋亡起始蛋白caspase8,进而启动凋亡级联反应[17]。我们研究发现oridonin可明显抑制模型组小鼠肝组织TNF-α表达,而凋亡起始蛋白caspase8却无明显变化,提示oridonin对ALF的保护作用可能与抑制TNF-α介导的细胞凋亡有关,但似乎并不是通过抑制TNF-α介导的死亡受体通路来发挥作用的。
JNK是丝裂原活化蛋白激酶(MAPK)家族成员[12],可由细胞应激、炎症因子(TNF-α)等因素诱导激活,其中研究最为广泛的是,TNF-α通过与TNFR1结合,介导JNK的激活[18]。TNF-α介导的细胞凋亡与持续激活的JNK信号通路有关[19]。基于JNK2基因敲除小鼠及JNK激酶抑制剂SP600125的研究表明,JNK可通过诱导线粒体膜通透性改变、细胞色素C释放和bid转位,介导肝细胞凋亡[4,11,20]。因此,在 ALF 动物,TNF-α 不仅可直接诱导肝细胞凋亡,还可通过激活JNK介导的线粒体凋亡通路,从而显著放大TNF-α的促凋亡效应。为了进一步阐明oridonin的抗凋亡机制,我们检测了JNK及线粒体通路相关促凋亡和抗凋亡蛋白表达。研究发现,在LPS/D-Gal诱导的ALF小鼠,TNF-α上调可能是肝细胞凋亡的启动因素,而JNK激活介导的线粒体途径才是ALF早期肝细胞大量凋亡的关键。oridonin干预可显著逆转JNK激活,下调线粒体相关促凋亡蛋白表达,并上调抗凋亡蛋白bcl-xl表达,同时伴随肝细胞凋亡的显著减轻,表明oridonin的抗凋亡效应主要与JNK介导线粒体凋亡通路有关。
综上所述,我们研究证实oridonin对ALF小鼠的保护作用至少部分与抑制TNF-α表达及JNK介导线粒体凋亡通路有关,提示oridonin在干预ALF方面具有潜在的应用前景。
[1] Jedicke N,Struever N,Aggrawal N,et al.Alpha-1-antitrypsin inhibits acute liver failure in mice.Hepatology,2014,59(6):2299-2308.
[2] Lee WM,Squires Jr RH,Nyberg SL,et al.Acute liver failure:Summary of a workshop.Hepatology,2008,47(4):1401-1415.
[3] Gill RQ,Sterling RK.Acute liver failure.J Clin Gastroenterol,2001,33(3):191-198.
[4] Michael D,Josephs FRB,Fukuzuka K,et al.Lipopolysaccharide and D-galactosamine-induced hepatic injury is mediated by TNF-αand not by Fas ligand.Am J Physiol Regulat Integrat Comp Physiol,2000,278:1196-1201.
[5] Luo M,Zhao A,Li J,et al.Acute liver injury attenuation of a novel recombinant sTNFR through blocking hepatic apoptosis.Immunopharmacol Immunotoxicol,2015,37(3):295-300.
[6] Ikezoe T,Yang Y,Taguchi H.Oridonin,a diterpenoid purified from Rabdosia rubescens,inhibits the proliferation of cells from lymphoid malignancies in association with blockade of the NF-KB signal pathways. Mol Cancer Ther,2005,4:578-586.
[7] Shi Min,Lu XJ,Zhang J,et al.Oridonin,a novel lysine acetyltransferases inhibitor,inhibits proliferation and induces apoptosis in gastric cancer cells through p53-and caspase-3-mediated mechanisms.Oncotarget,2016,7(16):22623-22631.
[8]Wang S,Yang H,Yu L,et al.Oridonin attenuates abeta1-42-induced neuroinflammation and inhibits NF-kappaB pathway.PLoS One,2014,9(8):e104745.
[9] Guo W,Zheng P,Zhang J,et al.Oridonin suppresses transplant rejection by depleting T cells from the periphery.Int Immunopharmacol,2013,17(4):1148-1154.
[10]Nowak M,Moldawer LL.LPS-induced liver injury in D-galactosamine-sensitized mice requires secreted TNF-α and the TNF-p55 receptor.Am J Physiol Regulat Integrat Comp Physiol,2000,278:1202-1209.
[11]Wang Y,Singh R,Lefkowitch JH,et al.Tumor necrosis factor-induced toxic liver injury results from JNK2-dependent activation of caspase-8 and the mitochondrial death pathway.J Biol Chem,2006,281(22):15258-15267.
[12]Brenner C,Galluzzi L,Kepp O,et al.Decoding cell death signals in liver inflammation.J Hepatol,2013,59(3):583-594.
[13]Anilkumar U,Prehn JH.Anti-apoptotic BCL-2 family proteins in acute neural injury.Front Cell Neurosci,2014,8:281.
[14]Guicciardi ME,Malhi H,Mott JL,et al.Apoptosis and necrosis in the liver.Compr Physiol,2013,3(2):977-1010.
[15]Mcilwain DR,Berger T,Mak TW.Caspase functions in cell death and disease.Cold Spring Harb Perspect Biol,2013,5(4):a008656.
[16]Micheau O,Tschopp J.Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes.Cell,2003,114(2):181-190.
[17]Schwabe RF,Brenner DA.Mechanisms of liver injury.I.TNF-alpha-induced liver injury:role of IKK,JNK,and ROS pathways.Am J Physiol Gastrointest Liver Physiol,2006,290(4):G583-589.
[18]Ding WX,Yin XM.Dissection of the multiple mechanisms of TNF-α-induced apoptosis in liver injury.J Cell Mol Med,2004,8:445-454.
[19]Seki E,Brenner DA,Karin M.A liver full of JNK:signaling in regulation of cell function and disease pathogenesis,and clinical approaches.Gastroenterology,2012,143(2):307-320.
[20]Takamura M,Matsuda Y,Yamagiwa S,et al.An inhibitor of c-Jun NH2-terminal kinase,SP600125,protects mice from D-galactosamine/lipopolysaccharide-induced hepatic failure by modulating BH3-only proteins.Life Sci,2007,80(14):1335-1344.
(收稿:2016-11-17)
(本文编辑:陈从新)
Suppression of TNF-αand JNK-related pro-apoptotic signaling expression of oridonin in m ice w ith LPS/D-Gal-induced acute liver failure
Deng Yilin,Yu Heguo,Shi Min,et al.Department of Gastroenterology, Xinhua Hospital Affiliated to Jiaotong University School of Medicine,Shanghai 200092,China
Objective To investigate the anti-apoptosis effect of oridonin in mice with lipopolysaccharide(LPS)/D-galactosamine(D-Gal)-induced acute liver failure(ALF).Methods 25 mice were randomly divided into five groups (5 in each),e.g.,normal,model,oridonin-intervened and oridonin-intervened at different doses,and oridonin for 12 days.ALF model was established in C57BL/6 mice by intraperitoneal injection of LPS/D-Gal.TUNEL,real-time PCR and Western blot were applied to related detection.Results Hepatocyte apoptosis rate in mice in model group was(36.4±1.8)%,significantly higher than that in oridonin-intervened groups[(19.4±3.3)%and (11.4±0.3)%,respectively,P<0.01];administration of oridonin significantly decreased hepatic TNF-α mRNA level in model group (P<0.01);the expressions of mitochondrial-dependent pro-apoptotic protein such as JNK,bax,cytochrome C,cleaved caspase8/9/3 were upregulated in the model group as compared to in the control group;Pretreatment with oridonin significantly reversed the changes of apoptosis signal pathway induced by LPS/D-Gal,the expression of caspase 8 was not significantly changed and the expression of anti-apoptotic protein bcl-xl increased.Conclusion Oridonin has an anti-apoptosis effect on LPS/D-Gal-induced ALF in mice,and its mechanism may be related to the suppression of pro-apoptotic cytokine TNF-αand JNK-related pro-apoptotic signaling.
Acute liver failure;D-galactosamine;Oridonin;Apoptosis;Mice
国家自然科学基金资助项目(编号:81400631/81570549)
200092上海市 上海交通大学医学院附属新华医院消化内科(邓怡林,石翠翠,范建高,李光明);附属同仁医院消化内科(施敏);上海市计划生育科学研究所(于合国,刁华)
邓怡林,女,25,硕士研究生。主要从事肝损伤及肝纤维化的防治研究
李光明,E-mail:ligm68@126.com
10.3969/j.issn.1672-5069.2017.04.005
