家蚕核型多角体病毒对寄主细胞凋亡抑制蛋白BmAPI5表达的影响
2017-09-08聂作明蒋彩英
章 娜,聂作明,蒋彩英
(浙江理工大学 生命科学学院,浙江 杭州 310018)
家蚕核型多角体病毒对寄主细胞凋亡抑制蛋白BmAPI5表达的影响
章 娜,聂作明,蒋彩英*
(浙江理工大学 生命科学学院,浙江 杭州 310018)
API5是一种新的细胞凋亡抑制蛋白因子,能有效抑制细胞凋亡。API5在结构与功能上高度保守,并已在包括家蚕在内的多种昆虫中发现存在同源基因。本文检测了家蚕幼虫BmAPI5基因在BmNPV和大肠杆菌侵染后的转录与表达变化。结果表明,微生物侵染能快速显著诱导BmAPI5基因的转录与表达,其中以BmNPV的诱导作用较为明显。这表明BmAPI5可能参与BmNPV-宿主的互作机制。
家蚕;核型多角体病毒;BmAPI5;基因表达
细胞凋亡(Apoptosis),又称程序性细胞死亡(Programmed cell death,PCD),是一种细胞自主有序的生理性死亡方式,旨在主动清除那些不再需要的、损伤的或有害的细胞[1]。细胞凋亡作为进化上高度保守的生物学现象,在维持机体正常发育与器官形成、维护内环境稳定和抵御外界侵害等方面具有重要作用。与哺乳动物和线虫等生物相似,昆虫细胞凋亡涉及一系列的基因激活、表达与调控。现已发现在昆虫体内存在多条相互联系的细胞凋亡信号转导途径,包括依赖于线粒体细胞色素C(Cyto⁃chrome C,Cytc)的释放和胱天蛋白酶(Cysteinyl as⁃partate specific proteinase,Caspase)活化的信号通路、不依赖于细胞色素C的释放但依赖于Caspase活化的信号通路和不依赖于Caspase活化的信号通路等[2]。有关昆虫细胞凋亡机制及其信号通路的研究主要集中于黑腹果蝇Drosophilamelanogaster[3-4]。近年来,家蚕Bombyxmori作为鳞翅目模式种类在细胞凋亡及其相关基因与功能等方面已有较多研究[5-13],特别是在其基因组测序完成后,已鉴定出52个与其他昆虫及哺乳动物等相似的细胞凋亡相关基因,包括凋亡信号通路中的各关键基因如Caspase、Bcl-2(B-cell lymphoma/leukemia-2)和凋亡抑制蛋白(In⁃hibitors of apoptosis,IAPs)等家族同源基因以及Cytc和凋亡蛋白酶活化因子-1(Apoptotic protease activating factor-1,Apaf-1)等[14]。Bcl-2 和IAPs是重要的凋亡调控蛋白,其中Bcl-2家族由促凋亡因子(如Bax、Bak、Bcl-Xs、Bad、Bik、Bid和Hrk等)和抑凋亡因子(Bcl-2、Bcl-xl、Mcl-1、Bcl-w和GRS等)组成,而IAPs家族则通过其保守的杆状病毒IAP重复序列结构域(Baculovirus inhibitor of apoptosis re⁃peats,BIR)与Caspase结合而阻断细胞凋亡进程[15]。
研究表明,外界刺激如病毒感染、紫外线辐射、化学药物和氨基酸饥饿等都可诱导昆虫细胞发生凋亡[2]。其中,杆状病毒是最早发现能诱导与抑制宿主细胞凋亡的病毒之一[15]。宿主细胞能通过启动细胞凋亡来应答防御病毒的感染[16],同时作为对宿主抗病毒防御的适应策略,病毒在感染早期利用自身编码的抗凋亡基因表达来抑制宿主细胞凋亡,以利于其复制与增殖,而在感染晚期的促进宿主细胞凋亡则利于病毒的传播与扩散[17]。目前,在杆状病毒中已发现P35和IAP等抗凋亡基因[18-19]。宿主细胞凋亡不仅受到其自身抗凋亡因子的调控,而且在感染病毒后还受到病毒编码的抗凋亡因子调控。有关昆虫与病毒的抗凋亡基因及其调控机制以及在病毒-寄主互作中的功能作用至今尚未完全明了[20]。
在各种抗凋亡因子中,API5(Apoptosis inhibi⁃tor-5),又称为AAC-11(Anti-apoptosis clone 11)和FIF(Fibroblast growth factor-2-interacting factor),是一种新发现的细胞凋亡抑制蛋白因子,能有效抑制因缺乏血清和生长因子而引发的细胞凋亡[21-22]。API5基因在哺乳类、两栖类、昆虫和植物等生物中高度保守,因其在人类癌细胞中高水平表达以促进癌细胞发生、并受microRNA-1等负调控抑制癌细胞生长而倍受关注[23]。在人类细胞中,API5通过其亮氨酸拉链基序与Acinus蛋白活性位点结合,抑制Caspase-3对Acinus的裂解,从而阻止凋亡细胞的DNA片段化[24]。此外,在人和果蝇中,API5还能负向调控E2F1(E2-promoter binding factor 1)依赖的细胞凋亡[25]。目前,已在家蚕基因组中发现存在同源基因BmAPI5(GenBank编号:XM_004927989),但一直未有其相关研究报道。近年来,我们开展了家蚕BmAPI5基因的克隆、表达与功能等研究,发现该基因的开放阅读框为1,668 nt,编码556个氨基酸,分子量63.13 K道尔顿,与黑腹果蝇同源基因Aac11的序列相似性为46%,具有API5基因家族的特征结构域[26],并且在家蚕不同发育时期均有表达。本文报道家蚕核型多角体病毒(Bombyxmorinucleopoly⁃hedrovirus,BmNPV)对该基因转录与表达的影响,旨为探明BmAPI5在家蚕-杆状病毒互作中的功能作用以及用于家蚕抗病毒防治提供基础。
1 材料与方法
1.1 材料
家蚕大造品种(P50)由浙江大学动物科学学院鲁兴萌教授提供,家蚕杆状病毒BmNPV由浙江理工大学生命科学学院陈健副教授提供。阳性对照大肠杆菌Escherichiacoli菌株Trans-T1购自北京全式金生物技术(TransGen Biotech)有限公司。
家蚕BmAPI5蛋白的兔源多克隆抗体委托杭州华安生物技术有限公司制备合成。RNA提取试剂Trizol购自美国Invitrogen公司;TaKaRa逆转录试剂盒和实时荧光定量PCR试剂盒购自大连宝生公司;Tubulin抗体购自美国Proteintech公司;HRP标记二抗购自美国Cell Signaling公司。定量PCR引物由上海生工生物工程公司合成。其它试剂均为国产或进口分装AR级产品。
1.2 样品制备
取家蚕5龄第1 d幼虫用75%酒精消毒虫体后,采用微量注射器分别在每头腹部注射5m l以0.15 M NaCl按1∶25稀释的大肠杆菌Trans-T1菌株(OD600=1.0)和家蚕杆状病毒BmNPV(1.25×106pfu/m l),并以注射0.15 M NaCl为阴性对照,各处理分别重复3次。处理后饲喂新鲜桑叶,在1 h、3 h、6 h、12 h、1 d和3 d后分别取样,在去除肠道内容物后,按Trizol操作说明书分别提取各样品的总RNA和蛋白质,并置于-80℃冰箱中保存备用。
1.3 家蚕Bm API5基因的定量PCR检测
选择家蚕微管蛋白α-Tubulin基因(GenBank编号:NM_001043419)为实时荧光定量PCR的内参基因。根据家蚕BmAPI5和α-Tubulin的mRNA序列,采用Primer3在线分析软件(http://primer3.ut.ee/)分别设计定量PCR引物,BmAPI5上游引物:5’-GCT CGT CTC ACA CAA GGC TA-3’和下游引物:5’-AAA TGA TGG TGG GGT ACG GA-3’;α-Tubulin上游引物:5’-TGA CCA CAA GTT CGA CCT CA-3’和下游引物:5’-GTA CTC TTCGGC TCC CTC AC-3’。验证引物的特异性,以保证溶解曲线为平滑单峰且峰值单一,无杂峰;并对目的PCR产物测序,确认引物扩增的PCR产物为特异性目的基因片段。
取各样品总RNA,经逆转录合成cDNA,用作PCR模板。实时荧光定量PCR参照SYBR Premix Ex Taq II试剂盒说明书,在实时荧光定量PCR仪(型号7300,美国ABI公司)上操作进行。PCR反应体系20 μL,其中cDNA 5 μL,引物终浓度为100 nmol/L;反应条件为:95℃预变性10 min;95℃ 15 s,60℃15 s,40个循环。比较目的基因与内参基因的Ct值,即可获得基因相对表达量[27]。
1.4 家蚕Bm API5蛋白的W estern印迹检测
将提取的各蛋白样品进行SDS-PAGE电泳,结束后把蛋白从SDS-PAGE胶上转移到PVDF膜上,然后用封闭液封闭2 h;接着与BmAPI5兔多抗(1∶1000)稀释液抗室温反应1 h,用洗脱液PBST洗膜3次;加入HRP二抗(1∶10000)稀释液室温反应1 h,用洗脱液洗膜3次;用ECL显色液显色,并在化学发光分析仪Luminoskan Ascent(美国Thermo公司)上扫描成像。
1.5 数据分析
试验数据采用DPS软件[28]进行单因素方差分析,用最小显著差数法(LSD法)比较各平均数间的差异显著性。
2 结果与分析
2.1 家蚕Bm API5基因的转录动态分析
对家蚕5龄幼虫的注射处理可诱导BmAPI5基因转录水平快速升高(图1)。在处理后1 h时,注射BmNPV处理组的转录水平极显著增高(p<0.01),而在注射大肠杆菌(阳性对照)和无菌PBS(阴性对照)之间无显著差异。注射大肠杆菌和注射无菌PBS的BmAPI5转录水平分别在处理后12 h和3 h时显著回落,并随时间延长而再无显著变化;注射BmNPV的BmAPI5转录水平随时间延长而降低,并在处理后3 h和12 h时各出现一次显著性回落,但其总体上均显著高于注射无菌PBS的对照。

图1 家蚕幼虫注射处理对BmAPI5基因转录的影响Figure 1 Effects of injection treatments on the gene transcription of BmAPI5 inB.morilarvae.
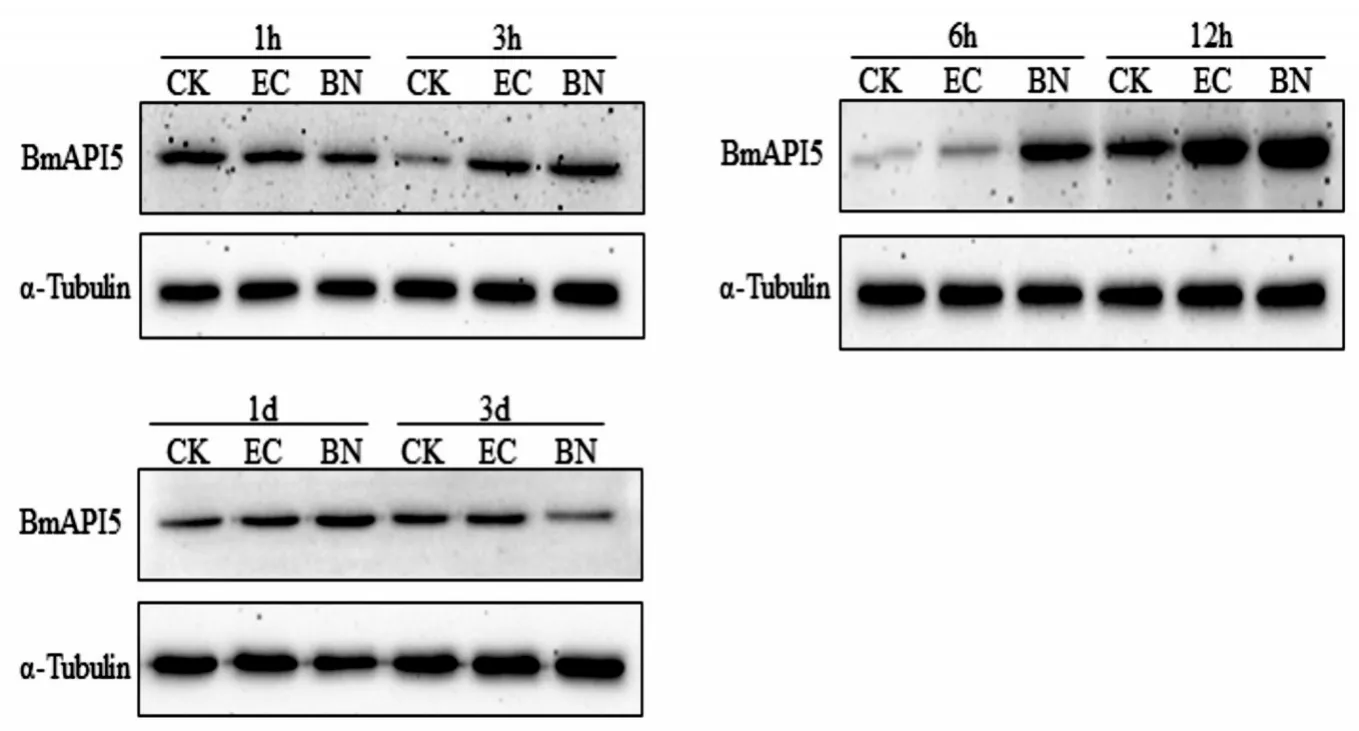
图2 家蚕幼虫注射处理对BmAPI5蛋白表达的影响Figure 2 Effects of injection treatments on the protein expression of BmAPI5 inB.morilarvae
2.2 家蚕Bm API5蛋白的表达动态分析
对家蚕5龄幼虫的注射大肠杆菌和BmNPV可诱导BmAPI5基因的蛋白表达水平(图2)。与注射无菌PBS的对照相比,家蚕幼虫在BmNPV注射1 h后,体内BmAPI5蛋白的表达水平仍相对较低,3 h后明显升高,并于6~12 h达到峰值,后随时间延长而逐渐降至对照水平;注射大肠杆菌后,BmAPI5表达量在处理后3 h开始升高,12 h达到最高,后渐趋于对照水平。尽管注射BmNPV的BmAPI5表达变化与注射大肠杆菌的相似,但在诱导的表达量上明显以注射Bm⁃NPV的为高。BmAPI5在不同处理后的蛋白表达变化趋势与其基因转录的相似,但存在明显的滞后现象。
3 讨论
API5是与已知的IAPs在结构上完全不同的一类新的凋亡抑制蛋白[21,30],从酵母、线虫、昆虫到人类都表现出高度的保守性[25]。目前,在GenBank数据库已登录有92条昆虫API5同源基因序列,涉及70种昆虫。有关API5的研究主要集中在与人类癌细胞凋亡调控机制及抗癌治疗等方面[30-33],在昆虫中仅限于以黑腹果蝇为疾病模型的调控作用机制研究[25]。在作为鳞翅目模式种类的家蚕中开展API5基因功能及其调控机制等相关研究,对于深入理解细胞凋亡这一生物学现象的本质以及为人类疾病研究与治疗提供不同模型等颇有意义。
本文结果显示,家蚕幼虫被微生物侵染后可快速诱导BmAPI5基因的转录与表达,其中以BmNPV的诱导作用较为明显。这表明BmAPI5不仅参与家蚕正常细胞的凋亡调控,而且还涉及病毒-宿主的互作反应。杆状病毒对家蚕细胞的凋亡调控,在感染早期主要通过病毒编码的IAPs抑制宿主细胞凋亡以利于其复制与增殖;在后期促进家蚕细胞凋亡以利于病毒释放与传播[17]。因此,BmNPV侵染后诱导家蚕BmAPI5高水平表达来抑制宿主细胞的凋亡,推测可能是BmNPV作为其调控宿主细胞凋亡的一种间接手段,是利用其IAPs直接抑制凋亡的补充途径。有关病毒对宿主API5基因的表达调控机制至今尚乏研究。在人类研究中,发现甲型流感病毒(Influ⁃enza A virus,IAV)可通过其编码的核蛋白(Nucleo⁃protein,NP)与API5互作,促进细胞凋亡而有利于IAV的复制[34]。由于杆状病毒对宿主细胞凋亡的作用方式与IAV诱导细胞凋亡不同,因此,有关BmA⁃PI5在与BmNPV-家蚕细胞互作中的调控机制有待进一步研究,以期为家蚕抗病毒育种提供基础。
[1] STELLER H.Mechanisms and genes of cellular suicide[J].Science,1995,267(5203):1445~1449.
[2] 刘凯于,邓玉杰,张许平,等.昆虫细胞程序性死亡的研究进展[J].昆虫学报,2008 ,51(6):652~658.
[3] STELLER H.Regulation of apoptosis in Drosophila[J].Cell Death Differentiation,2008,15(7):1132~1138.
[4] CLAVIER A,RINCHEVAL ARNOLD A,et al.Apoptosis inDrosophila:which role for mitochondria?[J].Apopto⁃sis,2016,21(3):239~251.
[5] 段军,朱虹,查幸福,等.与家蚕细胞凋亡相关的Caspase基因Bm Ice的克隆和序列分析[J].蚕业科学,2005,31(3):261~267.
[6] 包人月,吴金美.蚕的细胞凋亡相关基因及其检测技术[J].蚕桑通报,2006 ,37(2):9~14.
[7] MAKON V E,NEZIS IP,STRAVOPODISD J,et al.Pro⁃grammed cell death of the ovarian nurse cells during oo⁃genesis of the silkmothBombyxmori[J].Development Growth Differentiation,2006,48(7):419~428.
[8] 潘敏慧,陈默,黄淑静,等.家蚕细胞色素C基因的克隆及其蛋白在家蚕凋亡细胞中的释放[J].中国农业科学,2009 ,42(7):2546~2551.
[9] SUGANUMA I,USHIYAMA T,YAMADA H,et al.Clon⁃ing and characterization of a dronc homologue in the silk⁃worm,Bombyxmori[J].Insect Biochemistry Molecular Bi⁃ology,2011,41(11):909~921.
[10]TIAN L,LIU S,LIU H,et al.20-hydroxyecdysone upregulates apoptotic genes and induces apoptosis in theBombyxfat body[J].Archives of Insect Biochemistry Physiology,2012,79(4-5):207~2019.
[11]应慧慧,余海鹏,寿鑫,等.家蚕Bm30Kc6蛋白对过氧化氢诱导的家蚕细胞凋亡的抑制作用[J].农业生物技术学报,2013 ,21(4):441~447.
[12]刘学术,胡启豪,郑思春,等.家蚕翅原基细胞的凋亡和自噬分析[J].昆虫学报,2016 ,59(12):1317~1324.
[13]WANG L,SONG J,BAO XY,et al.BmDredd is an initia⁃tor caspase and participates in Emodin-induced apopto⁃sis in the silkworm,Bombyxmori[J].Gene,2016,591(2):362~368.
[14]ZHANG JY,PANM H,SUN Z Y,et al.The genomic un⁃derpinnings of apoptosis in the silkworm,Bombyxmori[J].BMCGenomics,2010,11(1):611
[15]吕鸿声.昆虫免疫学原理[M].上海:上海科学技术出版社,2008.
[16]CLOUSTONW M,KERR JF.Apoptosis,lymphocytotox⁃icity and the containment of viral infections[J].Medical Hypotheses,1985,18(4):399~404.
[17]IKEDA M,YAMADA H,HAMAJIMA R,et al.Baculovi⁃rus genesmodulating intracellular innate antiviral immu⁃nity of lepidopteran insect cells[J].Virology,2013,435(1):1~13.
[18]CLEM R J,MILLER L K.Control of programmed cell death by the baculovirus genes p35 and iap[J].Molecu⁃lar cell biology,1994,14(8):5212~5222.
[19]包人月,吴金美,吴小锋.昆虫杆状病毒细胞凋亡抑制基因[J].细胞生物学杂志,2006 ,28 :676~680.
[20]VASUDEVAN D,RYOO H D.Regulation of Cell Death by IAPs and Their Antagonists[J].Current Topics in De⁃velopmental Biology,2015,114:185~208.
[21]TEWARIM,YU M,ROSSB,et al.AAC-11,a novel cD⁃NA that inhibits apoptosis after growth factor withdrawal[J].Cancer Research,1997,57(18):4063~4069.
[22]VAN DEN BERGHE L,LAURELL H,HUEZ I,et al.FIF[fibroblast growth factor-2(FGF-2)-interacting-factor],a nuclear putatively antiapoptotic factor,interacts specifi⁃cally with FGF-2[J].Molecular Endocrinology,2000,14(11):1709~1724.
[23]LID,LIU Y,LIH,et al.MicroRNA-1 promotes apopto⁃sis of hepatocarcinoma cells by targeting apoptosis inhibi⁃tor-5(API-5)[J].Febs Letters,2015,589(1):68~76.
[24]RIGOU P,PIDDUBNYAK V,FAYE A,et al.The anti⁃apoptotic protein AAC-11 interacts with and regulates Acinus-mediated DNA fragmentation[J].Embo Journal,2009,28(11):1576~1588.
[25]MORRIS E J,MICHAUD W A,JI JY,et al.Functional identification of Api5 as a suppressor of E2F-dependent apoptosisinvivo[J].PLoSGenetics,2006,2(11):e196.
[26]MARCHLER BAUER A,BO Y,HAN L,et al.CDD/SPARCLE:functional classification of proteins via sub⁃family domain architectures[J].Nucleic Acids Research,2017,45(D1):200~203.
[27]SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative CTmethod[J].Nature Pro⁃tocol,2008,3(6):1101~1108.
[28]TANG Q Y,ZHANG C X.Data Processing System(DPS)software with experimental design,statistical analysis and data mining developed for use in entomological research[J].Insect Science,2013,20(2):254~260.
[29]HAN BG,KIM K H,LEE S J,et al.Helical repeat struc⁃ture of apoptosis inhibitor 5 reveals protein-protein inter⁃action modules[J].Journal of Biological Chemistry,2012,287(14):10727~37.
[30]FAYE A,POYET JL.Targeting AAC-11 in cancer thera⁃py[J].Expert Opin Ther Targets,2010,14(1):57~65.
[31]CHO H,CHUNG JY,SONG K H,et al.Apoptosis inhibi⁃tor-5 overexpression is associated with tumor progression and poor prognosis in patients with cervical cancer[J].BMCCancer.2014,14(1):545.
[32]NOH K H,KIM SH,KIM JH,et al.API5 confers tumor⁃al immune escape through FGF2-dependent cell survival pathway[J].Cancer Research,2014,74(13):3556~3566.
[33]JAGOT LACOUSSIERE L,KOTULA E,VILLOUTREIX BO,et al.A cell-penetrating peptide targeting AAC-11 specifically induces cancer cells death[J].Cancer Re⁃search,2016,76(18):5479~5490.
[34]MAYANK A K,SHARMA S,NAILWAL H,et al.Nucleo⁃protein of influenza A virus negatively impacts antiapop⁃totic protein API5 to enhance E2F1-dependent apoptosis and virus replication[J].Cell Death Disease,2015,6(12):e2018
Effects of Bombyx mori Nucleopolyhedrovirus on the Expression of Apoptosis Inhibitor,Bm API5 in Bombyx mori
ZHANG Na,NIE Zuo-m ing,JIANG Cai-ying*
(College of Life Sciences,Zhejiang Sci-Tech University,Hanghzou 310018,China)
The apoptosis inhibitor-5(API5)is a recently discovered inhibitor of apoptosis,which can effectively inhibit cell apoptosis.API5 is highly conserved in structure and function,and has been found in a variety of insects,including the silkworm,Bombyxmori.In this paper,the changes of the transcription and expression of BmAPI5 gene inB.morilarvae infected by BmNPV andEscherichiacoliwere detected.The results showed that microbial infection could significantly induce the transcription and expression of BmAPI5 gene,and the induction of BmNPV wasmore obvious.It suggests that BmAPI5may be involved in themechanism of BmNPV-host interaction.
Bombyxmori;nucleopolyhedrovirus;BmAPI5;gene expression
S884.5
A
0258-4069[2017]02-029-05
国家自然科学基金项目(31200974)
章娜(1990-),女,浙江衢州人,硕士研究生,从事家蚕生理生化与分子生物学研究。E-mail:491917586@qq.com
蒋彩英,女,副研究员。E-mail:jcy@zstu.edu.cn
