6种菊花抗氧化活性及总酚含量的研究
2017-09-07杨璐齐陈冠林俞憬王煜坤高永清傅南琳
杨璐齐,陈冠林,俞憬,王煜坤,高永清,傅南琳
(1.广东药科大学食品科学学院,广东中山528458;2.佛山市职业病防治所,广东佛山528000;3.广东药科大学附属第一医院,广东广州510008)
6种菊花抗氧化活性及总酚含量的研究
杨璐齐1,陈冠林2,俞憬1,王煜坤1,高永清1,傅南琳3,*
(1.广东药科大学食品科学学院,广东中山528458;2.佛山市职业病防治所,广东佛山528000;3.广东药科大学附属第一医院,广东广州510008)
采用DPPH、ABTS和FRAP 3种方法测定了6种菊花的抗氧化活性并用福林-酚法测定其总酚含量。结果表明:依据其总酚含量和抗氧化活性,6种菊花均是很好的抗氧化剂来源。FRAP、DPPH和ABTS试验显示,黄金菊的抗氧化活性最强,其 FRAP、DPPH 和 ABTS 值分别为 150.22、125.19、173.47 μmol Trolox/g。此外,总酚测定结果表明,黄金菊的总酚含量最高。
抗氧化性;总酚;菊花
菊花(chrysanthemum),学名为Dendranthemamorifolium(Ramat.)Tzvel,为菊科(Asteraceae)植物菊花的干燥头状花序,是一种常见的药食两用的花卉,具有清热、明目、疏风、解毒之功效[1-2],可用于治疗头痛眩晕、风热感冒、眼目昏花以及目赤肿痛。菊花在中国具有3 000多年的栽培历史,按产地和加工方法的不同,分为“杭菊”、“贡菊”、“毫菊”、“怀菊”、“滁菊”、“祁菊”、“济菊”和“黄菊”八大主流品种[3]。菊花的主要化学成分为黄酮类、单萜类、蒽醌类、倍半萜以及三萜类等化合物,具有抗炎、抗菌、抗肿瘤以及降血脂等多种生物学活性[4-7]。从目前掌握的文献来看,虽然有不少人对菊花提取物及其抗氧化性进行了相关的研究[2,8-11],但对菊花中酯化酚(esterified phenolics)以及难溶性酚(insoluble-bound phenolics)的研究较少。因此,本研究以菊花为原料,以一定比例的乙醇提取其中的游离酚(free phenolics)后,应用碱液对提取液及提取残渣水解而获得酯化酚和难溶性酚,测定其多酚含量,并系统地测定了菊花多酚的抗氧化活性,旨在为开发菊花多酚提供依据。
1 材料
1.1 材料与试剂
1.1.1 材料
6种菊花(杭白菊、黄金菊、胎菊、洋金菊、黄山贡菊、金菊花):购于广东省佛山市某市场。
1.1.2 试验试剂
Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,水溶性维生素 E)、ABTS(2,2-azinobis-3-ethylbenzothiazoline-6-sulfonic acid,2,2'-联氨-双-3-乙基-苯并噻唑啉-6-磺酸)以及福林-酚试剂(Folin-Ciocalteu reagent):美国 Sigma公司;TPTZ(2,4,6-tris-2,4,6-tripiridyl-2-triazine,三吡啶三吖嗪)和 DPPH(1,1-diphenyl-2-picrylhydrazyl,1,1-二苯基-2-三硝基苯肼):阿拉丁公司;乙醇、FeCl3、HCl、乙酸钠、过硫酸钾、没食子酸、乙醇(分析纯):天津化学试剂厂。
1.2 仪器与设备
UV-9600紫外/可见分光光度计:北京瑞利分析仪器有限公司;LEO-150S超声清洗仪:昆山力波超声波设备有限公司;ACQUITY UPLC H-CLASS超高效液相色谱仪:美国Waters公司;HD-100高速多功能粉碎机:诸暨市海道机械有限公司;SY2000旋转蒸发器:上海亚荣生化仪器厂;SHZ-Ⅲ型循环水真空泵:上海亚荣生化仪器厂。
1.3 样品的制备
菊花购回后用粉碎机粉碎,过20目筛备用。
2 方法
2.1 酚类的水解
准确称取1.00 g样品,加入50 mL 40%乙醇,超声波辅助浸提10 min后将提取液过滤,水相减压蒸馏至20 mL左右后用6 mol/L HCl调pH至2,用乙酸乙酯(1∶1,体积比)萃取3次。乙酸乙酯相经混合减压蒸馏(50℃)至干后溶于50%甲醇中,获得游离酚(free phenolics)。于萃取游离酚后的水相中加入30 mL 4 mol/L NaOH,室温下用氮吹仪吹入氮气水解4 h,然后用 6 mol/L HCl调至 pH2,再用乙酸乙酯(1∶1,体积比)萃取3次,乙酸乙酯相经混合减压蒸馏至干后溶于50%甲醇中,获得酯化酚(esterified phenolics)。在开始过滤后的提取物残渣中加入20 mL 4 mol/L NaOH,室温下用氮吹仪吹入氮气水解4 h,然后用6 mol/L HCl调至pH2,过滤后用乙酸乙酯(1∶1,体积比)萃取3次,乙酸乙酯相混合减压蒸馏至干后溶于50%甲醇中,获得难溶性酚(insoluble-bound phenolics)[12]。
2.2 总酚含量的测定
取0.10 mL待测样品,加入2.50 mL Folin-Ciocalteu试剂中,反应4 min后,加入2.00 mL 75 g/L的Na2CO3溶液,置室温下反应120 min,于760 nm下测定吸光度。结果以没食子酸当量(gallic acid equivalents,GAE)表示,单位为 mg GAE/g[13-14]。
2.3 FRAP法测定抗氧化活性
FRAP试剂由10 mmol/L的TPTZ(溶于40 mmol/L盐酸)、20 mmol/L的三氯化铁、300 mmol/L的乙酸钠缓冲液(pH3.6)以1∶1∶10(体积比)的比例混合而成。取100 μL待测样品,加入3 mLFRAP溶液中充分混合,反应120 min后于593 nm处测定吸光度。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用μmol Trolox/g 表示[15-16]。
2.4 DPPH法测定抗氧化活性
取0.1 mL待测样品,加入0.06 mmol/L DPPH 80%乙醇溶液3.9 mL,振荡15 s,放置暗处反应2 h后,于515 nm处测定吸光度,按以下公式计算清除率:
清除率/%=(A对照-A样品)×100/A对照。式中:A对照为对照组的吸光度,A样品为样品的吸光度。
以3.9 mL DPPH+0.1 mL 80%乙醇作对照、80%乙醇作空白,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μmol Trolox/g[17]。
2.5 ABTS法测定抗氧化能力
将7 mmol/L的ABTS(用pH值为4.5、20 mmol/L的乙酸钠配制)和2.45 mmol/L的过硫酸钾等体积混合,室温下避光反应12 h~16 h,形成ABTS储备液。使用前用20 mmol/L乙酸钠(pH4.5)将ABTS储备液稀释成为工作液,使其在734 nm处吸光度为0.700±0.005。取100 μL待测样品,加入3 mL ABTS工作液,室温下反应2 h后,在734 nm处测定吸光度。以20 mmol/L乙酸钠(pH4.5)为空白,ABTS工作液为对照,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用TEAC(trolox equivalent antioxidant capacity)表示[15],单位为μmol Trolox/g。
3 结果与分析
3.1 线性关系
多酚、FRAP、DPPH以及ABTS线性方程、相关系数和线性范围见表1。
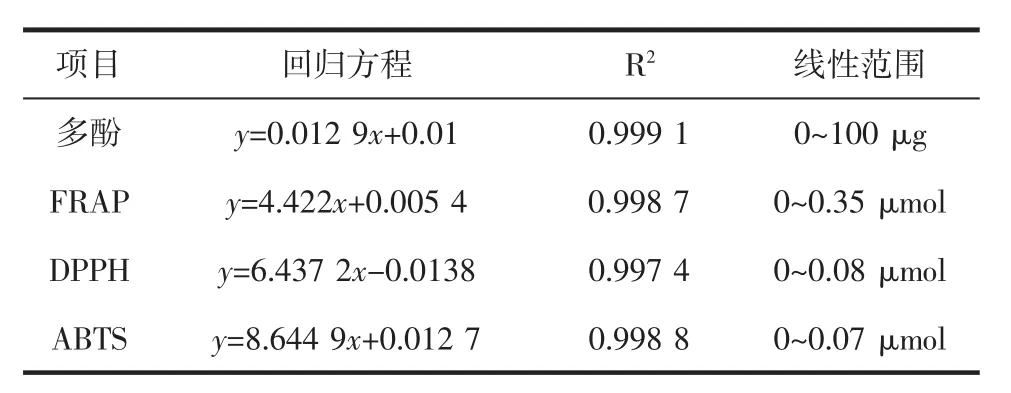
表1 多酚、FRAP、DPPH以及ABTS线性方程、相关系数和线性范围Table 1 Linear equations,correlation coefficients and linear ranges of polyphenol content,FRAP,DPPH and ABTS
从表1可以看出,在测定范围内多酚、FRAP、DPPH以及ABTS 4种测定方法具有很好的线性关系。
3.2 6种菊花中游离酚、酯化酚以及难溶性酚的含量
种菊花中游离酚、酯化酚以及难溶性酚的含量见表2。
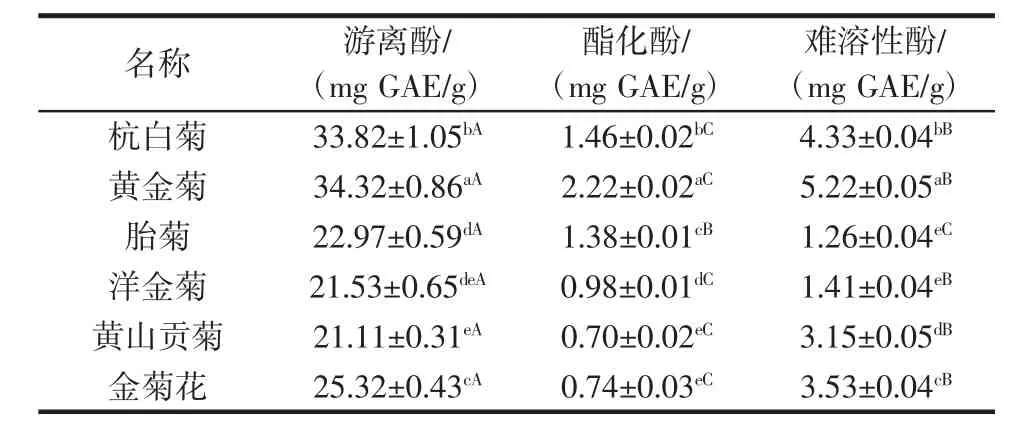
表2 6种菊花中游离酚、酯化酚以及难溶性酚的含量Table 2 The phenolic contents of free phenolics,esterified phenolics,and insoluble-bound phenolics from 6 kinds of chrysanthemums
从表2可知,6种菊花总酚含量差别较大,其中黄金菊的游离酚含量最高,其次是杭白菊、金菊花,而黄山贡菊的游离酚含量最低。黄金菊的酯化酚和难溶性酚含量也高于其他5种菊花。黄山贡菊的酯化酚酚含量最低,而胎菊的难溶性酚含量最低。6种菊花的游离酚含量均高于酯化酚和难溶性酚。杭白菊、黄金菊、洋金菊、黄山贡菊以及金菊花的难溶性酚含量高于酯化酚。Li等[18]研究发现,菊花游离酚含量高于难溶性酚。Xiong等[19]研究发现,杭白菊的游离酚含量高于难溶性酚,这与本研究的结果是一致的。而Kaisoon等[20]研究发现,珊瑚藤、叶子花、硫华菊、悬铃花、龙船花、荷花以及万寿菊的难溶性酚含量高于其游离酚。
3.3 游离酚、酯化酚以及难溶性酚的铁离子还原能力
游离酚、酯化酚以及难溶性酚的铁离子还原能力见表3。
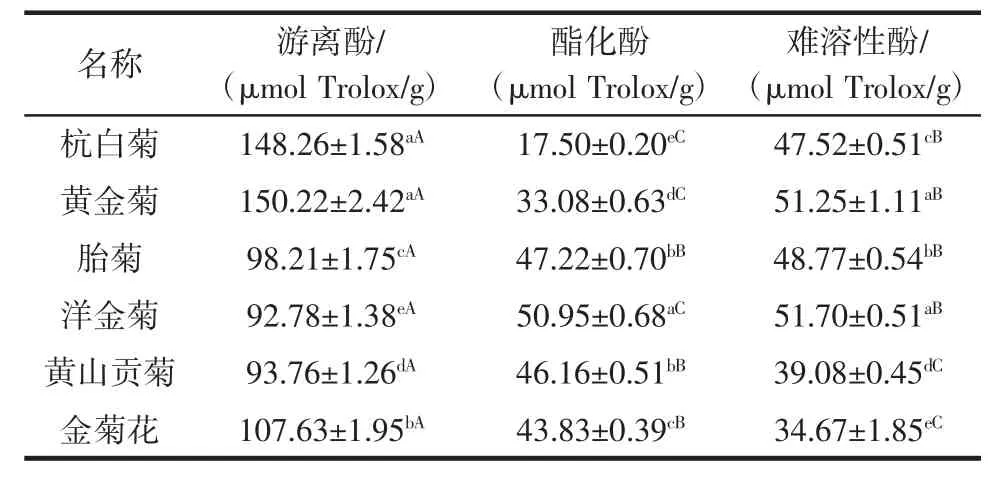
表3 6种菊花游离酚、酯化酚以及难溶性酚的铁离子还原能力Table 3 Ferric reducing antioxidant powers of free phenolics,esterified phenolics and insoluble-bound phenolics from 6 kinds of chrysanthemums
从表3可知,各种菊花的抗氧化能力均较强。就游离酚而言,黄金菊的FRAP值最高,其次是杭白菊、金菊花,而洋金菊的FRAP值最低;就酯化酚而言,洋金菊的FRAP值最高,杭白菊的FRAP值最低;而对难溶性酚的测定结果是,洋金菊的FRAP值最高,其次是黄金菊、胎菊,金菊花的FRAP值最低。在测定的6种菊花中,游离酚的抗氧化能力均高于酯化酚和难溶性酚;黄山贡菊和金菊花酯化酚的FRAP值高于难溶性酚。Li等[18]研究发现,菊花游离酚的铁离子还原能力高于难溶性酚;Xiong等[19]研究发现,杭白菊游离酚的铁离子还原能力高于难溶性酚,这与本研究的结果是一致的。而万寿菊游离酚的铁离子还原能力低于难溶性酚[20]。
3.4 游离酚、酯化酚以及难溶性酚的DPPH自由基清除能力
游离酚、酯化酚以及难溶性酚的DPPH自由基清除能力见表4。
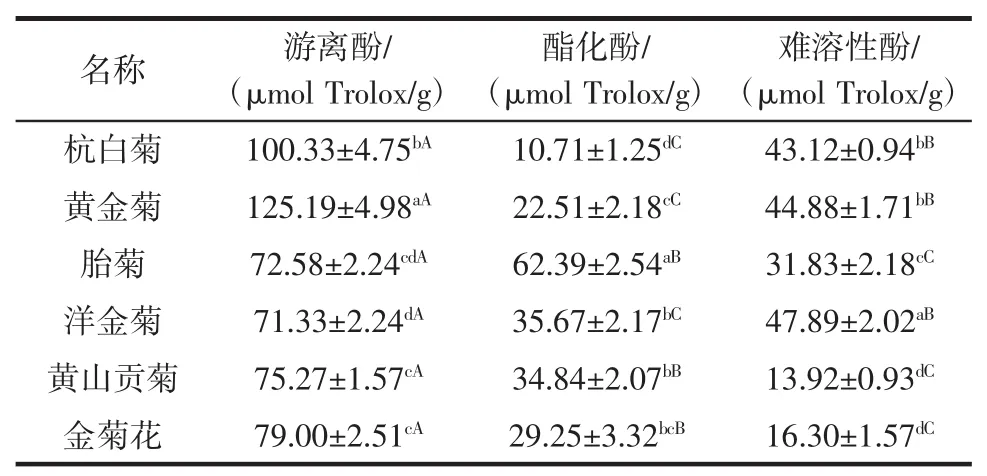
表4 6种菊花游离酚、酯化酚以及难溶性酚的DPPH自由基清除能力Table 4 DPPH radical scavenging activities of free phenolics,esterified phenolics and insoluble-bound phenolics from 6 kinds of chrysanthemums
从表4可知,各种菊花对DPPH自由基的清除能力均较强。就游离酚而言,黄金菊对DPPH自由基的清除能力最强,其他依次是杭白菊、金菊花、黄山贡菊,洋金菊对DPPH自由基的清除能力最弱;就酯化酚而言,胎菊对DPPH自由基的清除能力最强,其次是洋金菊和黄山贡菊;而对难溶性酚的测定结果是,洋金菊对DPPH自由基的清除能力最强,黄山贡菊对DPPH自由基的清除能力最弱。在测定的菊花中,游离酚对DPPH自由基的清除能力均高于酯化酚和难溶性酚;杭白菊、黄金菊以及洋金菊难溶性酚对DPPH自由基的清除能力均高于酯化酚。研究发现,万寿菊水溶性酚的DPPH自由基清除能力高于难溶性酚[20]。Wang等[21]研究发现,未经硫熏的菊花提取物有较高的DPPH自由基清除能力,其EC50值为0.079 mg/mL,而经硫熏后的菊花提取物对DPPH自由基的清除能力比未经硫熏的提取物低,其EC50值为0.085 mg/mL。菊花提取物还具有抗炎[22]、抗黑色素生成、抗氧化[23]以及抗糖尿病[24]等多种生物学活性。
3.5 游离酚、酯化酚以及难溶性酚的ABTS自由基清除能力
游离酚、酯化酚以及难溶性酚的ABTS自由基清除能力见表5。
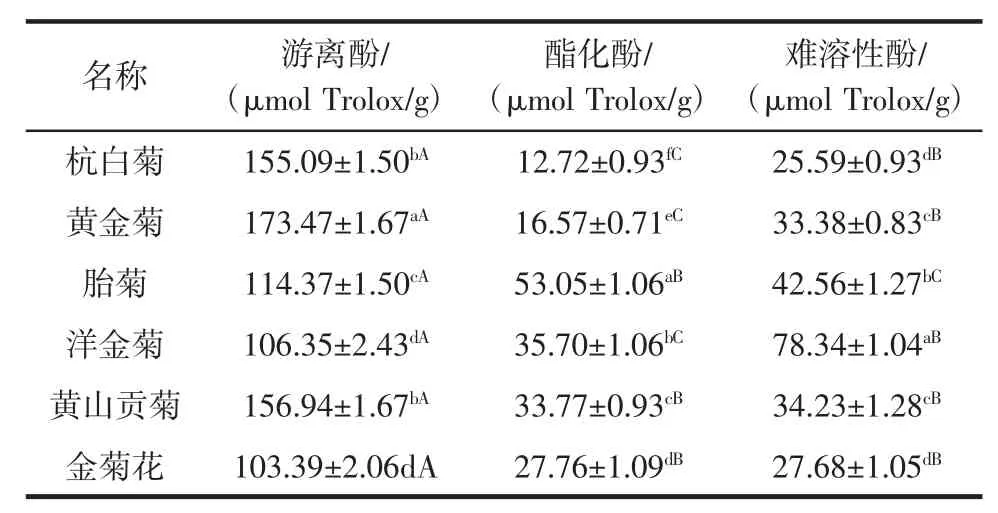
表5 6种菊花游离酚、酯化酚以及难溶性酚的ABTS自由基清除能力Table 5 ABTS radical cation scavenging activities of free phenolics,esterified phenolics and insoluble-bound phenolics from 6 kinds of chrysanthemums
从表5可知,各种菊花对ABTS自由基的清除能力均较强。就游离酚而言,黄金菊对ABTS自由基的清除能力最强,其他依次是黄山贡菊、杭白菊以及胎菊,金菊花对ABTS自由基的清除能力最弱;就酯化酚而言,胎菊对ABTS自由基的清除能力最强,其他依次是洋金菊、黄山贡菊以及金菊花,杭白菊对ABTS自由基的清除能力最弱;就难溶性酚而言,洋金菊对ABTS自由基的清除能力最强,杭白菊对ABTS自由基的清除能力最弱。在测定的6种菊花中,游离酚对ABTS自由基的清除能力均高于酯化酚和难溶性酚;杭白菊、黄金菊、洋金菊、黄山贡菊以及金菊花难溶性酚对ABTS自由基的清除能力均高于酯化酚。Li等[18]研究发现,菊花游离酚对ABTS自由基的清除能力高于难溶性酚,其游离酚和难溶性酚的ABTS值分别为8.11 μmol Trolox/g和0.12 μmol Trolox/g,低于本研究的6种菊花。Xiong等[19]研究发现,杭白菊游离酚对ABTS自由基的清除能力高于难溶性酚,但其难溶性酚对ABTS自由基的清除能力低于本研究的杭白菊。
4 结论
本研究采用DPPH、ABTS和FRAP 3种方法分别测定了6种菊花的抗氧化活性,并用Folin-Ciocalteu法测定其总酚含量。结果表明,6种菊花表现出不同的抗氧化活性,其中黄金菊的抗氧化活性最强,总酚含量也最高。
[1] 王珊.不同加工工艺对菊花提取物的抗氧化活性的影响[J].中南药学,2016,14(5):505-507
[2] 刘东顺,陈春林,车晓航,等.菊花、叶、茎抗氧化活性比较[J].中国实验方剂学杂志,2016,22(18):40-44
[3] 张健,李友宾,钱大玮,等.菊花化学成分及药理作用研究进展[J].时珍国医国药,2006,17(10):1941-1942
[4] 刘瑜新,常星,康文艺.两种开封产黄色菊花的体外抗氧化活性[J].食品工业科技,2009,30(12):85-87
[5] 王亚君,杨秀伟,郭巧生.黄菊花化学成分研究[J].中国中药杂志,2008,33(5):526-530
[6] 杨秀伟,邹磊,吴琦,等.芙蓉菊化学成分研究[J].中国中药杂志,2008,33(8):905-908
[7] 张健,钱大玮,李友宾,等.菊花的化学成分研究[J].天然产物研究与开发,2006,18(1):71-73
[8] 斯琴格日乐,恩德,李英杰.怀菊花总黄酮的提取工艺及其抗氧化活性[J].光谱实验室,2013,30(2):513-518
[9] 王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性测定[J].食品科学,2013,34(15):95-99
[10]张尔贤,方黎,张捷,等.菊花提取物的抗氧化活性研究[J].食品科学,2000,21(7):6-9
[11]黄波,张文鹏,郭腾,等.自来水冲泡贡菊花茶变色机理及抗氧化活性差异研究[J].现代食品科技,2009,25(9):1029-1031
[12]KRYGIER K,SOSULSKI F,HOGGE L.Free,esterified,and insoluble-bound phenolic acids.1.Extraction and purification procedure[J].J Agric Food Chem.,1982,30(2):330-334
[13]SINGLETON V L,ROSSI J A.Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents[J].Am J Enol Viticult,1965,16(3):144-158
[14]SONG F L,GAN R Y,ZHANG Y,et al.Total phenolic contents and antioxidant capacities of selected Chinese medicinal plants[J].Int J Mol Sci,2010,11(6):2362-2372
[15]OZGEN M,REESE R N,TULIO A Z,et al.Modified 2,2-Azinobis-3-ethylbenzothiazoline-6-sulfonic Acid (ABTS)Method to Measure Antioxidant Capacity of Selected Small Fruits and Comparison to Ferric Reducing Antioxidant Power (FRAP)and 2,2‘-Diphenyl-1-picrylhydrazyl(DPPH)Methods[J].J Agric Food Chem,2006,54(4):1151-1157
[16]BENZIE I F F,STRAIN J J.The Ferric Reducing Ability of Plasma(FRAP)as a Measure of“Antioxidant Power”:The FRAP Assay[J].Anal Biochem,1996,239(1):70-76
[17]CAI Y,SUN M,CORKE H.Antioxidant activity of betalains from plants of the amaranthaceae[J].J Agric Food Chem,2003,51(8):2288-2294
[18]LI A,LI S,LI H,et al.Total phenolic contents and antioxidant capacities of 51 edible and wild flowers[J].J Funct Foods,2014,6:319-330
[19]XIONG L,YANG J,JIANG Y,et al.Phenolic Compounds and Antioxidant Capacities of 10 Common Edible Flowers from China[J].J Food Sci,2014,79(4):C517-C525
[20]KAISOON O,SIRIAMORNPUN S,WEERAPREEYAKUL N,et al.Phenolic compounds and antioxidant activities of edible flowers from Thailand[J].J Funct Foods,2011,3(2):88-99
[21]WANG S,HAO L,ZHU J,et al.Study on the effects of sulfur fumigation on chemicalconstituentsand antioxidantactivity of Chrysanthemum morifolium cv.Hang-ju[J].Phytomedicine,2014,21(5):773-779
[22]TAO J,DUAN J,JIANG S,et al.Simultaneous determination of six short-chain fatty acids in colonic contents of colitis mice after oral administration of polysaccharides from Chrysanthemum morifolium Ramat by gas chromatography with flame ionization detector[J].J Chromatogr B,2016,1029–1030:88-94
[23]GUI M,DU J,GUO J,et al.Aqueous Extract of Chrysanthemum morifolium Enhances the Antimelanogenic and Antioxidative Activities of the Mixture of Soy Peptide and Collagen Peptide[J].J Tradit Complem Medicine,2014,4(3):171-176
[24]SHANG X,ZHU Z,WANG F,et al.Hypoglycemic effect of Chrysanthemum morifolium extract on alloxan-induced diabetic mice is associated with peroxisome proliferator-activated receptor α/γ-mediated hepatic glycogen synthesis[J].J Appl Biomed,2017,15(1):81-86
Antioxidant Activities and Total Phenolic Contents of Six Kinds of Chrysanthemum
YANG Lu-qi1,CHEN Guan-lin2,YU Jing1,WANG Yu-kun1,GAO Yong-qing1,FU Nan-lin3,*
(1.School of Food Science,Guangdong Pharmaceutical University,Zhongshan 528458,Guangdong,China;2.FoshanInstituteofOccupationalDiseasePreventionandControl,Foshan528000,Guangdong,China;3.TheFirstHospitalAffiliatedtoGuangdongPharmaceuticalUniversity,Guangzhou510008,Guangdong,China)
DPPH,ABTS and FRAP methods were used to determine the antioxidant activities of six kinds of chrysanthemum[Dendranthema morifolium(Ramat.)Tzvel],and Folin-Ciocalteu method was used to determine their total phenolic contents.Results indicated that six kinds of chrysanthemum were significant sources of an-tioxidants in terms of their total phenolic contents and antioxidant activities.In FRAP,DPPH and ABTS assays,chamomile (Perennial chamomile)exhibited the highest antioxidant activity with the values of 150.22,125.19 μmol Trolox/g and 173.47 μmol Trolox/g respectively.In addition,in Folin-Ciocalteu assay,chamomile exhibited the highest total phenolic content.
antioxidant activity;total phenolic content;chrysanthemum[Dendranthema morifolium(Ramat.)Tzvel
2016-12-26
10.3969/j.issn.1005-6521.2017.18.002
广东省医学科学技术研究基金项目(A2015617);中医药强省建设专项资金第二批名中医师承项目(粤中医办函[2015]93号)
杨璐齐(1992—),女(苗),在读硕士,研究方向:营养与食品安全。
*通信作者:傅南琳(1964—),女,主任医师,研究方向:中药天然产物与健康关系的研究。
