3种乳酸菌发酵提高黄浆水抗氧化能力的研究
2017-09-07孙晓琦周德庆王珊珊马玉洁朱兰兰赵峰
孙晓琦,周德庆,*,王珊珊,马玉洁,朱兰兰,赵峰
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.中国水产科学研究院黄海水产研究所食品工程与营养研究室,山东青岛266071)
3种乳酸菌发酵提高黄浆水抗氧化能力的研究
孙晓琦1,2,周德庆1,2,*,王珊珊2,马玉洁2,朱兰兰2,赵峰2
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.中国水产科学研究院黄海水产研究所食品工程与营养研究室,山东青岛266071)
选取植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)和清酒乳杆菌(Lactobacillus sakei)对黄浆水进行发酵,以酸度值、活菌数、DPPH自由基清除率、羟自由基清除率、ABTS自由基清除率及铁还原能力为指标,探究3种乳酸菌发酵黄浆水的可行性及对黄浆水抗氧化活性的影响,并测定其总酚和总黄酮含量。结果显示,3种乳酸菌均可在黄浆水中生长产酸,植物乳杆菌与嗜酸乳杆菌的产酸能力与活菌数显著高于清酒乳杆菌,3种菌株组合发酵时黄浆水的DPPH自由基清除率最高,且与发酵过程中总酚含量变化呈显著正相关。发酵后黄浆水提取物对DPPH自由基的清除率IC50值由3.51 mg/mL变为2.43 mg/mL,对羟自由基的清除率IC50值由3.58 mg/mL变为1.82 mg/mL,对ABTS自由基的清除率IC50值由0.90 mg/mL变为0.38 mg/mL,FRAP值由从1.24 mmol/L FeSO4升高到1.62 mmol/L FeSO4。
植物乳杆菌;清酒乳杆菌;嗜酸乳杆菌;黄浆水;抗氧化能力;总酚
黄浆水是豆腐在压榨成型时产生的乳清废水,据统计,每加工1 t大豆可排放2 t~5 t黄浆水,大部分作为废水被直接排放,浪费资源且污染环境[1]。黄浆水中含大豆异黄酮、皂苷、低聚糖、蛋白质及维生素等活性物质,是天然抗氧化剂的良好来源。目前我国对黄浆水中活性物质的利用主要集中在膜分离提取方面[2]。但此类方法需要特定的仪器设备,操作繁琐且经济成本高。因此,越来越多的研究将黄浆水的深加工手段聚焦到生物转化方面,以期降低加工成本,提高高值化利用程度。
乳酸菌发酵是一种高效、低耗、环保的生物转化技术,广泛应用于食品工业中。乔明武等用乳酸菌发酵黄浆水制备豆腐凝固剂[3]。Ounis等向黄浆水中添加蔗糖、酵母粉等物质,可作为植物乳杆菌的生长介质[4]。目前利用植物乳杆菌、清酒乳杆菌及嗜酸乳杆菌发酵黄浆水提高抗氧化活性的研究报道较少,本文探究这3种乳酸菌在黄浆水中的生长与产酸情况,并对发酵前后黄浆水的体外抗氧化能力进行了对比,以期为黄浆水高值化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黄浆水:三聚成有限公司豆制品生产厂;植物乳杆菌 CICC 20265(Lactobacillus plantarum)、嗜酸乳杆菌 CICC 22162(Lactobacillus acidophilus)、清酒乳杆菌CICC 6245(Lactobacillus sakei):中国工业微生物菌种保藏中心;总抗氧化能力检测试剂盒(ABTS法、FRAP法):南京建成生物工程研究所;MRS培养基:北京陆桥技术股份有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
DHP-9082电热恒温培养箱:上海一恒科学仪器有限公司;HCB-1300V垂直层流洁净工作台:青岛海尔医疗有限公司;UV1102Ⅱ紫外/可见分光光度计:上海天美科学仪器有限公司;Neofuge 15R高速冷冻离心机:力康生物医疗科技控股有限公司;FD5真空冷冻干燥机:金西盟公司。
1.3 方法
1.3.1 乳酸菌的培养[5]
将菌株置于MRS固体培养基上于37℃条件下活化培养20 h,再以10%接种量接种于MRS液体培养基,37℃培养20 h后,4 000 r/min离心5 min,用无菌生理盐水洗涤乳酸菌两次后制备菌悬液,使其浓度为108cfu/mL,发酵接种量以待接种的黄浆水体积计算。
1.3.2 黄浆水的发酵
向100 mL黄浆水中添加5%脱脂奶粉和5%蔗糖,混匀后于115℃条件下灭菌10 min,然后在无菌条件下分别接入1%活化后的植物乳杆菌、嗜酸乳杆菌和清酒乳杆菌,37℃恒温发酵。
1.3.3 乳酸菌活菌数的测定[6]
采用MRS培养基平板计数法测定乳酸菌活菌数。
1.3.4 酸度的测定
采用GB/T 5009.239-2016《食品安全国家标准食品酸度的测定》方法测定发酵液的酸度值,用涅尔度°T表示。
1.3.5 提取物的制备
分别取100 mL发酵前后的黄浆水,40℃下旋蒸浓缩至10 mL,加入100 mL 80%乙醇,超声辅助提取40 min后,离心(10 000 r/min,4℃,10 min)取上清液,40℃旋蒸浓缩后,真空冷冻干燥得到提取物,用80%乙醇配成不同浓度梯度的待测样品液,用于抗氧化性的测定。
1.3.6 总酚含量的测定[7]
准确移取1 mL样品提取液,依此加入2mL 1 mol/L Folin-Ciocalteu试剂,4 mL 12.5%Na2CO3溶液,混匀并定容至10 mL,30℃水浴30 min,于765 nm处测吸光值。其中,没食子酸为标准品,结果表示为每毫升样品中没食子酸当量(Gallic acid equivalent,GAE)的含量(μg GAE/mL)。
1.3.7 总黄酮含量的测定[8]
准确移取1 mL样品提取液,加入150 μL 5%NaNO2溶液,混匀,静置 6 min 后,加入 300 μL 10%AlCl3·6H2O 溶液,混匀,静置 6 min,然后加入 1 mL 1 mol/L NaOH溶液,用蒸馏水定容至3.5 mL,立即于765 nm处测吸光值。其中,(+)-儿茶素为标准品,结果表示为每毫升样品中儿茶素当量(Catechuic acid equivalent,CAE)的含量(μg CAE/mL)。
1.3.8 抗氧化性的测定
1.3.8.1 对DPPH自由基清除能力的测定[9]
取2 mL不同浓度梯度待测样品提取液,加入2 mL 0.2 mmol/L DPPH·乙醇溶液,混匀,避光静置30 min后于517 nm处测吸光值。
DPPH自由基清除率/%=[(1-(A样液-A空白)/A对照)]×100
式中:A样液为2 mL待测样液与等体积DPPH·乙醇溶液混合反应后的吸光值;A空白为2 mL待测样液与等体积无水乙醇混合后的吸光值;A对照为2 mL无水乙醇与等体积DPPH·乙醇溶液混合后的吸光值。
1.3.8.2 对羟自由基清除能力的测定[10]
取1 mL不同浓度的待测样品液,依次加入0.5 mL 2 mmol/L EDTA-Fe2+溶液、1 mL 20 mmol/L PBS(pH=7.4) 溶液、1 mL 360 μg/mL 番红花 T 溶液、1 mL 3%H2O2溶液,混匀,37℃水浴30 min,于520 nm处测吸光值。
羟自由基清除率/%=[(A样液-A空白)/(A对照-A空白)]×100
式中:A样液为待测样液吸光值;A空白为PBS代替样液做空白对照的吸光值;A对照为PBS代替样液和H2O2的吸光值。
1.3.8.3 对ABTS自由基清除能力的测定
使用A015-2试剂盒进行测定,具体操作方法与结果处理参见南京建成生物工程研究所相应说明书。
1.3.8.4 对铁还原能力的测定(Ferric Reducing/Antioxidant Power,FRAP)
使用A015-3试剂盒进行测定,利用标准溶液硫酸亚铁制作标准曲线,FRAP值以每升样品中含有的FeSO4当量表示(mmol/L FeSO4),其中得到的标准曲线为 y=0.406 7x-0.097 8(R2=0.999 2)。具体操作方法与结果处理参见南京建成生物工程研究所相应说明书。
1.4 统计分析
所有样品测试重复3次,测试结果以平均值±标准偏差的形式表示;使用SPSS 20.0软件进行数据处理。
2 结果与讨论
2.1 黄浆水发酵过程中酸度值和活菌数的变化
不同菌种发酵黄浆水过程中酸度值的变化见图1,不同菌种发酵黄浆水过程中活菌数的变化见图2。
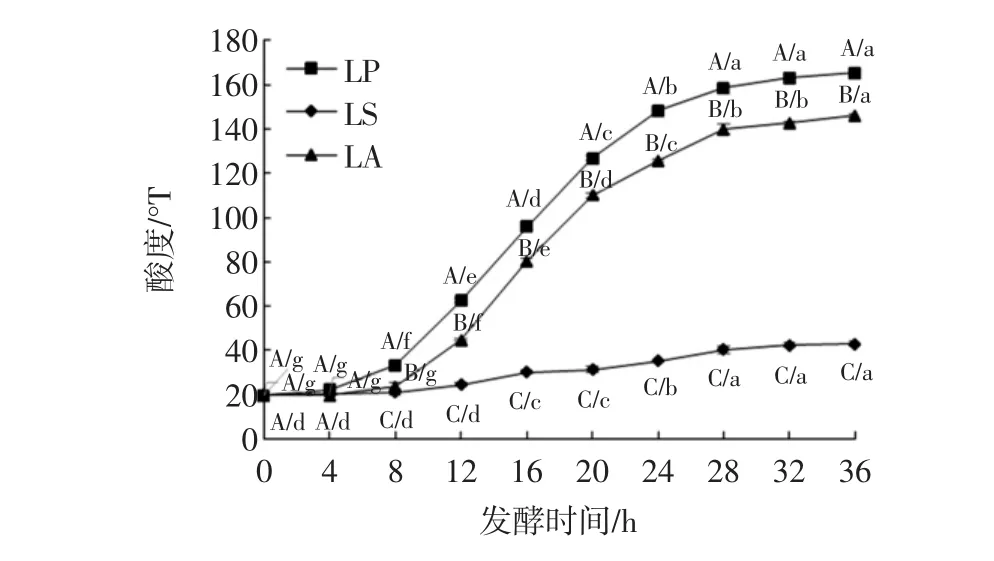
图1 不同菌种发酵黄浆水过程中酸度值的变化Fig.1 Changes of titratable acidity during the process of tofu whey fermented with different lactobacillus strains

图2 不同菌种发酵黄浆水过程中活菌数的变化Fig.2 Changes of viable count during the process of tofu whey fermented with different lactobacillus strains
由图1可知,从发酵4 h开始,植物乳杆菌和嗜酸乳杆菌的产酸能力随发酵时间的延长而快速增加,且这两株菌种在产酸能力上显著高于清酒乳杆菌。研究表明乳酸菌产酸量的升高与其自身新陈代谢和生长条件需要密不可分,产酸可迅速降低发酵液酸度值,从而有效抑制腐败菌及致病菌的生长及毒素的产生[11]。酸度值的变化与发酵液中活菌数的变化密切相关,从图2可知,3种乳酸菌均经过一个对数生长期后生长趋于平衡,在发酵24 h时,植物乳杆菌的活菌数含量最高为2.40×109cfu/mL,嗜酸乳杆菌为9.55×108cfu/mL,清酒乳杆菌为 2.57×108cfu/mL。Ghosh等研究表明只有当活菌数达到106cfu/mL及以上时,乳酸菌才具有益生活性,而更高的活菌数则有可能发挥更好的生物活性[12]。因此,选取24 h作为发酵时间,以探究发酵对黄浆水抗氧化活性的影响。
2.2 乳酸菌种类对发酵黄浆水抗氧化活性的影响
乳酸菌种类对发酵黄浆水DPPH自由基清除能力的影响见图3。
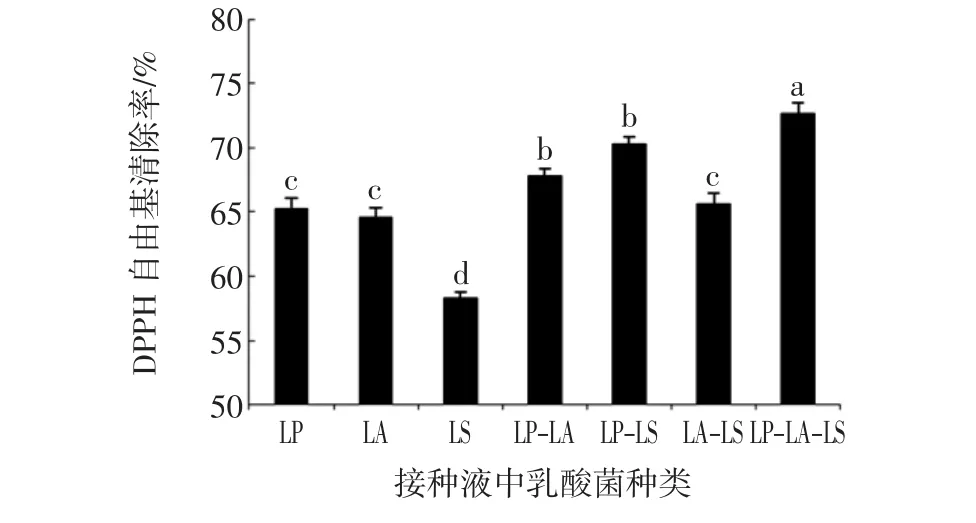
图3 乳酸菌种类对发酵黄浆水DPPH自由基清除能力的影响Fig.3 Changes in DPPH radical scavenging ability during the process of tofu whey fermented with different lactobacillus strains
由图3可得,乳酸菌种类对发酵黄浆水的体外抗氧化能力具有影响,多菌组合发酵表现出较好的互配协同作用,分别由植物乳杆菌与清酒乳杆菌、植物乳杆菌与嗜酸乳杆菌、植物乳杆菌与清酒乳杆菌与嗜酸乳杆菌组合发酵得到的黄浆水,其DPPH自由基清除能力要显著高于单一乳酸菌发酵所得黄浆水。其中,由植物乳杆菌、嗜酸乳杆菌和清酒乳杆菌按照1∶1∶1的体积比接种发酵的黄浆水DPPH自由基清除能力最高(P<0.05),是可利用的黄浆水发酵剂组合,后续实验中采用此配比进行接种发酵。
2.3 发酵过程中总酚含量与抗氧化活性的变化
发酵期间黄浆水中总酚、总黄酮含量及DPPH自由基清除能力的变化见表1。

表1 发酵期间黄浆水中总酚、总黄酮含量及DPPH自由基清除能力的变化Table 1 Changes of total phenolics content,total flavonoids content and DPPH radical scavenging activity during the fermentation process of tofu whey
如表1所示,发酵期间黄浆水中的总酚含量逐渐增加,到第36小时最高达到216.65 μg GAE/mL,随后呈现下降趋势。发酵前36小时黄浆水中的总黄酮含量无明显变化,到第48小时有所下降后趋于稳定。Chu等研究发现发酵过程中复杂的大分子酚类物质会转换为小分子游离酚类物质[13],从而使测得的总酚含量增大;但随着发酵时间的延长,过高浓度的酚类会抑制乳酸菌生长,因此乳酸菌会降解这部分酚类,继而造成总酚含量的降低。与此同时,黄浆水的DPPH自由基清除能力也呈现先升高后下降的趋势,第36小时的DPPH自由基清除率最高达到74.32%。黄浆水在发酵期间的总酚含量与DPPH自由基清除能力呈现相关性(r=0.781,P<0.05)。
2.4 发酵后黄浆水抗氧化活性的测定
发酵对黄浆水提取物DPPH自由基清除能力的影响见图4,发酵对黄浆水提取物羟自由基清除能力的影响见图5,发酵对黄浆水提取物ABTS自由基清除能力的影响见图6,发酵对黄浆水提取物铁还原能力的影响见图7,发酵前后黄浆水提取物抗氧化能力测定结果见表2。

图4 发酵前后黄浆水提取物的DPPH自由基清除能力Fig.4 DPPH radical scavenging activity of extracts from fermented and unfermented tofu whey
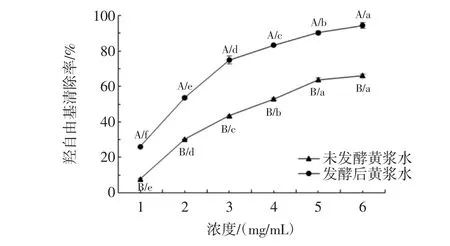
图5 发酵前后黄浆水提取物的羟自由基清除能力Fig.5 Hydroxyl radical scavenging activity of extracts from fermented and unfermented tofu whey
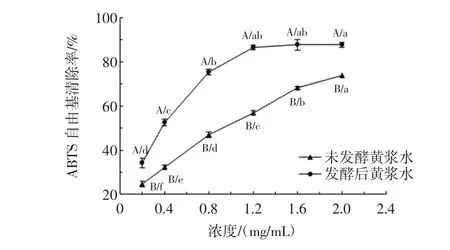
图6 发酵前后黄浆水提取物的ABTS自由基清除能力的影响Fig.6 ABTS radical scavenging activity of extracts from fermented and unfermented tofu whey
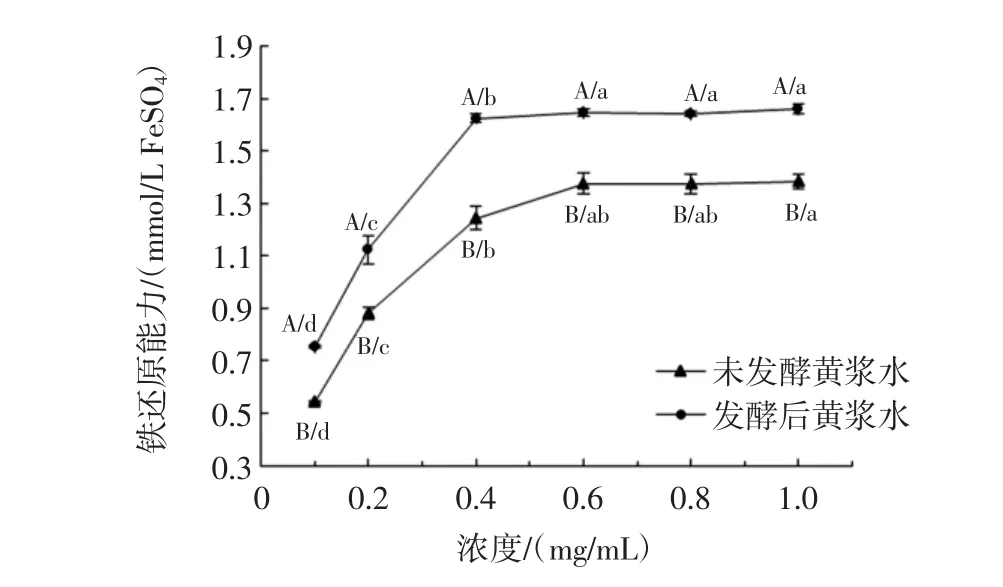
图7 发酵前后黄浆水提取物的铁还原能力Fig.7 Ferric reducing antioxidant power of extracts from fermented and unfermented tofu whey
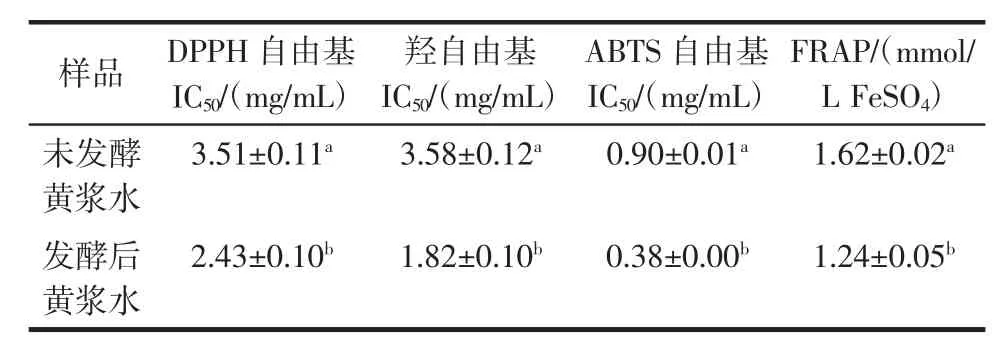
表2 发酵前后黄浆水提取物抗氧化能力测定结果Table 2 Antioxidant activity of extracts from fermented and unfermented tofu whey
图4至图7通过4种不同的抗氧化体系来反映发酵对黄浆水抗氧化能力的影响,均呈现出一定的量效关系。由图4可得,发酵可显著提高黄浆水DPPH自由基清除能力,发酵后黄浆水清除DPPH自由基的IC50值为2.43 mg/mL,明显低于未发酵黄浆水的3.51 mg/mL(P<0.05)(表2)。发酵过程中黄浆水的DPPH自由基清除能力与总酚含量的变化呈显著正相关(表1)。Shahidi等研究认为酚类物质易于给出H+,H+可与DPPH自由基发生共振杂化形成稳定产物[14]。
图5显示了发酵前后黄浆水的羟自由基清除能力变化。当浓度为6 mg/mL时,发酵后黄浆水的羟自由基清除率达到94.37%,显著高于未发酵黄浆水(63.73%)(P<0.05)。发酵前后黄浆水清除羟自由基的IC50值由3.58 mg/mL变为1.82 mg/mL(表2)。与DPPH自由基清除能力相比,发酵对羟自由基清除能力的提升效果相对更佳。Chandrasekara等研究发现酚类物质能够有效的直接清除羟自由基,同时可通过螯合亚铁离子以间接阻止羟自由基的产生[15]。发酵24 h后黄浆水中总酚含量显著增高(表1),使羟自由基清除率大幅提高。
发酵前后黄浆水的ABTS自由基清除能力如图6所示,当浓度在0.2 mg/mL~1.2 mg/mL时,发酵后黄浆水的ABTS自由基清除率从34.19%迅速上升到86.49%,之后随着浓度的增加清除率趋于平缓;未发酵黄浆水的ABTS自由基清除率则在2.0 mg/mL时达到73.76%。发酵后黄浆水清除ABTS自由基的IC50值要低于未发酵黄浆水近2.4倍(表2),因此发酵对ABTS自由基清除能力的影响效果最强。ABTS自由基清除能力的提高可能与发酵过程中异黄酮结构的改变及总酚含量的增高相关。
从图7可知,发酵对黄浆水FRAP的增强有明显促进作用。当浓度在0.4 mg/mL时,发酵前后黄浆水的FRAP值分别为1.24 mmol/L FeSO4与1.62 mmol/L FeSO4(表2)。Vadivel等研究认为酚类物质的存在有利于TPTZ-Fe3+还原为TPTZ-Fe2+,从而提高了铁还原能力[16]。
3 结论
本文通过3种乳酸菌组合发酵黄浆水,研究了发酵前后黄浆水抗氧化性能的变化。结果表明,植物乳杆菌、清酒乳杆菌及嗜酸乳杆菌均能在黄浆水中生长产酸,植物乳杆菌与嗜酸乳杆菌的产酸能力与活菌数高于清酒乳杆菌。3种乳酸菌组合发酵后黄浆水DPPH自由基、ABTS自由基、羟自由基清除能力以及铁还原能力得到了显著提高。此外,发酵有效提高了黄浆水中总酚含量。本研究表明乳酸菌发酵是改善黄浆水生理活性的有效方法,为开发利用黄浆水制成的功能性饮品提供理论指导。
[1] 仇农学.大豆制品加工技术[M].北京:中国轻工业出版社,2000:42-64
[2] 赵冬梅,刘凌,张京健.黄浆水中功能性成分和主要污染物在组合膜分离中的再分布[J].食品与发酵工业,2006,32(5):134-137
[3] 乔明武,田洁,赵秋艳,等.用响应曲面法优化发酵黄浆水制备豆腐凝固剂的工艺[J].江西农业学报,2014,26(3):85-89,100
[4] Ounis W B,Champagne C P,Makhlouf J,et al.Utilization of tofu whey pre-treated by electromembrane process as a growth medium for Lactobacillus plantarum LB17[J].Desalination,2008,229(1):192-203
[5] Pandey S M,Mishra H N.Optimization of the prebiotic&probiotic concentration and incubation temperature for the preparation of synbiotic soy yoghurt using response surface methodology[J].LWTFood Science and Technology,2015,62(1):458-467
[6] 纪铁鹏,崔雨荣.乳品微生物学[M].北京:中国轻工业出版社,2007
[7] Xu B J,Chang S K C.A comparative study on phenolic profiles andantioxidant activities of legumes as affected by extraction solvents[J].Journal of Food Science,2007,72(2):159-166
[8] Dewanto V,Wu X,Adom K K,et al.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J].Journal of Agricultural&Food Chemistry,2002,50(10):3010-3014
[9] Chen Y,Wang M,Rosen R T,et al.2,2-Diphenyl-1-picrylhydrazyl radical-scavenging active components from Polygonum multiflorum thunb[J].Journal of Agricultural&Food Chemistry,1999,47(6):2226-2228
[10]You L,Zhao M,Liu R H,et al.Antioxidant and Antiproliferative Activities of Loach(Misgurnus anguillicaudatus)Peptides Prepared by Papain Digestion[J].Journal of Agricultural&Food Chemistry,2011,59(14):7948-7953
[11]余焕玲,晏萍.乳酸菌的生理功能及在食品中的应用[J].饮料工业,2000,3(4):10-13
[12]Ghosh D,Chattoraj D K,Chattopadhyay P.Studies on changes in microstructure and proteolysis in cow and soy milk curd during fermentation using lactic cultures for improving protein bioavailability[J].Journal of Food Science and Technology,2013,50(5):979-985
[13]Chu S C,Chen C.Effects of origins and fermentation time on the antioxidant activities of kombucha[J].Food Chemistry,2006,98(3):502-507
[14]Shahidi F,Alasalvar C,Liyana-Pathirana C M.Antioxidant phytochemicals in hazelnut kernel(Corylus avellana L.)and hazelnut byproducts[J].Journal of Agricultural&Food Chemistry,2007,55(4):1212-1220
[15]Chandrasekara A,Shahidi F.Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulated in vitro digestion and microbial fermentation[J].Journal of Functional Foods,2012,4(1):226-237
[16]Vadivel V,Stuetz W,Scherbaum V,et al.Total free phenolic content and health relevant functionality of Indian wild legume grains:Effect of indigenous processing methods[J].Journal of Food Composition&Analysis,2011,24(24):935-943
Study on Enhancement of Antioxidant Activity of Tofu Whey by Fermentation with Three Species of Lactobacillus
SUN Xiao-qi1,2,ZHOU De-qing1,2,*,WANG Shan-shan2,MA Yu-jie2,ZHU Lan-lan2,ZHAO Feng2
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,Shandong,China;2.Food Engineering and Nutrition Lab,Yellow Sea Fishery Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,Shandong,China)
Fermentation of tofu whey was assayed using Lactobacillus plantarum,Lactobacillus acidophilus and Lactobacillus sakei in order to find out the feasibility of Lactobacillus fermentation and the changes of antioxidant activity.The titratable acidity,viable counts,DPPH radical scavenging activity,hydroxyl radical scavenging activity,ABTS scavenging activity and ferric reducing power were measured,while the content of total phenolics and flavonoids was determined.Results showed that all three Lactobacillus were able to grow and produce acid in tofu whey,the titratable acidity and viable counts of tofu whey fermented by Lactobacillus plantarum and Lactobacillus acidophilus were significantly higher than that of Lactobacillus sakei.The DPPH radical scavenging activity of tofu whey was the highest after combined fermentation with three Lactobacillus,which had a significant positively correlation with the content of total phenolics.After the fermentation,IC50of DPPH radical scavenging activity was changed from 3.51 mg/mL to 2.43 mg/mL,IC50of hydroxyl radical scavenging activity was changed from 3.58 mg/mL to 1.82 mg/mL,IC50of ABTS radical scavenging activity was changed from 0.90 mg/mL to 0.38 mg/mL,FRAP value was increased from 1.24 mmol/L FeSO4to 1.62 mmol/L FeSO4.
Lactobacillusplantarum;Lactobacillussakei;Lactobacillusacidophilus;tofu whey;antioxidant activity;total phenolics
2016-12-28
10.3969/j.issn.1005-6521.2017.18.001
国家科技支撑计划项目(2015BAD7B01)
孙晓琦(1992—),女(汉),在读硕士,研究方向:功能食品研发。
*通信作者:周德庆(1962—),男(汉),研究员,博士。
