葛花枳椇子配伍使用对醉酒小鼠体内乙醇代谢过程的影响
2017-09-04李怡文柳海艳薛文鑫李慧云
李怡文 刘 阳 柳海艳 薛文鑫 李慧云 李 静
(1 煤炭总医院药学部,北京,100028; 2 北京中医药大学基础医学院,北京,100029)
葛花枳椇子配伍使用对醉酒小鼠体内乙醇代谢过程的影响
李怡文1刘 阳1柳海艳2薛文鑫1李慧云1李 静1
(1 煤炭总医院药学部,北京,100028; 2 北京中医药大学基础医学院,北京,100029)
目的:通过检测急性乙醇中毒小鼠体内乙醇浓度、乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)的在不同时间的变化水平,探讨葛花枳椇子配伍应用是否优于单独使用。方法:将ICR小鼠分为空白组、模型组、阳性药组、单用葛花、枳椇子组及配伍1、2、3组。选取预防给药的方法,即给药30 min后灌酒复制模型,分别于酒后0.5 h,1 h,2 h,3 h摘眼球取血及肝脏组织。酶法测定酒后不同时间点小鼠血中乙醇浓度、肝中ADH和ALDH水平。结果:醉酒小鼠血中乙醇浓度在2 h达到峰值,葛花、枳椇子配伍1、2、3组小鼠体内乙醇浓度均较模型组显著降低(P<0.05);小鼠肝脏中ADH水平在1 h达峰,配伍2、3组可显著升高小鼠酒后1 h肝脏中ADH的水平(P<0.05),在2 h、3 h后,只有配伍3组效用较为明显(P<0.05);小鼠肝脏中ALDH水平在2 h到达峰值,配伍3组可显著增加其水平,其余各组有增加的趋势但差异无统计学意义。结论:葛花、枳椇子配伍使用效果优于单独应用,可降低酒后不同时间点小鼠血中乙醇浓度,其机制可能与激活肝脏中ADH与ALDH活性有关,从而起到预防醉酒的作用。
葛花;枳椇子;配伍;乙醇浓度;乙醇脱氢酶
近年来,随着经济繁荣及人际交往增多,急性乙醇中毒发生率也与日俱增。在酒文化历史悠久的中国,中医典籍中关于大量饮酒致病的记载不胜枚举,如《华佗神医秘传》将其称为“酒毒”。《诸病源候论》一书首次提出“酒癖”病名,指出其病机是由于“气瘀胁肋,结聚成癖”所致。大量饮酒可导致躯体、心理、社会多方面的严重损害,尤其是对消化系统、神经系统损害更为明显[1]请全文规范参考文献标注。因此在主观意识控制下,如何借助药物有效防治一些无法避免的乙醇摄入,已成为医疗行业及从业者的难题之一[2]。近年来,随着对传统中医药的深入研究,逐渐认识到传统医学在防治乙醇中毒方面有一定的优势。葛花、枳椇子在古代文献中被视为解酒功效显著的传统药对,各代医家善将此药视为君药,佐以其他药物治疗各种酒病。《本草拾遗》中记载葛花辛甘无毒,能“解酒毒,身热赤……小便赤涩”;《本草纲目》有言:“枳椇子,气味甘平,能止渴除烦,润五脏……解酒毒”。药王孙思邈曾用“园中生枳椇,家中无醉人”来高度评价该药味解酒毒之力强,现代研究表明葛花与枳椇子中的黄酮、异黄酮能明显加快体内的乙醇代谢,减轻乙醇对肝细胞的氧化损伤等[3-4]。
课题组前期研究结果表明,葛花、枳椇子不同比例配伍,无论是醇提还是水提,对于慢性乙醇性肝损伤大鼠均具有较好的防治作用,其中以葛花、枳椇子2:1比例配伍时对肝损伤大鼠效果更为明显[5]。对于急性乙醇中毒小鼠,葛花和枳椇子也具有预防醉酒和保护肝脏的作用[6-7]。但两药可否配伍用于急性乙醇中毒小鼠以及配伍使用是否优于单用两味中药还不得而知。因此,本实验在前期实验的基础上,通过检测小鼠体内的乙醇浓度、肝脏中ADH与ALDH含量探讨两味传统中药配伍使用的可能性,以期为临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 ICR小鼠210只,体重18~20 g,购于北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2014-0001,适应性喂养一周。
1.1.2 药物 葛花为豆科植物野葛Pueraria lobata(Willd.)Ohwi、甘葛藤P.thomsonii Benth.的花;枳椇子为鼠李科植物枳椇(Hovenia Dulcis Thunb)的干燥成熟带肉质果柄的果实或种子。购于河北安国药材批发市场。
葛花提取物:取药材葛花水中浸泡2 h,分2次提取,以10倍量水煎煮2 h后,倾出煎液后加入8倍量再煎煮1 h。浓缩后配置成含生药0.4 g/mL溶液待用。枳椇子同葛花溶液配制。混合液提取物:按不同比例(枳椇子∶葛花=1∶1和1∶2和2∶1)。取按比例配好的药材水中浸泡2 h,提取方法同前。滤过,浓缩至相对密度为1.05,使用前加蒸馏水配制成所需浓度。
阳性药制备:东宝甘泰片,生产企业:吉林通化东宝药业股份有限公司。用蒸馏水和0.5%CMC配成浓度为0.036 g/mL的溶液。
1.1.3 试剂与仪器 试剂:56°红星二锅头(北京红星酿酒股份有限公司),用于模型复制;注射用生理盐水(大冢制药有限公司,生产批号H10987054);无水乙醇(北京化工厂,生产批号:20140810);医用级肝素钠(常州千红生化制药股份有限公司,生产批号:20130704);盐酸氨基脲(北京化学试剂公司,生产批号:20130529);甘氨酸(北京东胜泰博科技有限公司);高氯酸(北京化工厂生产);乙醇脱氢酶(ADH)测定试剂盒(南京建成科技有限公司生产,生产批号:20150808);乙醛脱氢酶(ALDH)测定试剂盒(南京建成科技有限公司生产,生产批号:20140507);乙醇脱氢酶(SIGMA公司进口);氧化型辅酶Ⅰ(SIGMA公司进口)。
仪器:电子分析天平:型号为AEL-160,日本产;台式高速冷冻离心机:离心机,雷勃尔,LD5-2B0074NL0031;快速混匀器:型号为SK-1,江苏国华仪器厂;微量移液器:北京青云航空仪表有限公司;752-紫外光栅分光光度计:上海第三分析仪器厂;
1.2 方法
1.2.1 分组与模型制备 ICR小鼠按照时间点,将动物分为4批,每组49只,即酒后0.5 h组、1 h组、2 h组、3 h组。各时间点按受试药物不同分为模型组、阳性药组、葛花组、枳椇子组、配伍1、2、3组。
1.2.2 给药方法 空白组与模型组给予等量生理盐水,阳性对照药灌服东宝甘泰,其余各组按0.1 mL/10 g体重灌服煎煮制备好的药液。0.5 h后,除空白组外,其余各组小鼠按分别按0.15 mL/10 g灌胃给予二锅头酒。按动物分组方法,小鼠分别于酒后0.5 h、1 h、2 h、3 h行摘眼球取血。
1.2.3 检测指标与方法
1.2.3.1 制作乙醇标准曲线 1)小鼠乙醚麻醉摘眼球取血,滴入预处理的试管内(50 μL肝素钠抗凝)。移液枪从每管中取0.25 mL样本,加入到离心管中待测,除“0”号管为不含乙醇的对照管外,1、2、3、4、5管的乙醇浓度分别为25、50、75、100、150 mg/dL。2)标准液制备:以上样本均加入3.4%高氯酸4 mL,吹匀,3 000 r/min离心5 min,取上清即可。3)向上述六只待测管内分别加入乙醇脱氢酶(ADH)-氧化型烟酰胺腺嘌呤二核苷酸(NAD)液4.9 mL;“0”号管加入0.1 mL蒸馏水为对照品,其余5只各加0.1 mL标准液,室温静置60 min。4)标准曲线:选取1 cm比色杯,加入各管中待测样本,应用752-C紫外-可见分光光度计于340 nm处测定吸光度,详见图1。回归方程为C=1 179.2A-10.644;r=0.997 8。
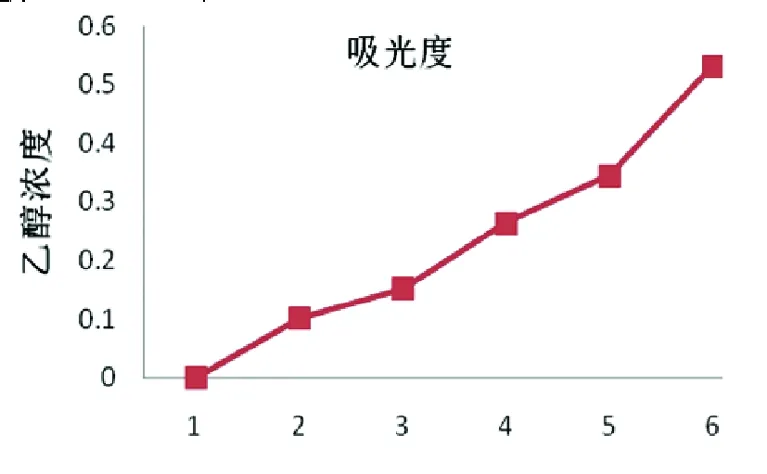
图1 乙醇标准曲线
1.2.3.2 各个给药组小鼠血液中乙醇含量 小鼠摘眼球取血,滴入事先用肝素钠抗凝的试管中。从抗凝管中取出0.25 mL样本,加生理盐水0.75 mL,其余步骤同1.4.1。根据吸光度值,通过标准曲线求出各样品的乙醇含量(mg/dL)。
1.2.3.3 各个给药组小鼠肝脏中ADH与ALDH含量水平 以上各组小鼠摘眼球取血后,于冰浴上取出同一部位肝组织(左叶),滤纸吸净后用玻璃匀浆器制备匀浆,高速离心机4 ℃,3 000 r/min,5 min,取上清待测。空白管加蒸馏水0.2 mL,1 cm比色杯内加0.0021 mol NAD 2.8 mL,混匀后在340 nm调0和100;样品管加0.3 mol乙醇和上清液各0.1 mL,观测其5 min内吸收度的变化率△A/min,并计算ADH和ALDH活性。
计算公式为:
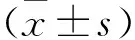
2 结果
2.1 单用及不同比例配伍对醉酒小鼠血中乙醇浓度的影响 采用预防给药的方法进行试验,结果表明,白酒灌胃0.5 h后,模型组小鼠血液中乙醇浓度显著升高,配伍1、3组能显著降低小鼠血液中乙醇浓度(P<0.05),其余各组有降低的趋势(P>0.05)。
白酒灌胃1 h后,小鼠血液中乙醇浓度持续升高,阳性药组、配伍3组能显著降低小鼠血液中乙醇浓度(P<0.05,P<0.01),其余各组有降低的趋势。
白酒灌胃2 h后,小鼠血液中乙醇浓度到峰,3小时后各组均有回落。在这2个时间点,阳性药组、配伍1、2、3组小鼠血液中乙醇浓度均较模型组显著下降(P<0.05,P<0.01)。
2.1 单用及不同比例配伍对醉酒小鼠肝中ADH活性的影响 酒后0.5 h,模型组及各个给药组小鼠肝脏中ADH值较空白组显著升高(P<0.05),表明模型复制成功;与模型组比较,除阳性药组能显著升高小鼠肝脏中ADH水平(P<0.05)其余各给药组只有升高该酶的趋势(P>0.05)。
酒后1 h,模型组与各个给药组小鼠肝脏中的ADH到达峰值,与模型组比较,阳性药物组、配伍2、3组小鼠肝脏中ADH水平显著升高(P<0.05)。
酒后2 h,模型组与各个给药组小鼠肝脏中的ADH开始回落,阳性药组、葛花组、配伍3组小鼠肝脏中ADH水平还保持较高浓度,与模型组差异有统计学意义。
酒后3 h,模型组与各个给药组小鼠肝脏中的ADH降至低点,唯有配伍3组较模型组小鼠肝脏中ADH浓度显著升高(P<0.05)。
该数据与小鼠血液中的乙醇浓度的变化趋势相吻合,1~1.5 h激活体内ADH酶活性,但发挥解酒作用还需一定时间,因此在2 h检测小鼠血液中乙醇浓度是出于最高点,而后慢慢回落的过程。肝中ADH活性与乙醇在体内的代谢有着必然联系,该酶活性升高这可能是降低血中乙醇浓度的原因之一。见表2。
2.3 单用及不同比例配伍对醉酒小鼠肝中ALDH活性的影响 酒后0.5 h,除配伍2组,其余各组小鼠肝脏中ALDH值均较空白组显著升高(P<0.05),表明模型复制成功;与模型组比较,各组有升高小鼠肝脏中ALDH水平的趋势,但差异无统计学意义(P>0.05)。
酒后1 h,有升高小鼠肝脏中ALDH水平的趋势,但无统计学意义(P>0.05)。
酒后2 h,模型组与各个给药组小鼠肝脏中的ALDH水平到达峰值,与模型组比较,阳性药物组与配伍3组升高小鼠肝脏中ALDH水平的作用较为明显(P<0.05)。
酒后3 h,各组小鼠肝脏中的ALDH浓度开始回落,组间差异无统计学意义(P>0.05)。
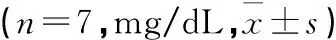
表1 单用及不同比例配伍对醉酒小鼠血中乙醇浓度的影响
注:*P<0.05;**P<0.01
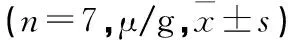
表2 不同组别对急性乙醇中毒小鼠肝中ADH活性的影响
注:*P<0.05;**P<0.01;△P<0.05;△△P<0.01

表3 单用及不同比例配伍对醉酒小鼠肝中ALDH活性的影响
注:*P<0.05;**P<0.01;△P<0.05;△△P<0.01
该数据与小鼠肝脏中实测乙醇脱氢酶的变化趋势有一定的吻合之处,但葛花与枳椇子及其不同配伍组合对于乙醛脱氢酶的改善作用不及对乙醇脱氢酶的变化明显。见表3。
3 结论
检测小鼠血中乙醇浓度一方面可以反应体内乙醇脱氢酶的活性,另一方面也可以反应肝损伤的程度。对于基础研究常选用化学法、酶法、直接气相色谱法、顶空气相色谱法等进行检测。Cope采用了热解吸毛细管气相色谱法来检测小鼠内源性乙醇浓度,此法具有样品用量少、灵敏度高等特点[8],但对于样本纯度与数量有着较高要求,大样本测试不宜选用[9];酶法其灵敏度较气相色谱法稍差,但特异性强。结合实验室条件,考虑到实验样本较多,故采用酶法对小鼠血中乙醇浓度进行测定。
人体对乙醇的代谢速率因人而异,其中胃的排空速率是其决定因素。乙醇经胃排空到达肝脏,其中80%~90%在肝脏内代谢,2%~10%由肾脏和肺脏排泄。肝是乙醇代谢最主要的器官,含有3种可以氧化乙醇的重要酶系:即ADH、微粒体乙醇氧化酶系和过氧化物。乙醇的代谢可分为3步:1)80%的乙醇经肝中的乙醇脱氢酶催化使乙醇氧化成乙醛,此反应为可逆反应。2)经乙醛脱氢酶的催化,乙醛氧化成乙酸,进入三羧酸循环,此反应不可逆。3)乙酸从肝脏进入血液循环并激活乙酰辅酶A。有文献表明,空腹饮酒后,乙醇可在30~90 min完全吸收入血,达到峰值[10]。本实验结果提示,葛花枳椇子配伍1、2、3组均可降低酒后2 h的血中乙醇浓度,与文献报道基本吻合[11]。
一次性大量饮酒可造成急性乙醇中毒,乙醇进入人体以后,三大酶系立即启动。乙醇氧化途径或过氧化氢途径代谢会产生大量的乙醛和自由基,对人体造成损害。尤其是当人体一次性大量摄入乙醇,导致乙醇脱氢酶活性降低时,乙醇就会通过另外2个途径代谢。正常情况下,ADH与ALDH在肝脏中含量最高,有当肝细胞受损时,ADH与ALDH由肝细胞内释放入血,从而引起ADH与ALDH含量升高,所以检测ADH与ALDH活性是诊断某些肝脏疾病的指标之一。本实验采取测定单位时间内生成的NADH引起的吸收度变化率的方法,测定ADH与ALDH活性的变化,试图阐述葛花与枳椇子这2种药物对乙醇的代谢与这2种酶是否相关[12]。
基于本实验结果,小鼠酒后肝中ADH与ALDH活性的改变规律,可看出酒后1~2 h内,肝中ADH活性增强,随之血中乙醇浓度的增高,酒后1 h,乙醇脱氢酶及乙醛脱氢酶的肝脏中的含量显著上升,乙醇脱氢酶于1 h达峰,乙醛脱氢酶于1.5 h达峰,而后开始下降,与小鼠血中乙醇浓度达峰值时间基本吻合。葛花枳椇子单用及配伍的各个组药效也不尽相同,各个给药组对肝中ADH含量的影响较ALDH含量明显。提示该药对配伍发挥作用主要是在乙醇的吸收阶段,而对于乙醇分解代谢阶段,作用不甚明显。
本实验在前期实验的基础上[13-14],从传统解救药对葛花枳椇子配伍角度出发,通过对急性乙醇中毒小鼠体内乙醇浓度、ADH与ALDH含量变化提示配伍使用比单用一种药物预防醉酒效果更佳,为临床应用葛花、枳椇子这一传统解酒药对防治急性乙醇中毒提供依据,为传统中药的成果转化提供数据支持。
[1]Hazeldine S,Hydes T.Sheron N Alcoholic liver disease-the extent of the problem and what you can do about it[J].Clin Med,2015,15(2):179-85.
[2]Cohen JI,Nagy LE.Pathogenesis of Mcohohc liver disease:interactions between parenchymal and nonparenchymal cells[J].J DigDis,2011,12(1):3.
[3]张永昕,俞发.枳椇子总黄酮治疗酒精性肝病及其作用机制研究[J].中药材,2010,33(10):1782-1785.
[4]宋莎莎,何伟,袁平凡,等.复方枳椇子制剂对乙醇所致小鼠肝损伤的保护作用[J].安徽医药,2013,17(6):923-925.
[5]柳海艳.葛花枳椇子配伍对酒精性肝损伤的防治作用及机理探讨[D].北京:北京中医药大学,2011.
[6]李萍,钟赣生.葛花对酒后血中乙醇浓度和肝中乙醇脱氢酶活性的影响[J].科技导报,2009,27(23):82-85.
[7]陈绍红,钟赣生.枳椇子对酒后血中乙醇质量浓度和肝中乙醇脱氢酶活性的影响[J].中国中药杂志,2006,31(13):1094-1096.
[8]Cope K,Risby T,Diehl AM.Increased gastrointestinal ethanol production in obese mice:implications for fatty liver disease pathogenesis.Gastroenterology,2000,119(5):1340-1347.
[9]瞿昊宇,冯楚雄,朱建平,等.GC法检测五汁饮对大鼠酒后血中乙醇浓度影响的实验研究[J].湖南中医杂志,2016,32(3):171-174.
[10]李先栓.乙醇代谢物的解毒探究[J].实验教学与仪器,2010,27(10):36-37.
[11]柳海艳,钟赣生,李怡文,王茜,刘佳.醇提和水提葛花枳椇子及其配伍对酒精性肝损伤大鼠肝脏抗氧化功能的影响[J].中华中医药杂志,2012,27(4):1181-1184.
[12]Tilg H,Moschen AR,Kaneider NC,et al.Pathways of liver injury in alcoholic liver disease[J].J Hepatol,2011,55(5):1159-1161.
[13]王旭,陈绍红,钟赣生,等.葛花、枳椇子配伍对慢性酒精性肝损伤大鼠海马7种单胺类神经递质及代谢产物含量水平的影响[J].中国现代中药,2016,18(5):558-562+594.
[14]刘明,陈绍红,钟赣生,等.葛花枳椇子配伍对酒精性肝损伤大鼠肝脏功能及病理形态的影响[J].南京中医药大学学报,2015,31(2):147-151.
(2017-01-01收稿 责任编辑:徐颖)
Effectiveness of Compatibility of Flos Puerariae and Semen Hoveniae on metabolic process of alcohol for acute alcoholism mice
Li Yiwen1, Liu Yang1, Liu Haiyan2, Xue Wenxin1, Li Huiyun1, Li Jing1
(1Departmentofpharmacy,ChinaMeitanGeneralHospital,Beijing100028,China; 2CollegeofBasicMedicine,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To discuss whether using the compatibility of Flos Puerariae and Semen Hoveniae or use them respectively was better through testing the changes of alcohol concentration, alcohol dehydrogenase (ADH), aldehyde dehydrogenase (ALDH) in acute alcoholism mice at different time points. Methods:ICR mice were randomly divided into control group, model group, positive group, Flos Puerariae(FP) group, Semen Hoveniae(SH) group, and combination group 1,2,3. Preventive administration method was taken, that was, feeding the mice alcohol to establish the model after 30 min administration. The blood and liver tissue were collected after 0.5 h,1 h, 2 h and 3 h respectively.The concentration of ethanol and the activity of ADH and ALDH in liver at different time point were measured by biochemical enzyme method. Results:The concentration of ethanol in blood reached the peak 2 h after intragastric administration. Compared with the model group, concentration of ethanol in blood in combination group 1,2,3 significantly decreased after 2 h (P<0.05); the level of ADH in the liver of mice reached peak 1 h later, and combination group 2,3 can significantly enhance liver ADH activity 1 h later for the drunken mice (P<0.05). Only combination group 3 was obvious effective in 2 h, 3 h; the level of ALDH in the liver of mice reached a peak at 2 h, and the combination group 3 had a significant increase. As for other groups, they tend to increase but the difference was not statistically significant.Conclusion:The effect of compatibility of Flos Puerariae and Semen Hoveniae was better than single application, it can decrease the concentration of alcohol in the blood of mice. Activating the activity of ADH and ALDH in the liver, inhibit the absorption of ethanol in the digestive tract may play a preventive role.
Flos Puerariae; Semen Hoveniae; Compatibility; Concentration of alcohol; Aldehyde dehydrogenase
煤炭总医院科研基金资助项目(K201412) 作者简介:李怡文(1984.09—),女,博士,主管药师,研究方向:中医临床药学,E-mail:liyiwenjackie@sina.cn
李静(1962.01—),女,研究生,主任药师,研究方向:医院药学,E-mail:lijing0127@sina.com
R285.5
A
10.3969/j.issn.1673-7202.2017.08.041
