体重指数与胃癌患者胃切除术术后生存质量的相关性研究*
2017-09-04张曹叶晶晶丁波刘东涛
张曹,叶晶晶,丁波,刘东涛
(宁夏医科大学总医院 1.胃肠外科,2.超声心动图室,宁夏 银川 750004)
体重指数与胃癌患者胃切除术术后生存质量的相关性研究*
张曹1,叶晶晶2,丁波1,刘东涛1
(宁夏医科大学总医院 1.胃肠外科,2.超声心动图室,宁夏 银川 750004)
目的 初步探讨体重指数与胃癌患者胃切除术术后生存质量的相关性。方法 选取该院行胃切除术的早期胃癌患者且符合研究要求的950例病例资料进行回顾性分析,根据患者于术前或术后1年的体重指数(BMI),分别将其分为:低体重组、正常体重组和高体重组。采集患者的年龄、性别、术前到术后1年的BMI、手术类型、胃根治性切除术类型、病理分期和组织学分型。并通过电话随访了解所有患者术后1年的生存情况,计算总生存率和无复发生存率。结果 3组患者的年龄分布、手术类型、胃根治切除术类型、病理分期及组织学分型比较,差异有统计学意义(P<0.05),高体重组术前不同BMI的总生存率高于低体重组和正常体重组,差异有统计学意义(P<0.05)。3组术后1年不同BMI的总生存率和无复发生存率比较,差异具有统计学意义(P<0.05),高体重组>正常体重组>低体重组。多因素分析显示,65岁及以上、术后1年低BMI、R1及R2的姑息性切除、肿瘤病理分期高(Ⅱ、Ⅲ和Ⅳ期)对早期胃癌患者的术后生存起到负向影响,均为风险因素。而术后1年高BMI对早期胃癌患者的术后生存起到正向影响,为保护因素。结论 体重干预对于早期胃癌患者行胃切除术的治疗效果的提高具有重要意义,值得临床深入研究与推广。
体重指数;早期胃癌;胃切除术;生存质量;体重干预
目前,肥胖和超重人群的不断增多已成为一项公共卫生的难题,多项研究证明[1-4],糖尿病、高血压、高?脂血和心血管疾病的发生多由不良的生活方式所导致,与机体处于超重和肥胖状态密切相关。体重指数(body mass index,BMI)是一个较好的反映全身脂肪量的测量指标,是评估肥胖使用最广泛的方法[5]。有多项研究证明[6-8],急性肺损伤、心脏衰竭、慢性肾衰竭及慢性阻塞性肺疾病等危重疾病的正常体重患者的手术效果及预后要优于超重和肥胖患者。然而,早期胃癌患者行胃切除术与其他手术不同,其术后总是伴随着体重减轻[9],故其术后BMI与术前BMI存在差异,不同体重的早期胃癌患者胃切除术后的生存质量不尽相同,但其中是否存在相关性尚不明确。因此,本研究拟通过分析早期胃癌患者行胃大部切除术前与术后BMI与其生存率之间的相关联系,探讨BMI对胃切除术后的生存预后的影响作用,旨为临床早期胃癌患者的临床治疗提供指导作用。
1 资料与方法
1.1 一般资料
选取2010年3月-2016年1月于宁夏医科大学总医院行胃切除术的早期胃癌患者1 126例的病历资料进行回顾性分析,经过纳入标准的筛选,符合研究要求的病例资料950例。根据患者于术前和术后1年内每个月在本院门诊部测得所有患者的BMI,将其分为3组:低体重组(BMI<18.50 kg/m2)、正常体重组(BMI为 18.50~24.99 kg/m2)和高体重组(BMI≥25.00 kg/m2)。
1.2 纳入标准
①早期胃癌患者;②行胃切除术者;③临床资料完整且随访记录完整者;④配合术后1年内BMI测量,且配合随访调查者;⑤对本研究知情同意并签订知情同意书者。
1.3 研究方法
根据患者病例资料采集其相关的临床资料,包括患者的年龄,性别,手术类型(包括胃全切除术和胃大部切除术),胃根治性切除术类型[R0切除(完整的手术切除,无残余肿瘤)、R1切除(除一切缘阳性外,无肿瘤残留)、R2切除(姑息性切除,可见肿瘤残留)];病理分期[Ⅰ(隆起型)、Ⅱ(浅表凹陷型)、Ⅲ(浅表广泛型)、Ⅳ(凹陷型)],组织学分型[乳突状腺癌、管状腺癌(高分化、中分化和低分化)、印戒细胞癌、黏液腺癌]。
1.4 预后调查
通过电话随访了解所有患者术后1年的生存情况,即死亡、复发、存活。生存率,即存活病例数所占总人数比例,本研究需计算其总生存率和无复发生存率。
1.5 统计学方法
数据处理采用SPSS17.0统计软件,计量资料以均数±标准差(±s)表示,比较做方差分析;计数资料以率(%)表示,比较做χ2检验;采用Kaplan-Meier法计算生存率,比较并通过log-rankχ2检验,影响因素的分析采用多因素Cox风险模型,以P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床病理特征
术前与术后1年3组的年龄分布(≥65岁与<65岁)、手术类型、胃根治切除术类型、病理分期及组织学分型的分布比较,差异均具有统计学意义(P<0.05),见表1、2。
2.2 3组的生存曲线情况
术前不同BMI的生存率显示:高体重组与低体重组、正常体重组比较,差异具有统计学意义(χ2=8.277和7.158,P=0.004和0.007),高体重组的生存率高于低体重组和正常体重组;正常体重组与低体重组的生存率比较,差异无统计学意义(χ2= 0.024,P=0.876),见图1。3组术后1年不同BMI的生存率比较,差异具有统计学意义(χ2=58.616,P= 0.000),其中高体重组>正常体重组>低体重组,见图2。
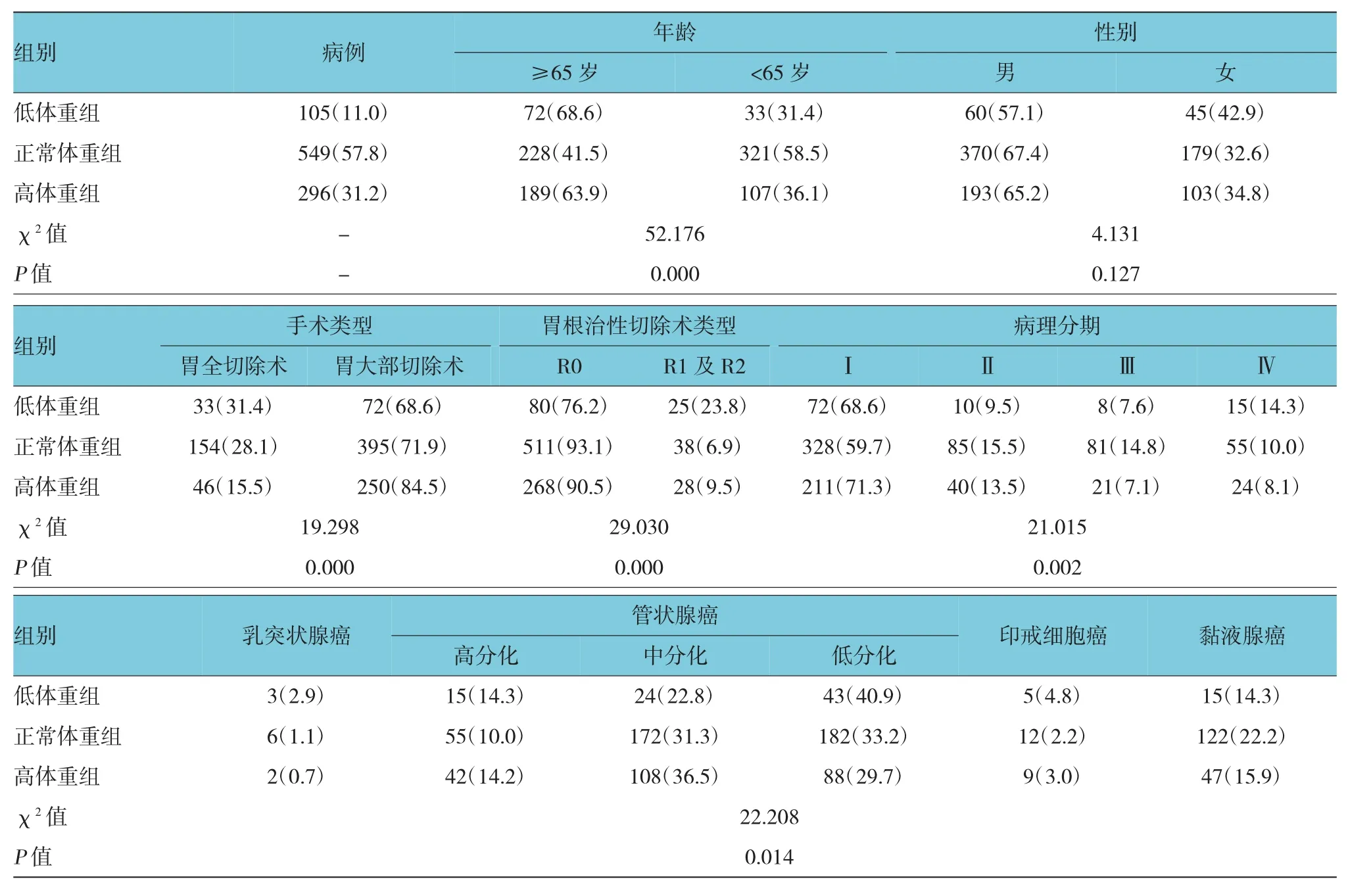
表1 术前不同体重指数组相关影响因素的比较 例(%)
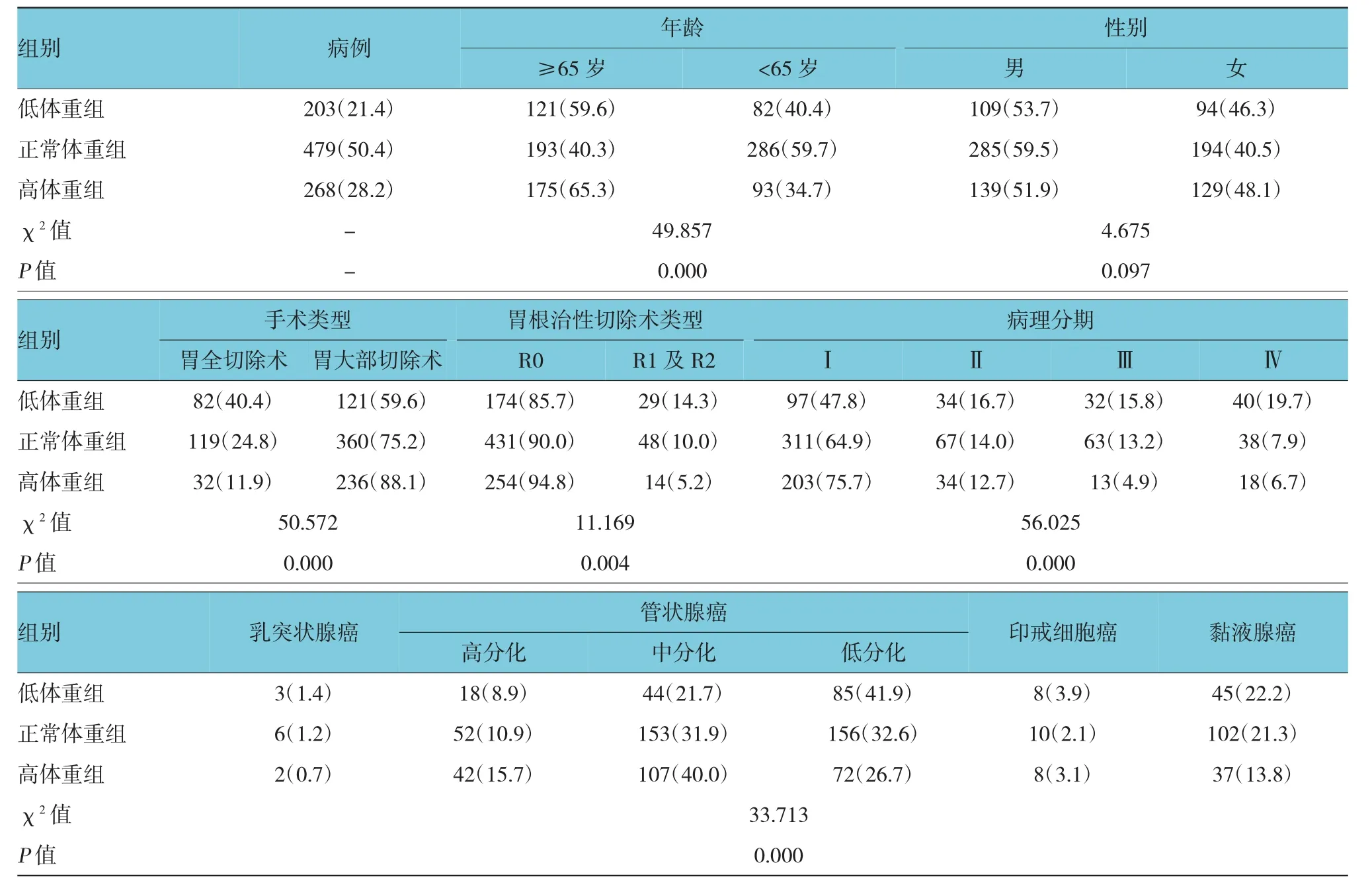
表2 术后1年不同体重指数组相关影响因素的比较 例(%)
3组术前不同BMI的无复发生存率比较,差异无统计学意义(χ2=0.045,P=0.757),见图3;3组术后1年不同BMI的无复发生存率比较,差异具有统计学意义(χ2=46.620,P=0.000),其中高体重组>正常体重>低体重组,见图4。
2.3 多因素Cox生存分析的结果

图1 3组术前不同BMI的生存率
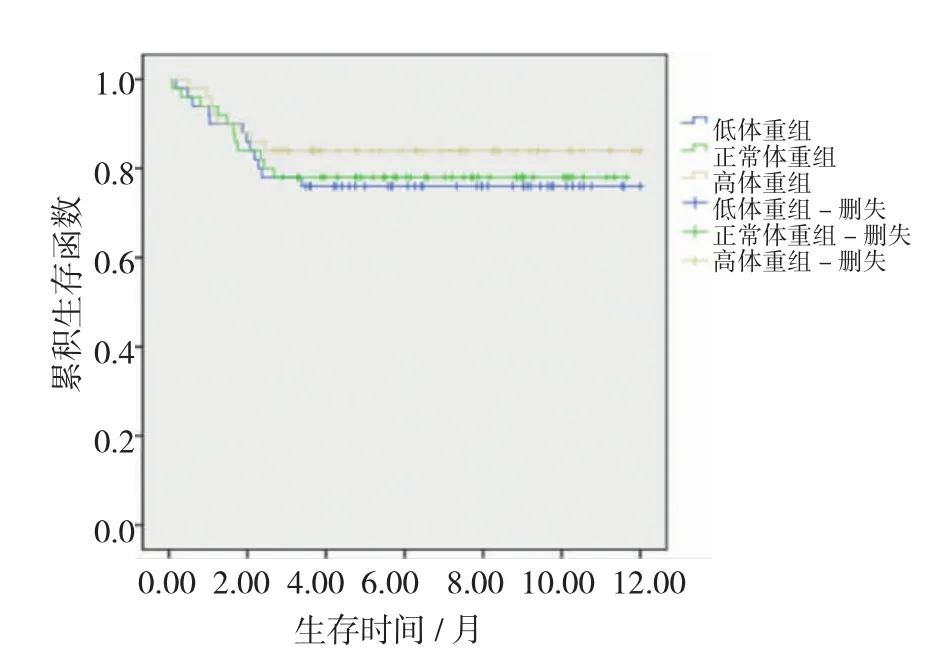
图3 3组术前不同BMI的无复发生存率
多因素分析显示影响早期胃癌总体生存的相关独立因素有:年龄、术后1年BMI、胃根治性切除术类型及病理分期。其中65岁及以上、术后1年低BMI、R1及R2的姑息性切除、肿瘤病理分期高(Ⅱ、Ⅲ和Ⅳ期)对早期胃癌患者的术后生存起到负向影响,均为风险因素。而术后1年高BMI对早期胃癌患者的术后生存起到正向影响,为保护因素。见表3。
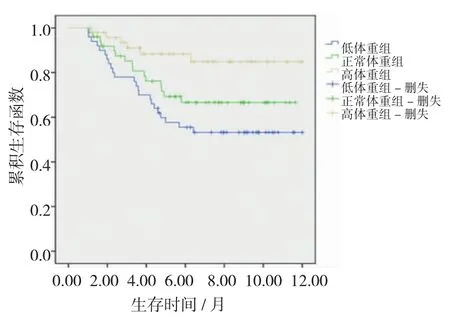
图2 3组术后1年不同BMI的生存率

图4 3组术后1年不同BMI的无复发生存率
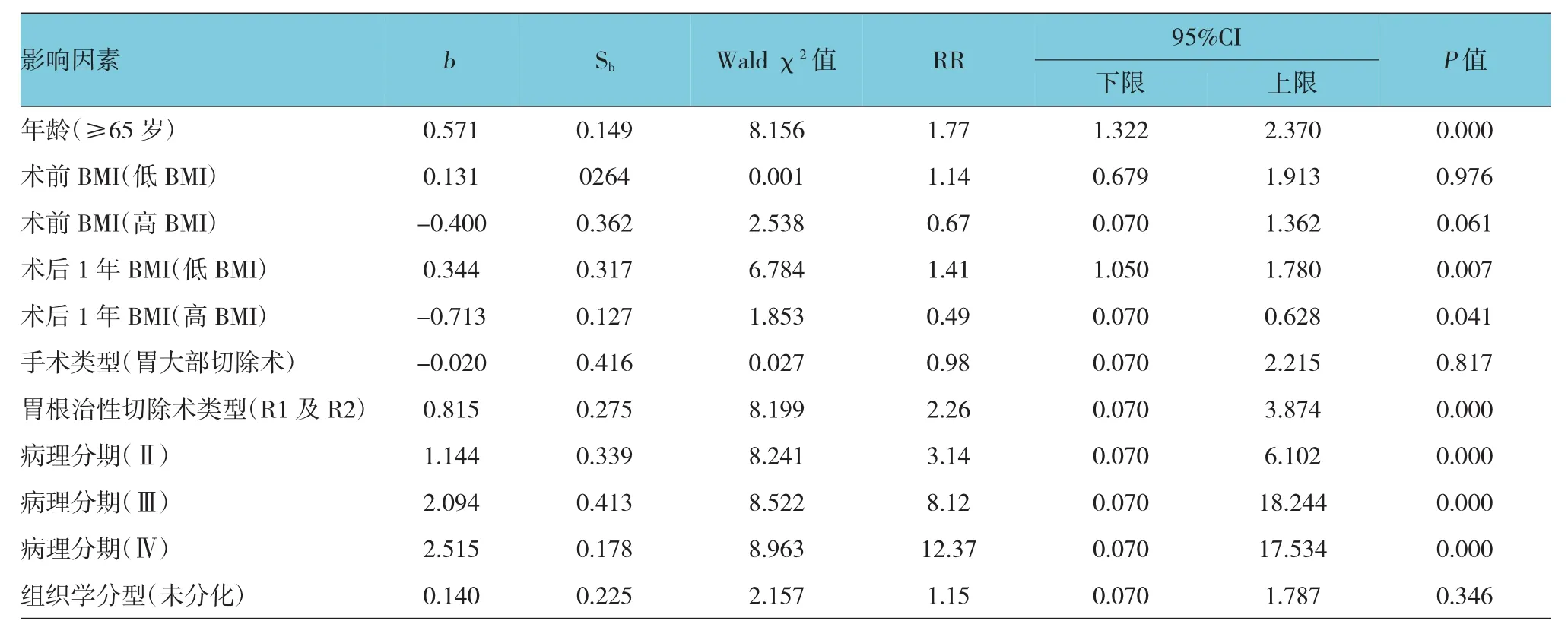
表3 Cox模型筛选的危险因素及相关参数
3 讨论
有研究证明BMI的增加可导致一些癌症的预后风险增高[10-11]。然而,结肠癌、胃癌等一些消化道恶性肿瘤的生存预后与肥胖之间的联系尚不确切,一定程度上影响了诊疗过程中的一些干预决策。因此,本研究的目的为明确BMI与早期胃癌患者胃切除术后生存预后的相关性,指导临床通过指导术前评估,从而通过体重干预提高临床疗效。
本研究结果中,高体重组术前和术后1年BMI患者的生存率高于正常体重者和低体重者。高体重组术后1年BMI的无复发生存率高于正常体重组和低体重组。说明高BMI患者的预后生存状况优于正常BMI和低BMI者,此结果与临床实际和此前的研究结果相一致[12],提示体重可能是影响早期胃癌患者行胃切除术后预后生存的重要因素之一,肥胖人群可能预后较好。
本研究对一些可能影响早期胃癌患者胃切除术后生存的指标进行了多因素分析,结果显示:65岁及以上、术后1年低BMI、R1及R2的姑息性切除、肿瘤病理分期高(Ⅱ、Ⅲ和Ⅳ期)为风险因素,而术后1年高BMI为保护因素。说明65岁及以上患者的总体生存预后不佳,可能由于行胃切除术对机体具有一定的损伤,年纪较大的老年患者身体素质较低,承受能力较弱,术后损伤后的恢复能力也较弱。早期胃癌患者胃切除术后的BMI对其预后生存情况有一定影响。其中高BMI患者的术后生存情况较好,而低BMI则欠佳,可能与胃切除术自身具有的体重变化规律有关,患者术后体重会呈下降趋势,术后3个月下降至最低,直至术后1年体重才趋于稳定,而在术后恢复的过程中患者对营养具有较高的需求。高BMI的患者具有较好的营养储备以满足患者术后的恢复,反之,低BMI无法满足患者术后的身体需求,从而术后恢复或预后生存状况欠佳。有研究证明,通过改善饮食的营养支持疗法可有效增加患者手术或接受放化疗降低的体重[13]。临床可以通过对早期胃癌患者胃切除术后的营养支持或其他一些体重干预措施以增加体重,改善患者营养储备,从而提高患者生存状况及总体的治疗效果。R1及R2的姑息性切除可能会因为切除不彻底,导致术后产生肿瘤复发、转移等不利影响,造成预后生存较差的结果,一般而言,肿瘤病理分期越高,其手术风险会随之升高,因其复发、转移及并发症的出现概率相对较高,故其生存状况具有一定程度的影响。
年龄、切除方法的选择、肿瘤病理分期均为相对客观的条件,无法通过干预治疗的办法对其进行改变。BMI是一项容易调节的指标,临床干预相对容易,所以通过调节术后BMI改善早期胃癌患者胃切除术后预后生存情况的可行性较高[14]。
综上所述,术后高BMI对早期胃癌患者的术后生存起到正向影响,为保护因素。临床可以通过体重干预措施以增加体重,改善患者身体的营养储备,从而提高患者生存状况及总体的治疗效果。体重干预对于早期胃癌患者行胃切除术的治疗效果的提高具有重要意义,值得临床深入研究与推广。
[1]刘震,黄斌,靳雁,等.远端胃切除术与全胃切除术治疗远端胃癌的术后并发症和长期预后比较[J].中华胃肠外科杂志,2015,18 (12):1240-1243.
[2]陆俊,黄昌明,郑朝辉,等.腹腔镜根治性全胃切除术治疗老年原发性胃癌患者的倾向评分配比预后分析[J].中华消化外科杂志, 2016,15(3):221-227.
[3]王家镔,黄昌明,郑朝辉,等.腹腔镜胃癌D2根治术218例疗效评价[J].中华外科杂志,2010,48(7):502-505.
[4]姚震旦,杨宏,崔明,等.POSSUM评分系统对胃癌患者手术风险的评估[J].中华胃肠外科杂志,2015(8):791-796.
[5]李彬,张惠玲.体质指数对胃癌患者术后预后的影响[J].实用医学杂志,2015,31(10):1620-1623.
[6]顾劲松,张文浩.超重对接受胃切除术治疗的胃癌患者的影响[J].中国医科大学学报,2011,40(4):372-375.
[7]卢昕,孟庆彬,邵永胜,等.进展期近端胃癌近端胃与全胃切除的对比研究[J].中华普通外科杂志,2016,31(2):97-99.
[8]鲁明典,李永翔.785例胃癌根治术后预后的多因素分析[J].安徽医科大学学报,2014,49(11):1654-1657.
[9]叶景旺,付涛,王祥峰,等.老年胃癌患者胃切除术后并发症相关发病因素分析[J].检验医学与临床,2015(18):2684-2687.
[10]鲍新洲,金炯,张明,等.胃癌根治术后患者预后的影响因素探讨[J].中国医师杂志,2015(3):451-453.
[11]刘松平,王连臣,柯延壮,等.手术前降低体重对胃癌患者生存状况影响的研究[J].中国现代医学杂志,2015,25(15):80-83.
[12]胡建,周阮萍,陈梦婷,等.近端胃癌的全胃切除术与近端胃切除术术后5年生存率Meta分析[J].南昌大学学报(医学版),2016, 56(4):43-47.
[13]丁海坤.胃全切除术和近端胃切除术对胃癌患者预后影响临床分析[J].中国实用医药,2013,8(8):129-130.
[14]袁玉青,张煜程,庄成乐,等.胃癌根治术后出院30天内非计划再入院危险因素分析[J].浙江医学,2016,38(11):794-798.
(张蕾 编辑)
Correlation between BMI and quality of life after gastrectomy in patients with gastric cancer*
Cao Zhang1,Jing-jing Ye2,Bo Ding1,Dong-tao Liu1
(1.Department of Gastrointestinal Surgery,2.Department of Echocardiography,General Hospital of Ningxia Medical University,Yinchuan,Ningxia Hui Autonomous Region 750004,China)
Objective To explore the correlation between body mass index(BMI)and quality of life after gastrectomy in patients with gastric cancer.Methods A total of 950 patients who underwent gastrectomy for early gastric cancer were retrospectively analyzed.According to BMI of the patients before operation or one year after operation,they were divided into underweight group,normal weight group and overweight group.The age and sex of the patients,the BMI before operation to one year after operation,the operation mode,the type of radical resection, the tumor pathological stage and histological type were collected.All patients were followed up by telephone for one year,and the overall survival rate and recurrence-free survival rate were calculated.Results There were significant differences in the age distribution,the preoperative BMI,the BMI at 1 year after operation,the surgical mode,the type of radical resection,the tumor pathological stage and histological type among the three groups(P<0.05).The overall survival rate of the patients in the overweight group(84%)was higher than that in the underweight group (58%)and the normal weight group(68%),the differences were statistically significant(P<0.05).The overall survival and relapse-free survival rates of the 3 groups at 1 year after operation were in the sequence of overweight group(88%,82%)>normal weight group(70%,66%)and underweight group(54%,54%),the differences werestatistically significant(P<0.05).Multivariate analysis showed that age over 65 years,low BMI at 1 year after operation,R1 and R2 palliative resection and high tumor stage(stageⅡ,Ⅲ andⅣ)were the risk factors for postoperative survival of early gastric cancer patients.However,high BMI at 1 year after operation had positive effect on the survival of the patients with early gastric cancer.Conclusions Body weight intervention is of great significance for the improvement of therapeutic effect of gastrectomy in patients with early gastric cancer.It is worthy of further research and promotion.
body mass index(BMI);early gastric cancer;gastrectomy;quality of life;weight intervention
R735.2
A
2017-03-24
宁夏自治区重点研发计划(2016KJHM55) ·56·
10.3969/j.issn.1005-8982.2017.19.011
1005-8982(2017)19-0056-05
