老年乳腺癌特点及内科辅助治疗现状
2017-09-04修萌张频
修萌 张频
·专家论坛·
老年乳腺癌特点及内科辅助治疗现状
修萌 张频

张频教授,主任医师、博士研究生导师。担任北京乳腺病防治学会内科专业委员会副主任委员,中国老年学会老年肿瘤专业委员会乳腺癌分会副主任委员,北京医学会乳腺疾病分会副主任委员,中国医师协会乳腺疾病培训专家委员会常委,中国女医师协会临床肿瘤学专家委员会常委,中国研究型医院学会乳腺专业委员会常委。致力于乳腺癌的药物治疗、综合治疗及抗肿瘤新药临床研究。作为主要成员荣获2014年中华医学科技奖一等奖,2016年华夏医学科技奖一等奖,2016年教育部科技进步二等奖。参与《临床肿瘤学》、《实用肿瘤内科治疗》、《乳腺癌》等多部肿瘤学专著的编写。
老年乳腺癌的治疗面临较多困境。老年乳腺癌患者的预期寿命、共病情况、一般功能状况等因素可对治疗决策和生存情况产生影响。体健、具有一定预期寿命的老年早期乳腺癌患者,术后应行标准的内科辅助治疗。本文结合老年乳腺癌特点,对内分泌治疗、化疗和抗HER-2靶向治疗的现状,及老年患者的药物疗效和不良反应进行综述。
乳腺癌 老年女性 辅助治疗 内科
老年乳腺癌通常是指65岁及以上的患者,但各研究的具体纳入年龄存在差异[1-2]。乳腺癌是老年女性患者死亡的重要事件,现有的大型临床研究很少纳入70岁以上的女性,且缺乏老年乳腺癌系统管理的充足证据。本文通过检索相关研究,综述老年乳腺癌内科辅助治疗的现状及进展,结合老年乳腺癌的流行病学、病理学特点,分析内科辅助治疗获益与不良反应,以期指导临床决策。
1 流行病学
中国国家癌症中心、全国肿瘤登记中心的数据显示,2015年中国女性乳腺癌新发病例数为26.86万例,居女性恶性肿瘤的第1位;死亡病例数为6.95万例,居第6位;60岁以上患者的新发病例占30%、死亡病例占53%,预计比例将继续增加[3]。一项以1999年至2008年医院为基础的全国多中心回顾性流行病学调查数据显示,中国女性确诊乳腺癌的中位年龄为48.7岁,发病高峰年龄段为40~49岁(占38.6%),年龄>60岁占15.4%[4]。欧美国家乳腺癌的发病年龄明显晚于中国,美国确诊乳腺癌的患者中位年龄为61岁,年龄>60岁占75%,年龄<50岁仅占7%[5]。近30年,美国乳腺癌患者的预后明显改善,而老年患者尤其是75岁以上的死亡率下降并不明显,年龄<75岁与年龄≥75岁新发乳腺癌的死亡风险每年下降约3.6%与1.3%(P<0.001)[6]。
2 病理学特点
在老年女性中乳腺癌常以惰性形式表现,具有良好的生物学特征;ER/PR表达高于年轻女性,HER-2过表达率较低,有较低的增生指数,P53表达正常且具有二倍体DNA;组织学低危的肿瘤如黏液癌比例更高[7]。在60~69岁乳腺癌中,Luminal A型、Lumi⁃nal B型、HER-2过表达型及Basal-like型分别占32%、28%、14%、16%;而70岁以上的乳腺癌中,Lumi⁃nal A型、Luminal B型的比例上升至39%、32%,HER-2过表达型、Basal-like型的比例下降,分别为11%、9%[8]。
3 辅助治疗
3.1 影响治疗决策的因素
目前,针对老年乳腺癌的临床研究较少,缺乏治疗相关的指南。单纯的生理年龄对于个体能否耐受抗肿瘤治疗所获得的信息较少,年龄相同的患者积极接受治疗的结果存在较大差异。预期寿命是对老年早期乳腺癌行内科辅助治疗尤其是化疗的重要影响因素,是首先应考虑的问题。乳腺癌本身、生理年龄、一般状况、共病情况均影响老年患者的预期寿命[9]。美国的一项研究纳入了1992年至2000年确诊的64034例66岁及以上的老年乳腺癌患者,分析了心梗、心衰、外周血管疾病、慢性肾脏病等13种共病均与总生存期(overall survival,OS)降低、死亡率升高相关,并发现存在1种共病的Ⅰ期患者的生存率等于甚至劣于无共病的Ⅱ期患者[10]。有研究报道,对因多种共病而预期寿命<5年的老年患者不宜化疗,可避免因化疗的严重不良反应导致生存质量下降[9]。
尽管老年乳腺癌通常具有良好的生物学特征,但因预期寿命有限和患者对治疗的不良反应担心,一半患者治疗不足,导致预后较差。德国的一项研究显示,年龄≥65岁乳腺癌患者行3个及以上疗程化疗的比例显著低于年龄<65岁患者(P<0.001),中位随访85个月,年龄≥65岁患者的无病生存期(disease free survival,DFS)显著较短(P<0.048)[11]。
3.2 老年综合评价
因老年患者身体状况差异大,难以形成统一的疾病管理标准,美国内科医师学会老年病学分会提出了老年综合评价(comprehensive geriatric assess⁃ment,CGA)指标。CGA为多学科评估,主要包括了解老年人的功能状态、共病、认知、营养、心理状态、社会支持和既往用药情况,预测和处理治疗造成的不良反应、预测生存情况、发现其他健康问题等,从而制定协同性方案,最大程度地维持老年患者的总体健康状况,被认为是老年患者实施个体化治疗的金标准。英国一项针对70岁以上老年患者对化疗耐受情况进行CGA与否的研究,结果显示行CGA患者易完成既定的抗肿瘤治疗(OR为4.14,P=0.006),发生3级以上不良反应的风险较低(43.8%vs.52.9%,P=0.292)[12]。国际老年肿瘤学会(SIOG)指南推荐,对老年癌症患者(定义为65岁或以上)应常规行CGA,若可耐受,均应根据肿瘤的生物学特征行标准治疗[13]。
3.3 内分泌治疗
内分泌治疗是老年早期乳腺癌、激素受体阳性患者最重要的辅助治疗手段,能显著改善患者的DFS。EBCTCG的一项Meta分析证实,在年龄>70岁的老年乳腺癌患者中,他莫昔芬降低了28%复发率和21%死亡率,建议对老年乳腺癌、激素受体阳性患者行内分泌治疗[1]。另有一项EBCTCG的Meta分析证实,对绝经后乳腺癌激素受体阳性患者,芳香化酶抑制剂(AI)优于他莫昔芬(TAM);与TAM相比AI降低了30%复发率;5年AI治疗较TAM治疗的10年死亡率降低了15%,较未行内分泌治疗降低了40%[14]。因此,老年乳腺癌激素受体阳性患者行内分泌治疗首选AI。延长AI治疗时间至10年,相较于5年治疗可进一步提高患者的DFS,降低对侧乳腺癌的发生率,但不改善OS[15]。BIG1-98是针对老年乳腺癌患者的内分泌疗效和不良反应的研究,通过STEPP分析发现,老年乳腺癌患者行内分泌治疗的DFS、不良反应与年龄无关;基于对治疗获益与不良反应的综合考虑,建议对接受过化疗、淋巴结转移的高危患者,或易发生血栓、子宫内膜增生性病变的患者优先选择AI治疗;对中低危,且易发生骨折或有心脏疾病风险的患者,可以选择TAM治疗[16]。
绝经后乳腺癌激素受体阳性患者,行AI内分泌治疗后相关的骨密度减少、骨折风险增高是临床普遍面临的问题,5年AI治疗后的骨折率由1%上升到18%[17]。欧洲临床肿瘤协会年会(ESMO)骨健康指南和中国骨安全专家共识建议,绝经后早期乳腺癌患者行AI治疗前应行基线骨密度检测(DXA法),以后1次/年检测骨密度的变化,结合年龄、既往家族骨折史、吸烟饮酒史、身体质量指数(BMI)、激素使用史及骨密度值等危险因素进行危险分层;对存在2个及以上骨折危险因素的患者,应给予双膦酸盐干预,推荐唑来膦酸4 mg,每6个月使用1次;同时,AI治疗期间应常规补充维生素D、钙剂,改善生存质量[18]。
3.4 化疗
老年早期乳腺癌患者具有ER、PR阴性、HER-2过表达或激素受体阳性、淋巴结转移、脉管瘤栓、组织学分级Ⅲ级、高增殖指数等预后不良因素,均应行辅助化疗。一项来自123个临床试验研究的Meta分析显示,100 000例早期乳腺癌患者亚组分析结果显示,辅助化疗使65~69岁患者(包括ER阳性接受内分泌治疗的患者)的10年死亡率下降1/3,但无年龄>70岁患者的数据[2]。在实际临床决策中,对老年乳腺癌患者行辅助化疗需慎重权衡化疗的获益和不良反应。
关于老年乳腺癌患者辅助化疗的临床试验较少,尤其缺乏身体虚弱、共病多、生存质量不佳患者的数据。FASG 08是第一个针对老年乳腺癌患者辅助化疗的临床试验,证明了以蒽环类为代表的化疗药物在治疗中的重要作用[19]。同时,蒽环类对老年患者的不良反应是不容忽视的临床问题。研究证明,传统蒽环类药物可导致心衰等严重心脏事件,其中年龄(不考虑共病和一般状况)、现存或既往心功能不全、高血压、糖尿病、冠心病、蒽环类累积剂量和使用间隔时间是重要的危险因素[20]。另外,蒽环类对老年乳腺癌患者的骨髓抑制更为严重,32%患者发生3~4度骨髓抑制,与年轻乳腺癌患者的21%比较具有显著性差异(P<0.000 1)[21]。
为了探索疗效好、不良反应较少的辅助化疗方案,针对老年乳腺癌患者进行了卡培他滨单药与标准的多柔比星联合环磷酰胺(AC)方案或环磷酰胺、甲氨蝶呤、氟尿嘧啶(CMF)方案的疗效比较,结果显示卡培他滨单药的疗效较差,在激素受体阴性患者中尤为显著[22]。该研究提示AC/CMF方案仍然是老年乳腺癌辅助化疗的标准方案。CALGB 40101研究对紫杉醇单药(每周或2周方案)与标准的AC方案进行比较,患者的淋巴结阳性数量<4枚,年龄>50岁占61%,结果显示紫杉醇单药不劣于AC方案,但神经毒性更多见[23]。另有研究纳入65~79岁老年患者,结果显示老年乳腺癌患者使用多西他赛单药化疗的有效性和安全性均劣于标准的CMF方案,患者的总体生存质量下降[24]。
标准的AC方案与多西紫杉醇联合环磷酰胺方案(TC)治疗比较的结果显示,年龄>65岁的老年患者占16%,TC方案优于AC,且与激素受体状态、HER-2表达无关,但未行亚组分析[25]。ICEⅡ-GBG 52研究探讨了白蛋白结合型紫杉醇(nPTX)联合卡培他滨(Xeloda)在中高危、共病少的老年患者中的应用,结果显示nPTX+Xeloda方案治疗的中断率较高,主要原因为手足综合征、腹泻、外周神经病变等不良反应。因该研究随访时间较短,现有数据尚不能证明nPTX+Xeloda方案优于标准的表柔比星联合环磷酰胺(EC)或CMF方案[26]。因此,老年乳腺癌辅助化疗目前仍推荐标准的联合化疗方案,对有心脏毒性风险的患者,可选择如TC、CMF等非蒽环类方案(表1)。
3.5 抗HER-2靶向治疗
辅助化疗联合曲妥珠单抗(赫赛汀)为早期乳腺癌HER-2阳性患者带来持久的生存获益[27]。有研究[28]分析了NCCTG N9831、NSABP B-31试验,在中位随访8.4年时,联合使用曲妥珠单抗使DFS、OS率分别提高了40%、37%。在临床实践中,由于预期寿命、经济负担、共病等问题,使得老年患者曲妥珠单抗的应用受限,应加强抗HER-2靶向治疗在老年乳腺癌中的应用。
曲妥珠单抗的心脏毒性是临床上老年乳腺癌抗HER-2靶向治疗面临的主要问题。2 203例曲妥珠单抗治疗老年乳腺癌(年龄>66岁)分析显示,接受曲妥珠单抗治疗与否所发生心衰的比例分别为29.4%和18.9%,高龄(年龄>80岁)、高血压、冠心病、曲妥珠单抗每周疗法为发生药物相关心衰的危险因素[29-30]。

表1 老年乳腺癌辅助化疗主要临床研究结果Table 1 Pivotal clinical trials for elderly breast cancer adjuvant chemotherapy

表1 老年乳腺癌辅助化疗主要临床研究结果(续表1)Table 1 Pivotal clinical trials for elderly breast cancer adjuvant chemotherapy
非蒽环类化疗方案联合曲妥珠单抗治疗HER-2阳性乳腺癌的主要临床研究中,均纳入了部分老年患者。多西他赛、卡铂联合赫赛汀(TCH)方案[31-32]具有良好的安全性和有效性,适合发生心脏意外事件风险较高的HER-2阳性老年患者。多西他赛、环磷酰胺联合赫赛汀方案对乳腺癌淋巴结阴性、HER-2阳性患者治疗所引发的心脏毒性较轻,是淋巴结阴性、HER-2阳性老年患者可选择的方案[33]。另外,针对淋巴结阴性的小肿瘤患者,使用紫杉醇单药治疗12周,同时联合赫赛汀治疗52周,3年随访结果显示该方案治疗Ⅰ期乳腺癌有良好的安全性和有效性[34-35](表2)。
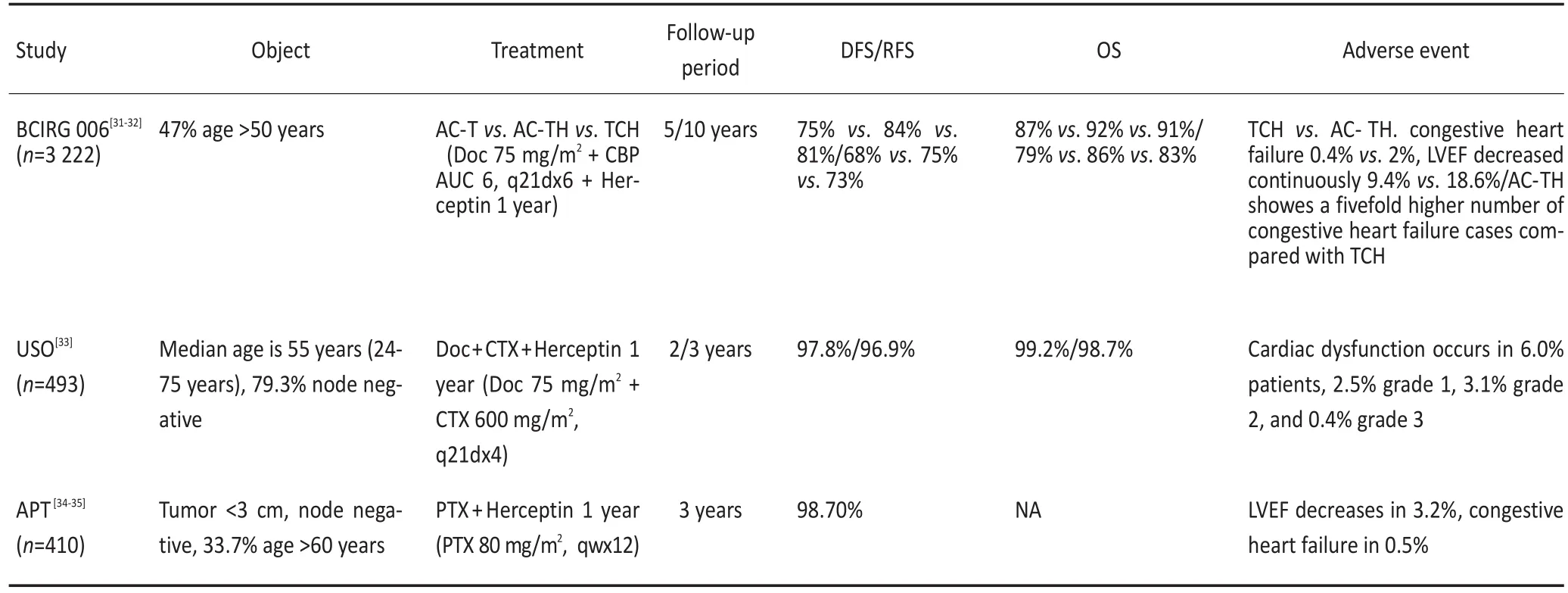
表2 HER-2阳性乳腺癌的非蒽环类化疗方案联合曲妥珠单抗的主要临床研究结果Table 2 Pivotal clinical trials of non-anthracycline-containing adjuvant chemotherapy combined with trastuzumab for HER2-positive breast cancer
因此,HER-2阳性老年乳腺癌患者的辅助治疗推荐赫赛汀联合化疗,兼顾疗效与心脏安全性,TCH方案是较好的选择。对淋巴结阴性的小肿瘤患者可选择多西他赛、环磷酰胺联合赫赛汀,或紫杉醇单药联合赫赛汀;对无心脏风险的高危患者,多柔比星联合环磷酰胺序贯紫杉醇联合曲妥珠单抗(AC-TH)方案仍为较理想的选择。
4 结语
老年乳腺癌通常具有良好的生物学特性,Lumi⁃nal型所占的比例较高。因预期寿命有限、对不良反应的担心及合并其他疾病,半数的老年患者未完成应行的辅助治疗,预后相对较差。激素受体阳性老年乳腺癌患者的辅助内分泌治疗首选AI,治疗期间应监测骨密度,必要时给予双膦酸盐干预。目前,辅助化疗仍推荐标准的联合化疗方案,对心脏意外事件风险高的患者,可选择非蒽环类方案。HER-2阳性患者推荐赫赛汀联合化疗,化疗方案的选择应综合考虑复发风险、一般状况及心脏功能。今后应积极开展针对老年乳腺癌患者的临床试验,探索有效、安全、适合老年患者的辅助治疗方案。
[1]Early Breast Cancer Trialists'Collaborative Group(EBCTCG),Davies C,Godwin J,et al.Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen:patient-level metaanalysis of randomised trials[J].Lancet,2011,378(9793):771-784.
[2]Early Breast Cancer Trialists'Collaborative Group(EBCTCG),Peto R,Davies C,et al.Comparisons between different polychemotherapy regimens for early breast cancer:meta-analyses of long-term outcome among 100,000 women in 123 randomised trials[J].Lancet,2012,379(9814):432-444.
[3]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[4]Li J,Zhang BN,Fan JH,et al.A nation-wide multicenter 10-year(1999-2008)retrospective clinical epidemiological study of female breast cancer in china[J].BMC Cancer,2011,11:364.
[5]Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin,2016,66(4):271-289.
[6]Smith BD,Jiang J,McLaughlin SS,et al.Improvement in breast cancer outcomes over time:are older women missing out[J]?J Clin Oncol,2011,29(35):4647-4653.
[7]Engels CC,Kiderlen M,Bastiaannet E,et al.The clinical prognostic value of molecular intrinsic tumor subtypes in older breast cancer patients:a FOCUS study analysis[J].Mol Oncol,2016,10(4):594-600.
[8]Jenkins EO,Deal AM,Anders CK,et al.Age-specific changes in intrinsic breast cancer subtypes:a focus on older women[J].Oncologist,2014,19(10):1076-1083.
[9]Schwentner L,Van Ewijk R,KühnT,et al.Exploring patient-and physician-related factors preventing breast cancer patients fromguidelineadherent adjuvant chemotherapy-results from the prospective multicenter study BRENDAⅡ[J].Support Care Cancer,2016,24(6):2759-2766.
[10]Patnaik JL,Byers T,Diguiseppi C,et al.The influence of comorbidities on overall survival among older women diagnosed with breast cancer[J].J Natl Cancer Inst,2011,103(14):1101-1111.
[11]Wallwiener CW,Hartkopf AD,Grabe E,et al.Adjuvant chemotherapy in elderly patients with primary breast cancer:are women≥65 undertreated[J]?J Cancer Res Clin Oncol,2016,142(8):1847-1853.
[12]Kalsi T,Babic-Illman G,Ross PJ,et al.The impact of comprehensive geriatric assessment interventions on tolerance to chemotherapy in older people[J].Br J Cancer,2015,112(9):1435-1444.
[13]Decoster L,Van Puyvelde K,Mohile S,et al.Screening tools for multidimensional health problems warranting a geriatric assessment in older cancer patients:an update on SIOG recommendations[J].Ann Oncol,2015,26(2):288-300.
[14]Early Breast Cancer Trialists'Collaborative Group(EBCTCG).Aromatase inhibitors versus tamoxifen in early breast cancer:patient-level meta-analysis of the randomised trials[J].Lancet,2015,386(10001):1341-1352.
[15]Goss PE,Ingle JN,Pritchard KI,et al.Extending aromatase-inhibitor adjuvant therapy to 10 years[J].N Engl J Med,2016,375(3):209-219.
[16]Crivellari D,Sun Z,Coates AS,et al.Letrozole compared with tamoxifen for elderly patients with endocrine-responsive early breast cancer:the BIG 1-98 trial[J].J Clin Oncol,2008,26(12):1972-1979.
[17]Body JJ,Terpos E,Tombal B,et al.Bone health in the elderly cancer patient:A SIOG position paper[J].Cancer Treat Rev,2016,(51):46-53.
[18]Chinese expert consensus group for multidisciplinary management of bone health of breast cancerendocrine therapy.Management of aromatase inhibitor-related bone health in postmenopausal patients with early breast cancer:Chinese expert consensus[J].Chin J Oncol,2015,37(7):554-558.[中国乳腺癌内分泌治疗多学科管理骨安全共识专家组.绝经后早期乳腺癌芳香化酶抑制剂治疗相关的骨安全管理中国专家共识[J].中华肿瘤杂志,2015,37(7):554-558.]
[19]Fargeot P,Bonneterre J,Roché H,et al.Disease-free survival advantage of weekly epirubicin plus tamoxifen versus tamoxifen alone as adjuvant treatment of operable,node-positive,elderly breast cancer patients:6-year follow-up results of the French adjuvant study group 08 trial[J].J Clin Oncol,2004,22(23):4622-4630.
[20]Aapro M,Bernard-Marty C,Brain EG,et al.Anthracycline cardiotoxicity in the elderly cancer patient:a SIOG expert position paper[J].Ann Oncol,2011,22(2):257-267.
[21]Karavasilis V,Papadimitriou C,Gogas H,et al.Safety and tolerability of anthracycline-containing adjuvant chemotherapy in elderly high-risk breast cancer patients[J].Clin Breast Cancer,2016,16(4):291-298.
[22]Muss HB,Berry DA,Cirrincione CT,et al.Adjuvant chemotherapy in older women with early-stage breast cancer[J].N Engl J Med,2009,360(20):2055-2065.
[23]Shulman LN,Berry DA,Cirrincione CT,et al.Comparison of doxorubicin and cyclophosphamide versus single-agent paclitaxel as adjuvant therapy for breast cancer in women with 0 to 3 positive axillary nodes:CALGB 40101(Alliance)[J].J Clin Oncol,2014,32(22):2311-2317.
[24]Perrone F,Nuzzo F,Di Rella F,et al.Weekly docetaxel versus CMF as adjuvant chemotherapy for older women with early breast cancer:final results of the randomized phaseⅢELDA trial[J].Ann Oncol,2015,26(4):675-682.
[25]Jones S,Holmes FA,O'Shaughnessy J,et al.Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide:7-year follow-up of US Oncology Research Trial 9735[J].J Clin Oncol,2009,27(8):1177-1183.
[26]von Minckwitz G,Conrad B,Reimer T,et al.Arandomized phase 2 study comparing EC or CMF versus nab-paclitaxel plus capecitabine as adjuvant chemotherapy for nonfrail elderly patients with moderate to high-risk early breast cancer(ICEⅡ-GBG52)[J].Cancer,2015,121(20):3639-3648.
[27]Cameron D,Piccart-Gebhart MJ,Gelber RD,et al.11 years'followup of trastuzumab after adjuvant chemotherapy in HER-2-positive early breast cancer:final analysis of the Herceptin adjuvant(HERA)trial[J].Lancet,2017,389(10075):1195-1205.
[28]Perez EA,Romond EH,Suman VJ,et al.Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer:planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831[J].J Clin Oncol,2014,32(33):3744-3752.
[29]Denegri A,Moccetti T,Marccettio M,et al.Cardiac toxicity of trastuzumab in elderly patients with breast cancer[J].J Geriatr Cardiol,2016,13(4):355-363.
[30]Chavez-MacGregor M,Zhang N,Buchholz TA,et al.Trastuzumab-related cardiotoxicity among older patients with breast cancer[J].J Clin Oncol,2013,31(33):4222-4228.
[31]Slamon D,Eiermann W,Robert N,et al.Adjuvant trastuzumab in HER-2 positive breast cancer[J].N Engl J Med,2011,365(14):1273-1283.
[32]Fontanella C,Puglisi F.Translational and clinical research highlights from the 38th San Antonio Breast Cancer Symposium[J].Future Oncol,2016,12(8):1005-1008.
[33]Jones SE,Collea R,Paul D,et al.Adjuvant docetaxel and cyclophosphamide plus trastuzumab in patients with HER-2 amplified early stage breast cancer:a single-group,open-label,phase 2 study[J].Lancet Oncol,2013,14(11):1121-1128.
[34]Tolaney SM,Barry WT,Dang CT,et al.Adjuvant paclitaxel and trastuzumab for node-negative,HER-2 positive breast cancer[J].N Engl J Med,2015,372(2):134-141.
[35]Dang C,Guo H,Najita J,et al.Cardiac outcomes of patients receiving adjuvant weekly paclitaxel and trastuzumab for node-negative,ERBB2-positive breast cancer[J].JAMA Oncol,2016,2(1):29-36.
(2017-03-17收稿)
(2017-07-09修回)
Characteristics and adjuvant medical treatment for elderly women with breast cancer
Meng XIU,Pin ZHANG
Pin ZHANG;E-mail:zppumc@163.com
Department of Medical Oncology,National Cancer Center/Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China
The optimal treatment of elderly women with breast cancer still faces many difficulties.Life expectancy,comorbidity,and functional status influence clinical decision and survival.Standard adjuvant medical treatments should not be withheld from healthy older patients with reasonable life expectancies.In this study,adjuvant medical treatment literatures for elderly breast cancer patients,including endocrine therapy,chemotherapy,and HER2-targeted therapy,were reviewed,focusing on efficacy and toxicity of drugs for elderly women.
breast cancer,elderly women,adjuvant treatment,medical

10.3969/j.issn.1000-8179.2017.15.304
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院内科(北京市100021)
张频zppumc@163.com
修萌专业方向为肿瘤内科临床及基础研究。
E-mail:ambw53719@126.com
