新型线粒体靶向铂类配合物Mor-platin抑制肝癌细胞HepG2增殖和抑制细胞球侵袭的研究*
2017-09-04李淑群陈谦廖维甲翁俊莫庆荣李菁玲喻亚群
李淑群陈谦廖维甲翁俊莫庆荣李菁玲喻亚群
新型线粒体靶向铂类配合物Mor-platin抑制肝癌细胞HepG2增殖和抑制细胞球侵袭的研究*
李淑群①陈谦①廖维甲①翁俊①莫庆荣①李菁玲②喻亚群①
目的:探讨新型线粒体靶向性铂类配合物Mor-platin对人肝癌细胞HepG2的细胞增殖和细胞球侵袭的影响。方法:运用细胞毒性实验CCK-8法,比较新型线粒体靶向性铂类配合物Mor-platin和经典铂类抗癌药顺铂(cisplatin)对人肝癌细胞HepG2的细胞增殖抑制作用;利用激光共聚焦显微镜观察Mor-platin是否靶向于线粒体;利用透射电子显微镜观察Mor-platin对细胞线粒体形态的影响;流式细胞仪检测Mor-platin作用细胞后细胞凋亡的改变;建立三维肿瘤细胞球模型,探讨Mor-platin对细胞球侵袭的影响。结果:Mor-platin能够抑制HepG2细胞增殖,半数抑制浓度(IC50)少于cisplatin;Mor-platin能够靶向到线粒体;加Mor-platin后,细胞线粒体膜结构不完整,嵴不清晰或消失以及线粒体中有大片空白区域;Mor-platin引起的细胞凋亡具有剂量依赖性;三维肿瘤细胞球模型显示,Mor-platin处理的细胞球面积小于对照组。结论:新型线粒体靶向性铂配合物Mor-platin能够靶向于细胞的线粒体,引起线粒体形态变化,抑制细胞增殖,最终导致细胞凋亡,Mor-platin还能抑制三维肿瘤细胞球侵袭,比cisplatin具有更好的抗癌效果。上述研究结果提示Mor-platin具有成为新抗肿瘤药物的潜质。
顺铂 线粒体 抗肿瘤药物 人肝癌细胞 细胞增殖 细胞凋亡 细胞球侵袭
1965年美国生物物理学家Rosenberg及其团队意外发现“惰性的铂电极”能够促使细菌生长,由此展开对顺铂抗癌特性的研究。顺铂可与细胞核DNA结合,抑制DNA复制[1],并损害细胞膜结构,具有较强的广谱抗癌性,对卵巢癌、睾丸癌、肺癌、鼻咽癌、头颈癌等均有较好的疗效[2-5]。合成数千种铂配合物,其中得到广泛应用的为卡铂、奈达铂和奥沙利铂,虽然这些铂类配合物的抗肿瘤效果较强,但是由于均具有相似的结构,容易产生交叉耐药性,进而限制了其在临床上的使用。
亚细胞器靶向性特别是线粒体靶向性的铂类配合物是近年来抗肿瘤药物的研究热点,因为线粒体是细胞中除细胞核之外唯一具有遗传物质DNA的亚细胞器,加上肿瘤细胞和正常细胞的线粒体在结构和功能上有很大不同,肿瘤细胞更易受到线粒体功能影响[6-9],所以线粒体可以作为铂类抗肿瘤药物的治疗靶点。本研究新合成的铂类化合物Mor-plat⁃in[10],由于具有磷光、亲脂性和离域阳离子等特性,因此能够追踪该药物在细胞内的线粒体靶向性[11]。本研究已对Mor-platin在人肺癌细胞(H1975)中的生物学效应进行了研究,本研究选择人肝癌细胞HepG2细胞,主要研究Mor-platin对HepG2细胞增殖的影响以及在细胞内的线粒体靶向性,建立三维肿瘤细胞球模型研究细胞侵袭效应。
1 材料与方法
1.1 材料
1.1.1 细胞株人肝癌细胞系HepG2购自于中国科学院上海细胞库。
1.1.2 主要试剂细胞培养基DMEM购自于美国Hyclone公司;胎牛血清FBS购自于美国Gibco公司;0.25%胰酶细胞消化液购自于美国Sigma公司;顺铂购自于上海佰世凯化学科技有限公司;Cell Counting Kit-8购自于日本Dojindo公司;线粒体绿色荧光探针(MTG)购自于上海碧云天生物技术有限公司;细胞裂解液RIPA溶液、Trump's固定液、锇酸、树脂包埋剂以及其他电镜相关的试剂均购自于上海生工生物有限公司;Annexin V-FITC细胞凋亡检测试剂盒购自于上海碧云天生物技术有限公司。
1.1.3 主要仪器细胞培养箱购自于美国Thermo公司;多功能酶标仪购自于美国Bio Tek公司;扫描型激光共聚焦显微镜和倒置荧光显微镜均购自于日本Olympus公司;流式细胞仪购自于美国BD公司。
1.2 方法
1.2.1 细胞毒性实验取对数增长期的HepG2细胞,用0.25%胰酶细胞消化液消化细胞1 min,DMEM培养基终止消化,以每孔10 000/100 μL的细胞浓度接种于96孔板中,置于细胞培养箱中(37℃,5%CO2)孵育过夜。弃掉原培养基,加入含有不同浓度梯度的Mor-platin和cisplatin的新鲜培养基,以1%二甲基亚砜溶剂作为对照组,同时设立不加细胞的空白对照组,每个浓度有6个复孔。药物处理24 h后,弃掉培养基,换含有10%CCK-8的新鲜培养基,放入培养箱中孵育4 h,采用多功能酶标仪检测波长在490 nm处的吸光度值。用Origin 8.0软件作图,计算IC50值。
1.2.2 线粒体染色取对数增长期的HepG2细胞以100 000/1.5 mL细胞浓度接种于35 mm confocal培养皿中,于细胞培养箱中孵育,待细胞长到70%~80%细胞丰度时,加入2.5 μg/mL Mor-platin处理细胞2 h,然后与50 nM线粒体绿色荧光探针MTG共同孵育30 min,在扫描型激光共聚焦显微镜下观察线粒体染色情况以及和药物Mor-platin的共定位现象。
1.2.3 透射电子显微镜(TEM)HepG2细胞以1 500 000/10 mL细胞浓度接种于10 cm细胞培养皿中,于细胞培养箱中孵育过夜,加入5 μg/mL Mor-pla⁃tin处理细胞24 h。24 h后,收集细胞,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗一遍细胞,离心,取细胞沉淀,Trump's固定液在4℃中固定细胞过夜,0.1 M PBS洗一遍细胞,锇酸固定1 h,50%、70%、90%、100%乙醇和丙酮脱水,树脂包埋,切片(70 nm)置于铜网上,柠檬酸铅和醋酸双氧铀双重染色,染色后的样品在透射电子显微镜下观察、拍照。
1.2.4 细胞凋亡实验Annexin-V-FITC细胞凋亡检测试剂盒被用来检测Mor-platin导致的细胞凋亡。选取对数增长期的HepG2细胞,以50 000/0.5 mL的细胞浓度接种于24孔板中,置于细胞培养箱中孵育过夜,加入不同浓度梯度的Mor-platin(0~40 μg/mL),每个浓度重复3次。药物处理细胞24 h后,将上清液吸出至5 mL离心管中,PBS洗一遍以除去培养基,加入300 μL胰酶细胞消化液消化细胞,注意避免过度消化,加入600 μL培养基终止消化,将细胞转移至之前的5 mL离心管中,1 000 g离心5 min,小心吸除上清,残留约50 μL的培养基,以避免吸走细胞。用预冷的PBS轻轻重悬细胞并计数,取5~10万个细胞,1 000 g离心5 min,小心吸除上清,残留约50 μL培养基,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,然后加入5 μL Annexin V-FITC,混匀,最后加入10 μL碘化丙啶(PI)染色液,混匀,室温避光孵育30 min,孵育过程中重悬细胞3次以增加染色效果,立即上流式细胞仪进行检测。
1.2.5 三维肿瘤细胞球侵袭实验用PBS配制1%琼脂糖溶液,用高压灭菌锅灭菌,灭菌后应立即放入60℃的水浴锅中,以避免凝固。吸取50 μL琼脂糖溶液加入96孔板(RNase&DNase free)中,待琼脂糖凝固后,将200 μL H1975细胞悬液(5×103)接种到用琼脂糖处理过的96孔板中,置于细胞培养箱中孵育2~3 d使细胞成球。待细胞成球后,加入Mor-platin(0、5、10 μg/mL)处理24 h,采用倒置荧光显微镜观察并拍照。
2 结果
2.1 Mor-platin的抗细胞增殖效应
采用细胞毒性实验CCK-8法,比较Mor-platin和cisplatin对人肝癌细胞HepG2的细胞增殖的影响。结果显示(图1),在两种药物作用下,细胞存活率随着药物剂量的增加而降低,具有剂量依赖性。Morplatin的半数抑制浓度为10.20 μg/mL,而cisplatin的半数抑制浓度是21.53 μg/mL,是Mor-platin的2倍多。此研究结果表明,药物浓度相同时,Mor-paltin会导致更多的细胞死亡,Mor-platin相比于cisplatin,具有更好的抗癌效果。

图1 Mor-platin和cisplatin对HepG2细胞的毒性实验Figure 1Cell viability of HepG2 cells treated with Mor-platin and cisplatin
2.2 Mor-platin线粒体靶向性
由于Mor-platin具有磷光,在激光共聚焦下显示红色,所以可以观察和追踪细胞内的Mor-platin。利用线粒体绿色荧光探针MTG将线粒体染成绿色,观察绿色的线粒体是否会与红色的Mor-platin重叠,以此来研究Mor-platin是否会靶向到线粒体中。由图2激光共聚焦图片得知,红色的Mor-platin与绿色的线粒体有重叠,重叠的部分显示黄色,pearson's相关系数超过0.8,说明Mor-platin能够靶向到线粒体中,与线粒体共定位。

图2 Mor-platin和MTG的激光共聚焦图片Figure 2Laser confocal images of cells incubated with Mor-platin and Mito-Tracker green
2.3 Mor-platin使线粒体形态发生变化
完整的线粒体形态是肿瘤细胞能量产生和生物合成所必需。Mor-platin靶向到线粒体后,是否会引起线粒体形态的变化,进而影响线粒体的功能。因此,运用电子显微镜观察Mor-platin对线粒体形态的影响。电子显微镜图片(图3)显示,无药物的对照组细胞的线粒体形态正常,具有完整的内外双层膜结构,线粒体嵴很多,而加入Mor-platin后细胞线粒体膜结构不完整,嵴不清晰或者消失,线粒体中出现大片空白区域,说明线粒体膜破坏后可能会导致线粒体中的蛋白丢失。

图3 有无Mor-platin处理后细胞线粒体的TEM图片Figure 3TEM micrographs of untreated cells as well as cells treated with 5.0 μg/mL Mor-platin for 24 h
2.4 Mor-platin对细胞凋亡的影响
Mor-platin对人肝癌细胞HepG2凋亡的影响用Annexin-V-FITC细胞凋亡检测试剂盒进行检测。研究结果显示,2.5、5和10 μg/mL Mor-platin导致的细胞凋亡数较少,与对照组相差较小,而20 μg/mL Morplatin能导致20%以上细胞凋亡,40 μg/mL Mor-platin能引起80%的细胞凋亡(图4)。
2.5 Mor-platin抑制三维肿瘤细胞球侵袭
前期研究发现Mor-platin能够抑制人肺癌细胞H1975细胞迁移,使用细胞划痕实验和Transwell实验加以验证,但是上述两种实验是在二维层面进行细胞迁移研究,在三维层面细胞的迁移行为也许会表现出不一样的效果[12-13]。因为动物细胞生长在三维环境中,有研究表明二维细胞模型不能够很好地模拟体内微环境[14-15]。三维细胞球模型由于可以调节细胞-细胞和细胞-细胞质间的相互作用[16],因此在肿瘤研究中,三维细胞球模型是体外测量早期肿瘤行为和毒性物质对肿瘤影响的金标准。本研究建立三维肿瘤细胞球模型并从细胞球面积的大小来估计细胞侵袭能力。研究结果显示,Mor-platin处理细胞24 h后,肿瘤细胞球的面积比没有加药物的对照组细胞球面积小,且随着剂量增加,肿瘤细胞球面积依次减小,说明Mor-platin能够抑制三维肿瘤细胞球侵袭(图5)。
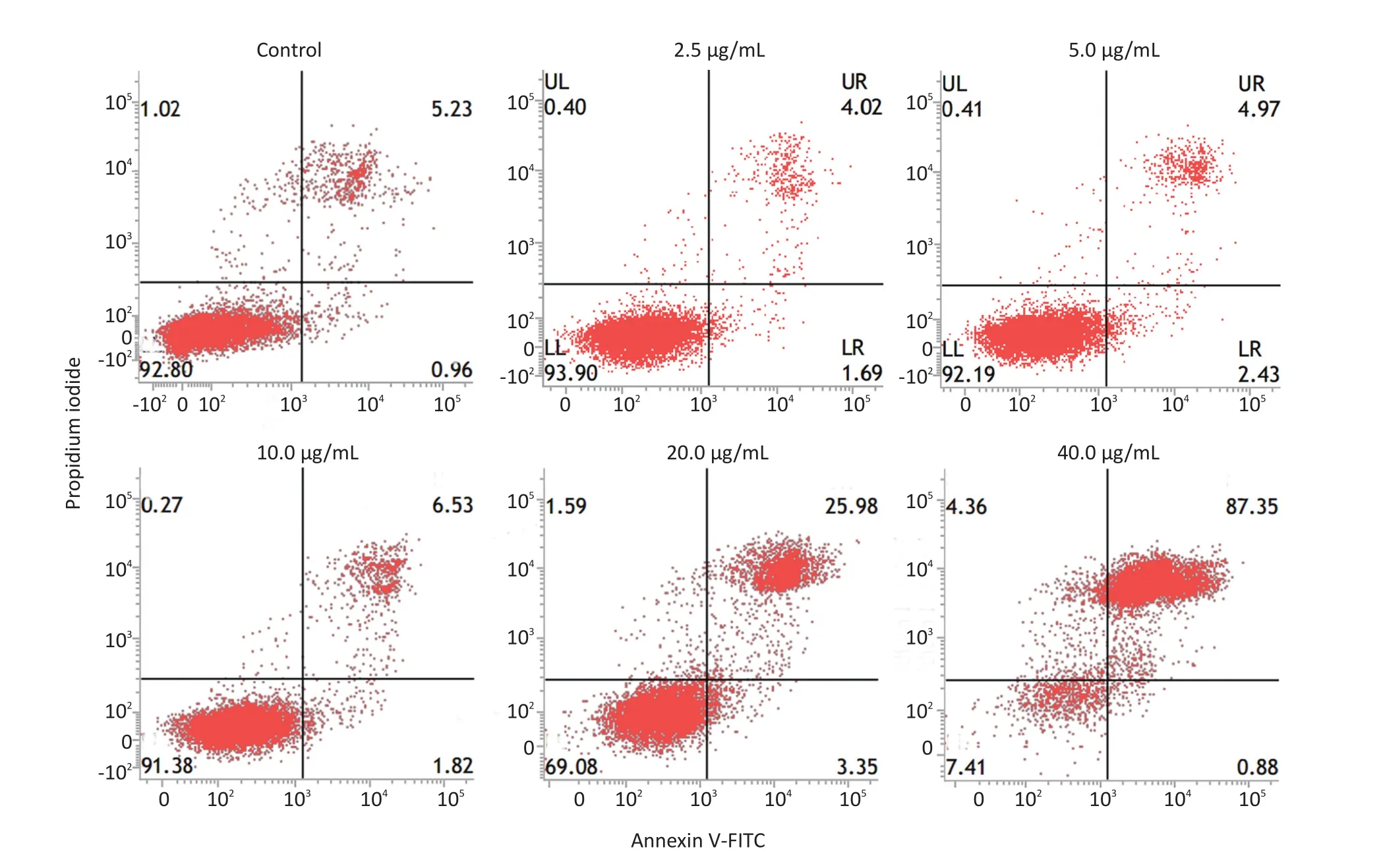
图4 Mor-platin对HepG2细胞凋亡的影响Figure 4Cell apoptosis of HepG2 cells by Mor-platin

图5 Mor-platin对三维细胞球的影响(100μm)Figure 5Mor-platin affected 3D cell's growth(100μm)
3 讨论
本研究结果显示,Mor-platin对HepG2的半数抑制浓度比cisplatin低,说明Mor-platin比cisplatin具有更好的抗癌效果。线粒体是真核细胞内有氧代谢的主要场所,为细胞的活动提供能量,在内源性细胞凋亡中也发挥着重要作用。自从Otto Warburg在上个世纪首次发现Warburg effect效应(即大多数肿瘤细胞通过产能率相对低的糖酵解为自身供能,而健康细胞是依靠线粒体氧化糖类分子释放能量)后,正常细胞和肿瘤细胞线粒体之间的显著差异陆续被发现[7,17-18]。由于线粒体密切参与肿瘤的发生发展过程,因此线粒体靶向性的抗肿瘤药物成为研究热点,并且对这些药物的抗癌机制也进行了研究[19-21]。本研究新合成的Mor-platin能够靶向到细胞线粒体中,从而在线粒体中富集。随之,使细胞线粒体形态发生变化,导致细胞凋亡。除此之外还发现,Mor-platin能够抑制三维肿瘤细胞球生长,从而验证Mor-platin能够抑制细胞侵袭,与之前的研究结果相符[10]。前期研究表明,Mor-platin对人肺癌细胞和人肝癌细胞具有相同的效果,并且从机制进行了解释,Mor-platin能够靶向细胞线粒体,造成线粒体损伤,最终导致细胞凋亡,本研究从肿瘤三维细胞球模型进一步验证Mor-platin可以抑制细胞侵袭,由此认为Mor-platin的作用可能为新的抗肿瘤药物研究提供思路。
[1]Todd RC,Lippard SJ.Inhibition of transcription by platinum antitumor compounds[J].Metallomics,2009,1(4):280-291.
[2]Rosenberg B,Vancamp L,Krigas T.Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode[J].Nature,1965,(205):698-699.
[3]Kelland L.The resurgence of platinum-based cancer chemotherapy[J].Nat Rev Cancer,2007,7(8):573-584.
[4]Scagliotti GV.PhaseⅢstudy comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J].J Clin Oncol,2008,26(21):3543-3551.
[5]Bruijnincx PC,Sadler PJ.New trends for metal complexes with anticancer activity[J].Curr Opin Chem Biol,2008,12(2):197-206.
[6]Modica-Napolitano JS,Singh KK.Mitochondrial dysfunction in cancer[J].Mitochondrion,2004,4(5-6):755-762.
[7]Kroemer G.Mitochondria in cancer[J].Oncogene,2006,25(34):4630-4632.
[8]Pedersen PL.Tumor mitochondria and the bioenergetics of cancer cells[J].Prog Exp Tumor Res,1978,(22):190-274.
[9]Park D,Dilda PJ.Mitochondria as targets in angiogenesis inhibition[J].Mol Asp Med,2010,31(1):113-131.
[10]Li JL,Cao JP,Chen CY,et al.The study of Mor-platin a new platinum complex that can induce apoptosis and inhibit migration[J].Chin Sci Bulletin,2017,62(4):270-278.[李菁玲,曹建平,陈春英,等.新型铂配合物Mor-platin导致细胞凋亡及抑制细胞迁移的研究[J].科学通报,2017,62(4):270-278]
[11]Guo Z,Tong WL,Chan MC.Luminescent oligo(ethylene glycol)-functionalized cyclometalated platinum(Ⅱ)complexes:cellular characterization and mitochondria-specific localization[J].Chem Commun,2014,50(14):1711-1714.
[12]Cukierman E,Pankov R,Stevens DR,et al.Taking cell-matrix adhesions to the third dimension[J].Science,2001,294(5547):1708-1712.
[13]Braga VM.Cell-cell adhesion and signalling[J].Curr pin Cell Biol,2002,14(5):546-556.
[14]Cukierman E,Pankov R,Stevens DR.Taking cell-matrix adhesions to the third dimension[J].Science,2001,294(5547):1708-1712.
[15]Lei KF,Wu ZM,Huang C.Impedimetric quantification of the formation process and the chemosensitivity of cancer cell colonies suspended in 3D environment[J].Biosens Bioelectron,2015,(74):878-885.
[16]Braga VM.Cell-cell adhesion and signalling[J].Curr Opin Cell Biol,2002,14(5):546-556.
[17]Modica-Napolitano JS,Singh KK.Mitochondrial dysfunction in cancer[J].Mitochondrion,2004,4(5-6):755-762.
[18]Pedersen PL.Tumor mitochondria and the bioenergetics of cancer cells[J].Prog Exp Tumor Res,1978,(22):190-274.
[19]Fulda S,Galluzzi L,Kroemer G.Targeting mitochondria for cancer therapy[J].Nature reviews Drug discovery,2010,9(6):447-464.
[20]Gogvadze V,Orrenius S,Zhivotovsky B.Mitochondria as targets for cancer chemotherapy[J].Semin Cancer Biol,2009,19(1):57-66.
[21]Zhang E,Zhang C,Su Y,et al.Newly developed strategies for multifunctional mitochondria-targeted agents in cancer therapy[J].Drug Discov Today,2011,16(3-4):140-146.
(2017-02-08收稿)
(2017-06-23修回)
(编辑:郑莉 校对:周晓颖)
A new mitochondria-targeted platinum complex Mor-platin inhibits HepG2 cell proliferation and cell invasion
Shuqun LI1,Qian CHEN1,Weijia LIAO1,Jun WENG1,Qingrong MO1,Jingling Li2,Yaqun YU1
Yaqun YU;E-mail:Yuyaqun0222@sina.com
1Department of Hepatobiliary and Pancreatic Surgery,Affiliated Hospital of Guilin Medical University,Guilin 541000,China;2Department of Medical Record Statistics Room,Affiliated Children's Hospital of Soochow University,Suzhou 215000,China
Objective:To investigate the effects of Mor-platin,a novel mitochondrial platinum complex,on proliferation and migration of human hepatoma carcinoma HepG2 cells.Methods:Cell counting kit-8(CCK-8)assay was used to analyze cell proliferation of Morplatin and classic anticancer drugs,particularly cisplatin,in HepG2 cells.A laser confocal microscope was used to observe whether Mor-platin can target mitochondria.The morphological changes in cellular mitochondria after treatment with Mor-platin were observed on a transmission electron microscope.Cell apoptosis was measured by flow cytometry,and cell invasion was evaluated by three-dimensional tumor spheroid model.Results:Mor-platin can inhibit cell proliferation and is dose dependent.The half inhibitory concentration(IC50)of Mor-platin is lower than that of cisplatin.Laser confocal images showed that Mor-platin can target cell mitochondria and enrich cell mitochondria.Transmission electron microscopy images showed that cell mitochondrial morphology changed after Mor-platin treatment.Furthermore,cell mitochondrial membrane is incomplete and mitochondrial cristae are reduced.Cell apoptosis caused by Mor-platin is dose dependent.The three-dimensional tumor spheroid model showed that the cell areas of the group subjected to Mor-platin treatment are smaller than those of the control group.Conclusion:Mor-platin can target cell mitochondria,change the cell mitochondrial morphology,inhibit cell proliferation,and thus promote cell apoptosis.It also showed better anticancer effects than cisplatin.Furthermore,Mor-platin can inhibit three-dimensional tumor spheroid invasion.These results suggest that Mor-platin is a potential antitumor drug.
cisplatin,mitochondria,anticancer drugs,human hepatoma carcinoma cells,cell proliferation,cell apoptosis,cell invasion

10.3969/j.issn.1000-8179.2017.15.136
①桂林医学院附属医院肝胆胰外科(广西壮族自治区桂林市541000);②苏州大学附属儿童医院病案统计室
*本文课题受国家自然科学基金项目(编号:81372163)和广西省自然科学基金项目(编号:2015GXNSFAA139111)资助
喻亚群Yuyaqun0222@sina.com
This work was supported by the National Natural Science Foundation of China(No.81372163)and the Natural Science Foundation of Guangxi(No.2015GXNSFAA139111)
李淑群专业方向为肝癌的诊治。
E-mail:lishuqun2008@126.com
