响应面法优化萌发藜麦芽乳发酵工艺
2017-09-03陈树俊徐晓霞张君梅李佳益王翠莲
陈树俊,石 玥,胡 洁,徐晓霞,李 乐,张君梅,李佳益,王翠莲
响应面法优化萌发藜麦芽乳发酵工艺
陈树俊,石 玥,胡 洁,徐晓霞,李 乐,张君梅,李佳益,王翠莲
(山西大学生命科学学院,山西 太原 030006)
以萌发藜麦芽为原料,研究发酵条件对藜麦芽发酵乳酸度和活菌数的影响。选用植物乳杆菌和干酪乳杆菌2 种混合菌进行发酵,通过单因素试验、响应面优化试验探究菌种比例、接种量和发酵时间对发酵的影响。结果表明,萌发藜麦芽乳混合菌发酵最佳工艺条件为植物乳杆菌和干酪乳杆菌比例2.5∶1、接种量3%、发酵时间10.3 h,得到的萌发藜麦芽发酵乳酸度为85.32 °T,活菌数为9.21(lg(CFU/mL)),与预测值吻合,表明萌发藜麦芽的匀浆发酵培养基适合乳酸菌生长。
藜麦芽乳;发酵工艺;酸度;活菌数;响应面法
藜麦(Chenopodium quinoa),又称南美藜、藜谷、奎奴亚藜等,原产于南美洲安第斯山区,归属藜科草本植物,已有5 000多年种植历史[1]。藜麦作为一种“类全谷物”被誉为“健康食品”[2],有预防肥胖、心血管疾病、糖尿病和癌症等功效[3]。与其他谷物相比,藜麦蛋白含量较高,几乎含有全部天然氨基酸,尤其是一般谷物中缺乏的赖氨酸和婴儿必需的组氨酸,与联合国粮食与农业组织推荐的理想蛋白相接近,并且比例平衡有益于吸收[4-6];富含钙、铁、锌、铜、镁、钾、硒等矿物质[7-8];藜麦中不饱和脂肪酸的比例达83%,藜麦中的抗氧化活性物质如VE等同时维持了这些不饱和脂肪酸的稳定性[9-10]。藜麦中酚类物质等功能成分远高于其他谷物[11-12],具有良好开发利用前景。藜麦种子极易萌发,其营养成分也会随之改变。苗灵香[13]研究发现淀粉和脂肪在藜麦萌发过程中含量下降,蛋白质和可溶性糖含量随着萌发时间的延长在合成和消耗的双重作用下不断变化,总体呈上升趋势,同时藜麦中活性物质黄酮、多酚随着萌发含量增加,与Pasko等[14]研究结果一致。
谷类食物自古以来就是中国传统膳食主体,随着人们生活水平提高,营养健康意识增强,谷物饮料已成为饮料行业发展的新机遇[15]。通过现代加工工艺制成的益生菌发酵谷物饮料,既保存了谷物原有营养价值,又具有益生菌发酵制品的保健作用,风味良好,口感独特,对人体有明显的营养保健作用,如改善肠道内菌群[16]、预防肠道疾病[17]、降低胆固醇水平等[18],并且经过发酵后,营养成分更容易被人体消化吸收[19]。藜麦目前在食品中的应用主要有早餐粥、藜麦粉、甜点等形式[20],但对藜麦及藜麦芽的发酵工艺研究鲜见报道。藜麦芽乳经过发酵,其中的营养成分如蛋白质、淀粉等大分子物质部分被分解为小分子,可以增加游离氨基酸消化率,同时提高淀粉消化率,有助于调节人体血糖变化。除此之外,在发酵过程中藜麦芽乳的活性物质成分得到释放和利用,如多酚含量的增加,可以使抗氧化能力得到一定程度的提高。本实验旨在探索萌发藜麦芽乳最佳发酵工艺,为藜麦食品研发提供理论依据。
1 材料与方法
1.1 材料与试剂
藜麦 山西稼祺农业科技有限公司;植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(L. casei)、瑞士乳杆菌(L. helveticus) 中国菌种保藏中心;MRS琼脂 北京索莱宝科技有限公司。
1.2 仪器与设备
SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;JYL-c010料理机 九阳股份有限公司;XL-600B多功能粉碎机 小宝电器有限公司;SC-3610低速离心机 安徽中科中佳仪器有限公司;HRHS24电热恒温水浴锅 青岛海尔医用低温科技有限公司;YXQ-LS-75SII全自动高压灭菌锅 上海博讯实业有限公司医疗设备厂;HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;FE20实验室pH计 上海梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 藜麦芽乳制作的工艺流程
藜麦种子→过60 目筛、挑选→浸泡→萌发→收芽→清洗→冷冻干燥→粉碎→磨浆→糊化→灭菌→冷却→接种→保温发酵→成品→检验
1.3.2 工艺操作要点
藜麦种子:要求新鲜、饱满。
过筛、挑选:将新鲜、饱满的藜麦种子过60 目筛,同时经细致挑选去除杂质。
萌发、收芽:在白磁盘内铺两层滤纸,蒸馏水浸湿,藜麦均匀平铺在滤纸上,放入30 ℃恒温恒湿培养箱中培养,使其萌发,24 h后收集藜麦芽。
冷冻干燥、粉碎:将清洗后的藜麦芽预冻24 h,放入真空冷冻干燥机中冻干至水分含量不大于6%,24 h后取出并粉碎低温保藏。
磨浆:用藜麦芽粉与60 ℃蒸馏水以1∶6(g/mL)比例混合,磨浆1.5 min。以蛋白提取率为指标得到最佳磨浆工艺,在此磨浆条件下制得的藜麦芽乳蛋白含量高达2.056 g/100 mL。
糊化:将经过磨浆的藜麦芽乳置于80 ℃水浴锅中糊化50 min。经过糊化工艺,藜麦芽乳中还原糖含量提高至3.345 g/100 mL。
灭菌、冷却:将经过糊化的藜麦芽乳,121 ℃高压灭菌20 min,待冷却。
接种:将植物乳杆菌和干酪乳杆菌按体积比2∶1,以3%的接种量接种。
保温发酵:在37 ℃恒温恒湿培养箱中进行发酵培养,培养时间10 h。
1.3.3 指标测定
1.3.3.1 pH值的测定
采用实验室精密pH计测定。
1.3.3.2 酸度的测定
参照GB 5413.34—2010《乳和乳制品酸度的测定》。
1.3.3.3 活菌数的测定
将发酵菌株接种到谷物原料中,发酵到一定时间取0.5 mL菌悬液用4.5 mL灭菌生理盐水稀释至适当倍数后,采用MRS固体培养基,37 ℃需氧培养48 h,计算其活菌数。
1.3.4 单因素试验
以活菌数和酸度为指标,考察菌种比例(植物乳杆菌和干酪乳杆菌体积比1∶1、1∶2、1∶3、2∶1、3∶1)、接种量(1%、2%、3%、4%、5%)和发酵时间(8、9、10、11、12 h)3 个因素对发酵效果的影响。采用控制变量法,其中发酵的初始条件为菌种比例2∶1、接种量3%、发酵时间10 h。
1.3.5 响应面优化试验
基于单因素试验结果,依据Box-Behnken试验设计原理,考察因素之间的交互作用并得到最佳发酵工艺条件。以活菌数和酸度为响应值,设计三因素三水平的试验见表1。

表1 响应面试验因素及水平Table 1 Codes and levels of independent variables used for response surface analysis
1.4 数据处理
每组实验重复3 次,数据均以平均值表示。实验图表采用Origin 6.0绘制,响应面试验设计与分析采用Design-Expert 8.0软件。
2 结果与分析
2.1 菌种选择
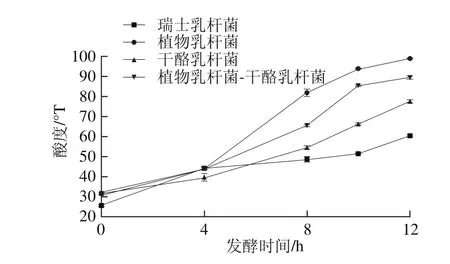
图1 不同菌种对酸度的影响Fig. 1 Effect of different tarter cultures on acidity
由图1可知,单一菌种发酵的产酸能力排序为植物乳杆菌>干酪乳杆菌>瑞士乳杆菌,从产酸能力上来看,瑞士乳杆菌与其他两菌种相比明显不占优势,考虑放弃使用。将植物乳杆菌与干酪乳杆菌按2∶1比例混合接种,产酸能力得到提高,且使得发酵到12 h酸度低于植物乳杆菌单独发酵酸度,酸度达到适宜范围。适宜的酸度不仅有利于提升口感,还可以有效地提高乳酸菌活菌数,提升益生功能。

图2 不同菌种对活菌数的影响Fig. 2 Effect of different starter cultures on viable count
由图2可知,单一植物乳杆菌发酵产品活菌数比干酪乳杆菌高,混合菌发酵产品活菌数略大于单菌发酵活菌数,生长情况良好,说明植物乳杆菌和干酪乳杆菌具有协同作用,可以促进彼此生长[21],且产生酸度适宜。
2.2 单因素试验结果
2.2.1 菌种比例对发酵的影响
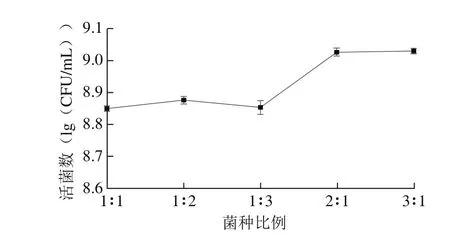
图3 菌种比例对活菌数的影响Fig. 3 Effect of starter culture composition on viable count
从图3不同比例混合菌发酵情况来看,随着干酪乳杆菌含量增多,活菌数对数值明显减少,当植物乳杆菌与干酪乳杆菌比例为2∶1和3∶1时,活菌数达到最高,与其他比例有极显著差异(P<0.01),且2∶1与3∶1之间无显著差异(P>0.05)。随干酪乳杆菌比例增加,体系产酸能力降低,影响活菌生长速率从而使活菌数较低。随植物乳杆菌比例增加,酸度上升较快,在适宜酸度下活菌生长速率提升,活菌数上升。而酸度过高活菌数受到抑制,出现逐渐平缓甚至下降的趋势。
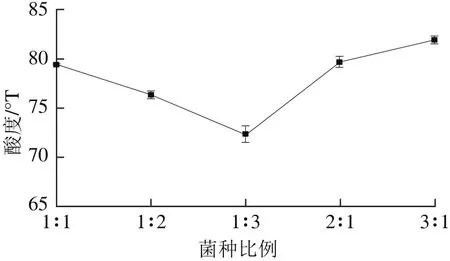
图4 菌种比例对酸度的影响Fig. 4 Effect of starter culture composition on acidity
混合菌不仅可以提高活菌数,对于产品的酸度风味等方面也有不同影响[22-23]。随着干酪乳杆菌比例增多,发酵培养基酸度呈现降低趋势。在菌种比例为2∶1时,发酵培养基酸度可达到79 °T,与3∶1达到的酸度已无显著差异(P>0.05),同时发酵培养基酸度在菌种比例为1∶1、1∶2、1∶3之间有显著性差异(P<0.05),但2∶1与1∶1无显著性差异(P>0.05)。出现此情况的原因可能是植物乳杆菌产酸能力高于干酪乳杆菌,所以活菌数增长速率大于干酪乳杆菌。随着干酪乳杆菌比例增多,混合菌活菌数的增长速率降低,产酸能力也随之降低。综合菌种比例对两指标的影响,选择植物乳杆菌与干酪乳杆菌的比例为2∶1进行后续试验。
2.2.2 接种量对发酵的影响
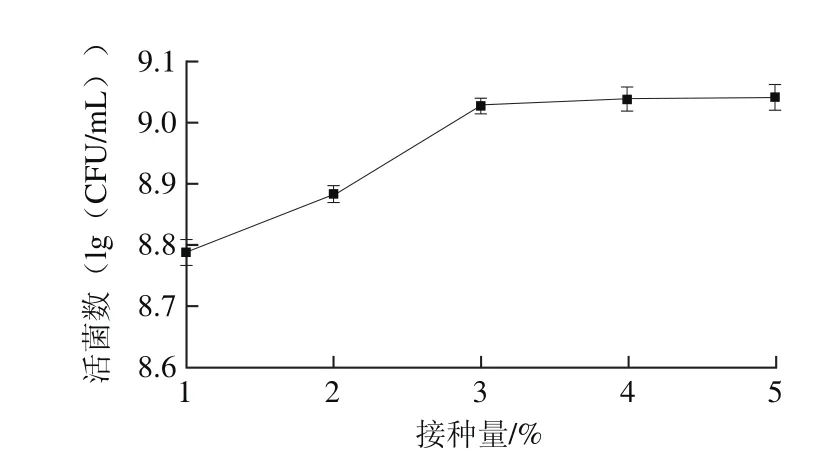

图5 接种量对活菌数的影响Fig. 5 Effect of inoculum concentration on viable count
接种量对菌体的活菌数有一定影响,过大或过小都不利于发酵过程的进行[24]。由图5可知,随着接种量增加,活菌数呈现上升趋势,当接种量达到3%之后,随着接种量增大,活菌数对数值显示无显著差异(P>0.05),说明接种量3%时发酵到10 h时,植物乳杆菌和干酪乳杆菌生长已经进入稳定期,活菌数已达到稳定值,增加接种量没有明显变化。由图6可知,当接种量达到3%之后,酸度增长不显著(P>0.05),符合活菌数变化趋势。综合图5、6可知接种量对活菌数和酸度的影响,选择接种量为3%进行后续试验。
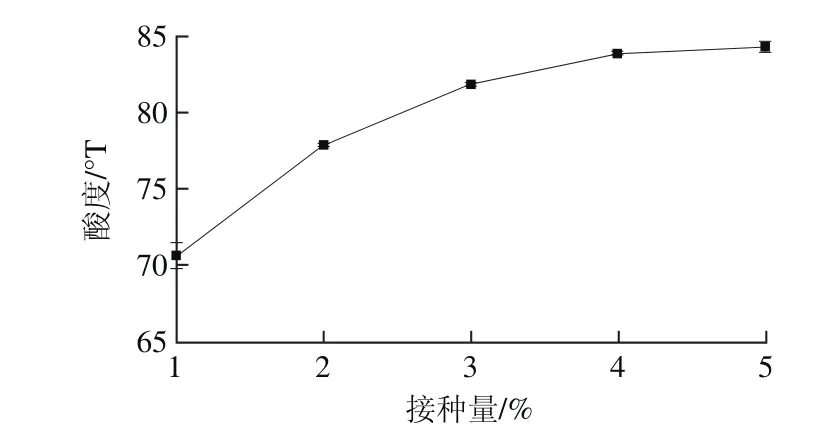
图6 接种量对酸度的影响Fig. 6 Effect of inoculum concentration on acidity
2.2.3 发酵时间对发酵的影响
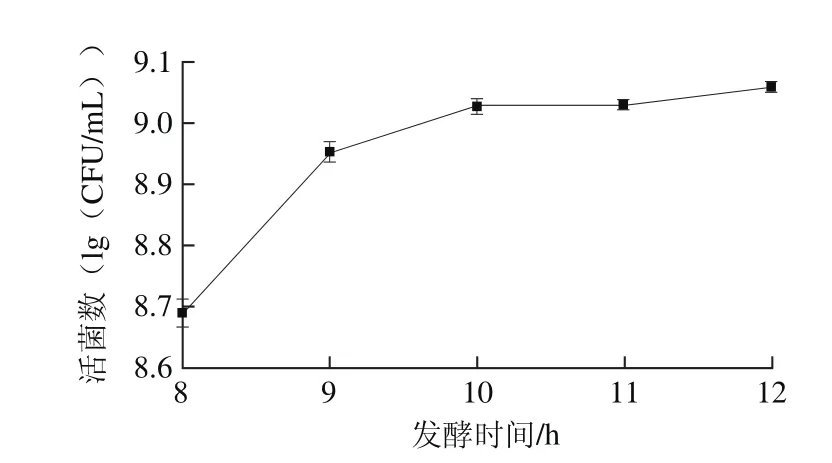

图7 发酵时间对活菌数的影响Fig. 7 Effect of fermentation time on viable count
由图7可知,随着发酵时间延长,活菌数呈现上升趋势,当发酵时间达到10 h之后,活菌数变化呈不显著(P>0.05),说明发酵10~12 h,复合菌在发酵培养基中生长已经进入稳定期,达到稳定状态,与杨杰[25]和王刚[26]等的研究结果一致。
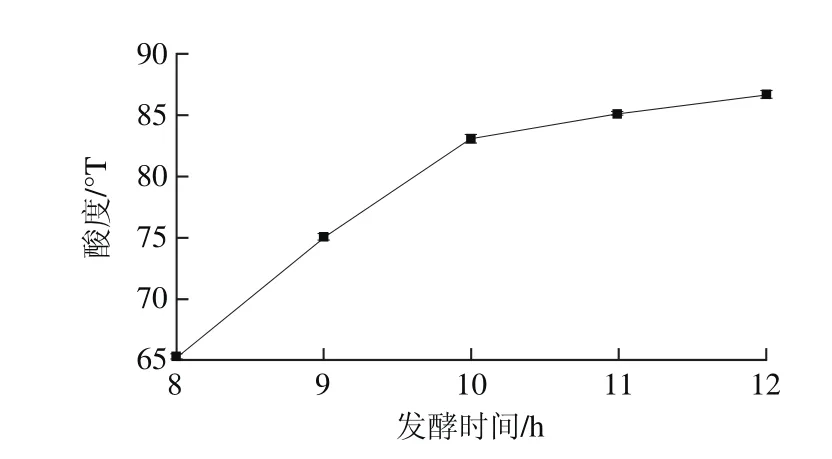
图8 发酵时间对酸度的影响Fig. 8 Effect of fermentation time on acidity
由图8可知,随着发酵时间的延长,pH值逐渐降低,酸度逐渐升高,且有显著性差异(P<0.05)。可能是益生菌在发酵过程中不断利用发酵基质中的营养物质产酸,乳酸累积使酸度上升。酸度变化到10 h基本稳定,随时间延长略有增加,基本已经呈现平缓趋势。综合发酵时间对各指标影响,选择发酵时间为10 h进行后续试验。
2.3 藜麦芽发酵乳发酵条件响应面优化结果
2.3.1 响应面试验设计与结果
为了确定藜麦芽发酵乳最佳发酵条件,选择菌种比例、接种量与发酵时间3 个因素,以活菌数和酸度为评价指标进行响应面回归分析,Box-Behnken试验设计及结果如表2所示。
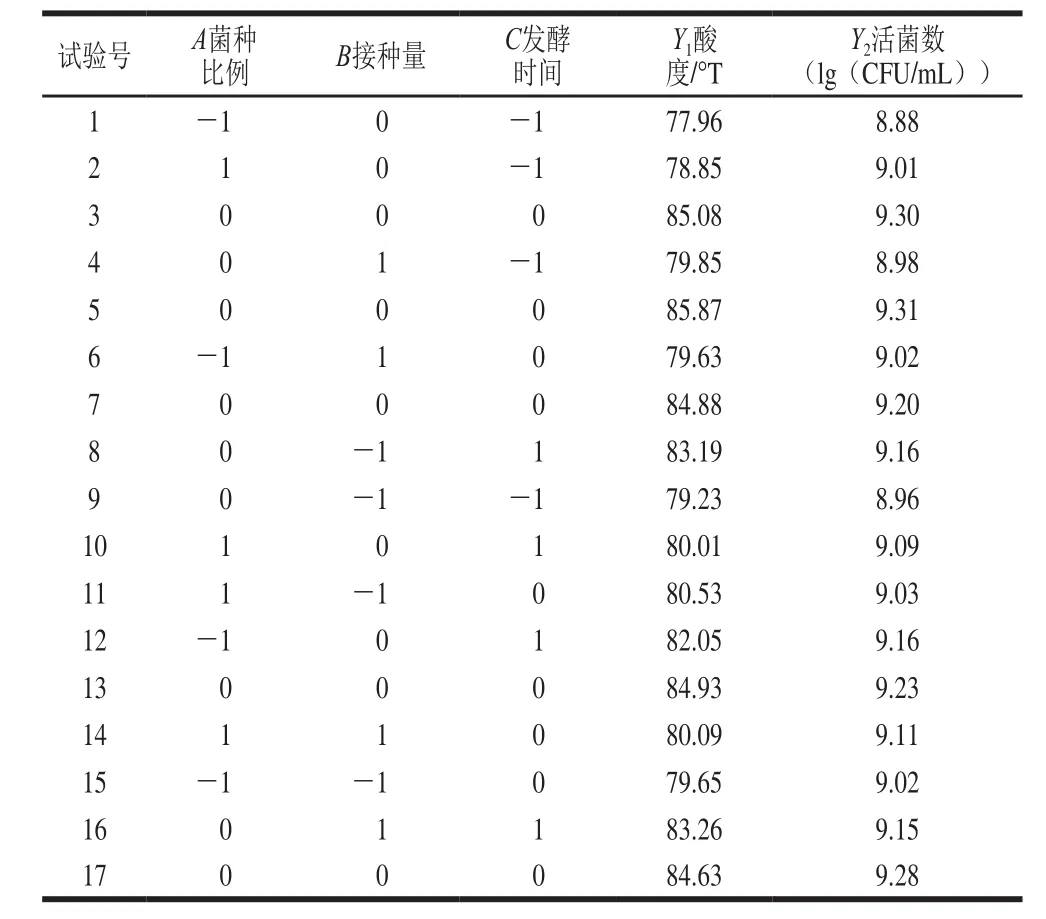
表2 响应面试验设计及结果Table 2 Experimental designs and results for response surface analysis
2.3.2 回归方程及参数分析
利用Design-Expert 8.0软件对表的数据进行二次多元回归拟合,分别得到各个因素对样品活菌数和酸度两个指标的二次回归方程分别如下:
Y1=85.08+0.024A+0.029B+1.58C-0.11AB-0.73AC-0.14BC-3.38A2-1.72B2-1.98C2(R2=0.978 2,=0.950 1)
Y2=9.26+0.02A+0.011B+0.091C+0.02AB-0.05AC-7.5×10-3BC-0.12A2-0.096B2-0.11C2(R2=0.962 4,0.939 8)
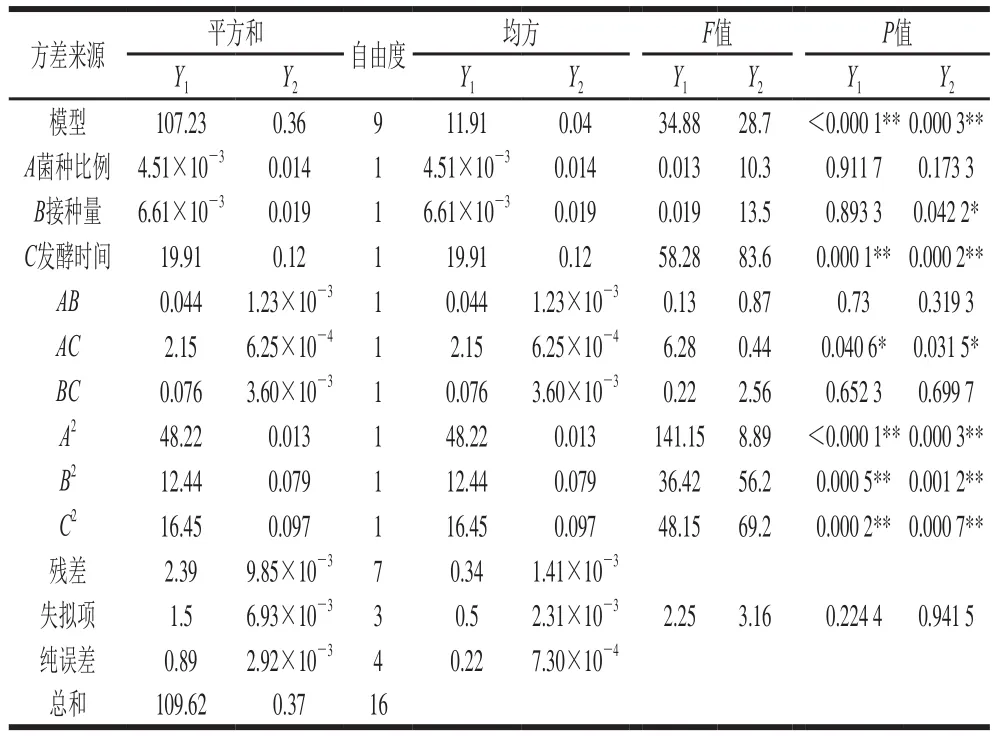
表3 回归方程方差分析Table 3 Analysis of variance of regression model
由表3可知,失拟项不显著(P=0.224 4>0.05),模型的P值小于0.000 1,表明模型极显著;软件分析的复相关系数R2为97.82%(96.24%),校正后为95.01%(91.41%),表明模型拟合程度良好,试验误差小,该模型成立,可以用此模型进行分析和预测。模型方差分析结果如表3所示,根据表3中给出F值大小,可以判断3 个因素对两个响应值影响的主次顺序,其中,影响样品酸度因素主次为C>B>A,影响样品活菌数因素主次为C>B>A;再观察各响应值P值变化,从P值可以了解到,C、A2、B2、C2对样品酸度有极显著影响(P<0.01),AC对酸度有显著影响(P<0.05);C、A2、B2、C2对样品活菌数有极显著影响(P<0.01),B、AC对样品活菌数有显著影响(P<0.05)。
2.3.3 响应面优化及分析
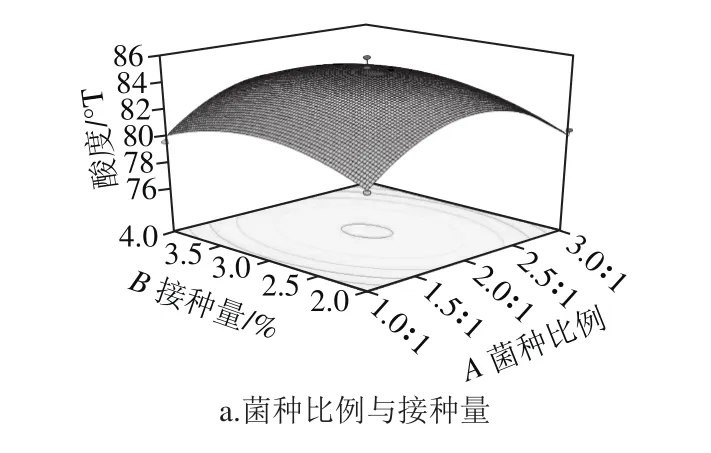
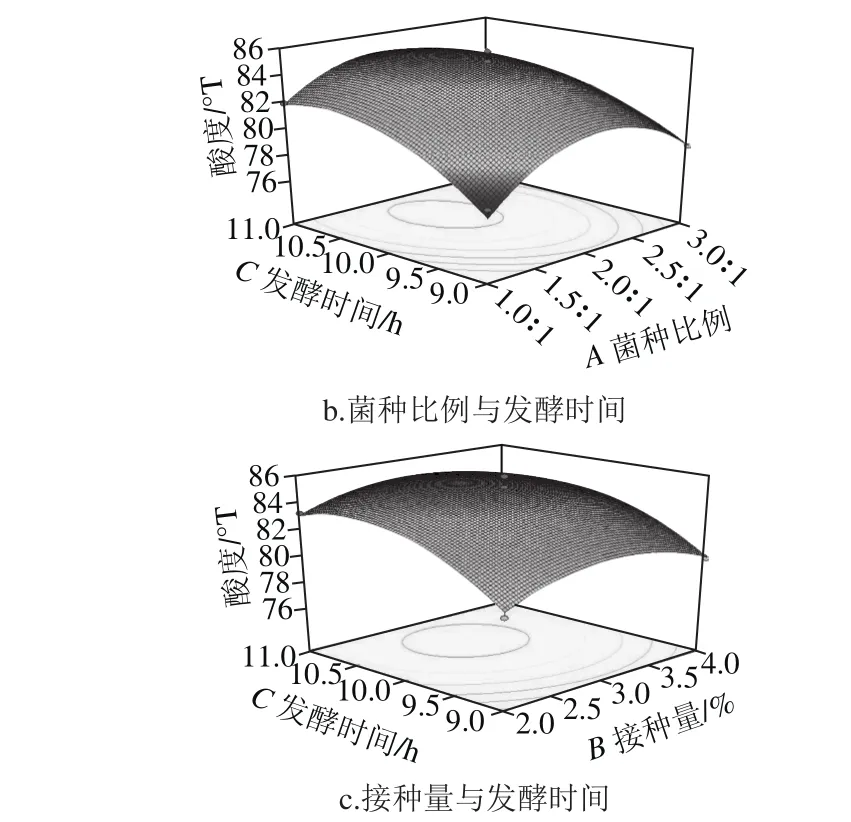
图9 三因素交互作用对藜麦芽发酵乳酸度的影响Fig. 9 Surface response plots showing the effect of three factors on acidity
2.3.3.1 三因素交互作用对样品酸度的影响由图9a可知,随着接种量和菌种比例增加,酸度先增加后减少。由图9b可知,在以接种量为中心水平值时,样品酸度随着发酵时间延长而呈现先上升再趋于平缓趋势,图9b中等高线呈椭圆形,表明菌种比例与发酵时间交互作用显著。同样在图9c中样品酸度随发酵时间延长呈先上升再平缓趋势,随着菌种比例增加,酸度先上升后下降。菌种比例增加,会使植物乳杆菌在接种菌液中所占比例大大增加,而植物乳杆菌前期产酸速率较快,因此会使得发酵培养基pH值降低速率偏快,随发酵时间延长,pH值越来越小,以至到后期活菌数会受到抑制,从而导致了酸度降低的可能。接种量与菌种比例影响方式类似,随着接种量增加,乳酸菌在发酵前期迅速增长,产酸速率快,到发酵后期使得活菌生长受到抑制,从而使酸度降低。
2.3.3.2 三因素交互作用对样品活菌数的影响
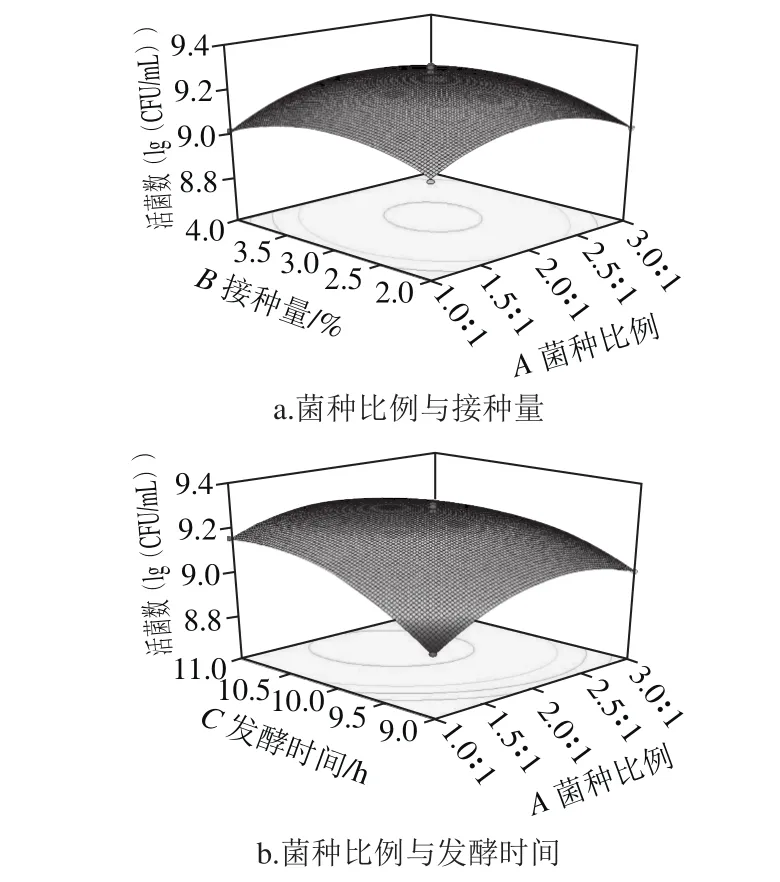
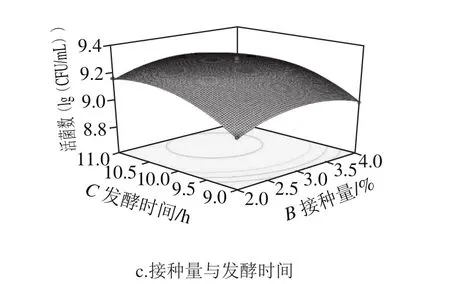
图10 三因素交互作用对藜麦芽发酵乳活菌数的影响Fig. 10 Surface response plots showing the effect of three factors on viable count
如图10a所示,样品活菌数随接种量和菌种比例增大均呈现先增加后减少趋势;在接种量为中心水平时,菌种比例和发酵时间的交互影响如图10b所示,随着发酵时间变化,响应面坡度较大,说明活菌数受发酵时间影响较大,并且活菌数随着发酵时间延长先增高后基本不变,到11 h略有下降;在图10c中,活菌数随着发酵时间和接种量增加先增大后缓慢减小,而且发酵时间对活菌数影响更加显著。随着菌种比例和接种量增加,使发酵培养基在发酵前期产酸速率加快,随着发酵时间的增长,pH值越来越小,过酸环境不利于乳酸菌生长,从而导致发酵时间越长,活菌数呈现下降趋势,因此酸度也会跟着下降,与酸度响应面分析结果一致。
2.3.4 最佳发酵工艺条件的确定
对发酵产品评价指标来说,酸度范围适宜情况下,酸度越高,活菌数越高说明产品质量越高。通过Design-Expert 8.0软件分析,得到发酵最佳工艺条件为:植物乳杆菌和干酪乳杆菌比例2.42∶1、接种量3.04%、发酵时间10.33 h,在该工艺条件下,萌发藜麦芽发酵乳酸度理论值可达84.70 °T,活菌数可达9.26(lg(CFU/mL))。考虑到实验实际操作,将最优工艺条件调整为:植物乳杆菌和干酪乳杆菌比例2.5∶1、接种量3%、发酵时间10.3 h。为检验响应面法所得结果可靠性,采用调整得到最优发酵工艺条件,经过3次平行实验,实际测得萌发藜麦芽发酵乳酸度为85.32 °T,活菌数为9.21(lg(CFU/mL)),其相对误差小于1%,说明回归模型的拟合度较高,可以利用响应面法对萌发藜麦芽发酵乳发酵工艺进行优化。
3 结 论
以藜麦芽乳为原料,通过接种植物乳杆菌和干酪乳杆菌进行混菌发酵,研究菌种比例、接种量和发酵时间对藜麦芽乳酸度和活菌数影响,确定最佳发酵工艺。通过Box-Behnken试验,建立混菌发酵藜麦芽乳最佳工艺条件数学模型。结果表明对酸度和活菌数影响最大因素为发酵时间。经回归分析及实际操作可行性,确定藜麦芽乳混菌发酵最佳参数为植物乳杆菌和干酪乳杆菌比例2.5∶1、接种量3%、发酵时间10.3 h,在此发酵条件下测得萌发藜麦芽发酵乳酸度为85.32 °T,活菌数为9.21(lg(CFU/mL))。
经过萌发的藜麦芽乳中还原糖含量较高,正好为乳酸菌在其中生长提供条件,采用混菌发酵可以改变藜麦芽乳体系,还原糖含量由4.002 g/100 mL降低至3.702 g/100 mL,多酚含量由0.570 mg/mL增加至0.587 mg/mL,减少的还原糖可能产生了有机酸[27],多酚含量增加可以提高藜麦芽乳的抗氧化能力。蛋白质、淀粉和脂肪在发酵前后含量变化不明显,主要是因为乳酸菌在生长过程中可利用的营养物质类型有限。发酵后,藜麦芽乳中的黄酮含量由0.294 mg/mL降低至0.036 mg/mL,原因可能是藜麦中的黄酮类化合物在自然状态下不是很稳定,在发酵过程中,乳酸菌在一定温度和多酚氧化酶等的作用下发生转化或者降解。经过发酵的藜麦芽乳口感得到改善,更适宜人体消化吸收,在谷物饮料创新发展领域具有良好的应用前景。
[1] 肖正春, 张广伦. 藜麦及其资源开发利用[J]. 中国野生植物资源, 2014, 33(2): 62-66. DOI:10.3969/j.issn.1006-9690.2014.02.015.
[2] 魏志敏, 李顺国, 夏雪岩, 等. 藜麦的特性及其发展建议[J]. 河北农业科学, 2016, 20(5): 14-17.
[3] 谭斌, 谭洪卓, 刘明, 等. 粮食(全谷物)的营养与健康[J]. 中国粮油学报, 2010, 25(4): 100-107.
[4] 雷洁琼. 藜麦功能成分研究及利用[J]. 青海畜牧兽医杂志, 2016, 46(3): 42-47. DOI:10.3969/j.issn.1003-7950.2016.03.020.
[5] GONZALEZ J A, KONISHI Y, BRUNO M, et al. Interrelationships among seed yield, total protein and amino acid composition of ten quinoa (Chernopodium quinoa) cultivars from two different agroecological regions[J]. Journal of the Science of Food & Agriculture, 2012, 92(6): 1222-1229. DOI:10.1002/jsfa.4686.
[6] NOWAK V, DU J, CHARRONDIÈRE U R. Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.)[J].Food Chemistry, 2016, 193: 47-54. DOI:10.1016/ j.foodchem.2015.02.111.
[7] BHARGRVA A, SHUKLA S, OHRI D. Chenopodium quinoa: an Indian perspective[J]. Industrial Crops and Products, 2006, 23(1): 73-87. DOI:10.1016/j.indcrop.2005.04.002.
[8] ABUGOCH J L E. Quinoa (Chenopodium quinoa Willd.): composition, chemistry, nutritional, and functional properties[J]. Advances in Food and Nutrition Research, 2009, 58: 1-31. DOI:10.1016/S1043-4526(09)58001-1.
[9] VEGA-GÁLVEZ A, MIRABDA M, VERGARA J, et al. Nutrition facts and functional potential of quinoa (Chenopodium quinoa Willd.), an ancient Andean grain: a review[J]. Journal of the Science of Food & Agriculture, 2010, 90(15): 2541-2547. DOI:10.1002/jsfa.4158.
[10] YOUDIM K A, MARTIN A, JOSEPH J A. Essential fatty acids and the brain: possible health implications[J]. International Journal of Developmental Neuroscience, 2000, 18(4/5): 383-399. DOI:10.1016/ S0736-5748(00)00013-7.
[11] ALVAREZ-JUBETE L, WIJNGAARD H, ARENDT E K, et a1. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa, buckwheat and wheat as affected by sprouting and backing[J]. Food Chemistry, 2010, 119(2): 770-778. DOI:10.1016/ j.foodchem.2009.07.032.
[12] HIROSE Y, FUJITA T, ISHIII T, et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J]. Food Chemistry, 2010, 119(4): 1300-1306. DOI:10.1016/ j.foodchem.2009.09.008.
[13] 苗灵香. 萌发藜麦成分动态分析及其多酚的研究[D]. 晋中: 山西农业大学, 2015.
[14] PASKO P, BARTON H, ZAGRODZKI P, et al. Anthocyanins, total polyphenol composition and in vitro antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J]. Food Chemistry, 2009, 155(3): 994-998. DOI:10.1016/j.foodchem.2009.01.037.
[15] 姬万里, 庞玉艳. 玉米在饮料工业中的应用[J]. 黑龙江农业科学, 2010(3): 126-127. DOI:10.3969/j.issn.1002-2767.2010.03.045.
[16] 曹振辉, 刘永仕, 潘洪彬, 等. 乳酸菌的益生功能及作用机制研究进展[J]. 食品工业科技, 2015, 36(24): 366-370; 377. DOI:10.13386/ j.issn1002-0306.2015.24.072.
[17] 董懿樱, 陈臣, 任婧, 等. 乳酸菌对肠免疫调节功能研究进展[J].中国微生态学杂志, 2014, 26(2): 221-224; 242. DOI:10.13381/j.cnki. cjm.201402027.
[18] 国立东, 王丽群, 蒋琛, 等. 乳酸菌调控体内胆固醇代谢综述[J]. 中国乳品工业, 2016, 42(2): 32-36. DOI:10.3969/j.issn.1001-2230.2016.02.007.
[19] 安莉. LB、ST和LA混菌发酵酸乳的研究[D]. 西安: 陕西科技大学, 2010.
[20] 王黎明, 马宁, 李颂, 等. 藜麦的营养价值及其应用前景[J]. 食品工业科技, 2014, 35(1): 381-384; 389. DOI:10.13386/j.issn1002-0306.2014.01.007.
[21] 刘芸, 刘波, 朱育菁, 等. 黑豆酸奶发酵微生物鉴定与发酵特性的研究[J]. 福建农业学报, 2011, 26(3): 450-456. DOI:10.3969/ j.issn.1008-0384.2011.03.023.
[22] 王振强, 申森. 利用瑞士乳杆菌制作酸奶的研究[J]. 食品研究与开发, 2007, 28(6): 91-94. DOI:10.3969/j.issn.1005-6521.2007.06.027.
[23] 王玉华, 王立梅, 陈小平, 等. 嗜酸乳杆菌酸奶的研制[J]. 吉林农业大学学报, 2002, 24(4): 113-115. DOI:10.3969/j.issn.1000-5684.2002.04.029.
[24] 周小莉, 王淼. 乳酸菌在燕麦基质中生长特性的研究[J]. 食品与发酵工业, 2011, 37(9): 64-69.
[25] 杨杰, 谷新晰, 李晨, 等. 响应面法优化植物乳杆菌绿豆乳增殖培养基[J]. 中国食品学报, 2015, 15(12): 83-90.
[26] 王刚, 杭锋, 邢家溧, 等. 干酪乳杆菌CCFM1566发酵制备麦芽乳酸菌饮料的工艺研究[J]. 中国乳品工业, 2013, 41(12): 4-7. DOI:10.3969/j.issn.1001-2230.2013.12.001.
[27] 李琦, 张兰威, 张英春, 等. 高效液相色谱法测定发酵乳中的乳糖、葡萄糖和半乳糖[J]. 食品科学, 2012, 33(4): 162-166. DOI:10.7666/ d.y1799232.
Process Optimization by Response Surface Methodology for the Development of a Beverage Based on Lactic Acid Fermentation of Quinoa Malt
CHEN Shujun, SHI Yue, HU Jie, XU Xiaoxia, LI Le, ZHANG Junmei, LI Jiayi, WANG Cuilian
(College of Life Science, Shanxi University, Taiyuan 030006, China)
The purpose of this study was to investigate the effect of fermentation conditions on the acidity and viable bacterial count of a beverage developed from quinoa malt fermented with lactic acid bacteria. Mixed starter cultures of Lactobacillus plantarum and Lactobacillus casei were used for the fermentation. One-factor-at-a-time method and response surface methodology were used to explore the effect of starter culture composition, inoculum amount and fermentation time on fermentation. A ratio of L. plantarum to L. casei of 2.5:1, an inoculum amount of 3% and a fermentation time of 10.3 h were found to be optimal. Under these conditions, the acidity of fermented quinoa malt was 85.32 °T and the viable count was 9.21 (lg(CFU/mL)), which were in good agreement with the predicted values. The result showed that homogenized quinoa malt was suitable for the growth of lactic acid bacteria.
quinoa malt; fermentation process; lactic acidity; viable count; response surface methodology
10.7506/spkx1002-6630-201716010
TS252.54
A
1002-6630(2017)16-0064-07
陈树俊, 石玥, 胡洁, 等. 响应面法优化萌发藜麦芽乳发酵工艺[J]. 食品科学, 2017, 38(16): 64-70. DOI:10.7506/ spkx1002-6630-201716010. http://www.spkx.net.cn
CHEN Shujun, SHI Yue, HU Jie, et al. Process optimization by response surface methodology for the development of a beverage based on lactic acid fermentation of quinoa malt[J]. Food Science, 2017, 38(16): 64-70. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716010. http://www.spkx.net.cn
2016-11-10
山西省重点研发计划项目(201603D221033-1)
陈树俊(1964—),男,副教授,学士,研究方向为食品新工艺与功能食品。E-mail:chenshujun515@163.com
