玻璃酸钠对兔骨关节炎早期iNOS炎症途径及炎性细胞因子表达影响的实验研究*
2017-09-03韦卓袁冰马琴刘平姚弘毅阮锋
韦卓袁冰马琴*刘平姚弘毅阮锋
玻璃酸钠对兔骨关节炎早期iNOS炎症途径及炎性细胞因子表达影响的实验研究*
韦卓1袁冰1马琴1*刘平1姚弘毅2阮锋1
目的探讨骨关节炎(OA)早期病理生理变化中一氧化氮合酶(iNOS)、一氧化氮(NO)和炎症性细胞因子(如IL-6、和IL-17)表达水平的相关性,以及玻璃酸钠腔内注射对OA早期iNOS炎症途径和炎性细胞因子的影响。方法48只新西兰大白兔随机分为三组,分别为空白对照组、模型组和玻璃酸钠治疗组,模型组和玻璃酸纳治疗组前交叉韧带切断制备兔膝骨关节炎软骨退行性病变(ACLT)模型。造模四周后玻璃酸钠治疗组给予玻璃酸钠0.3mg/(只·次),关节内重复注射每周一次,连续4周。模型组以相同方式注射等体积的生理盐水。造模8周后处死动物,行关节腔大体观察、软骨组织学观察;采用试剂盒检测血清和关节腔内iNOS、NO的表达量;采用ELISA法对关节腔内IL-6、和IL-17等细胞因子进行检测。结果经玻璃酸钠治疗4周后,血清和关节腔内iNOS、NO和IL-6、以及IL-17的表达量显著性下降,且具有一定相关性;HE染色和病理学评分结果表明,玻璃酸钠治疗软骨能显著改善关节软骨的退变进程。结论在OA早期的发病历程中,NO的合成与炎症性细胞因子表达呈正相关,且玻璃酸钠可能通过抑制iNOS途径来阻断NO的产生,发挥保护关节软骨的作用。
骨关节炎;玻璃酸钠;一氧化氮;细胞因子
骨关节炎(osteoarthritis,OA)多发于中老年人群,主要病理特点为关节软骨的退变[1,2],临床以骨关节的反复疼痛、肿胀为主要表现,严重影响了患者的生活质量,是最常见的关节疾病之一[3,4]。随着我国老龄化人群逐渐增加,OA的患病率已近8.5%,形势不容乐观。目前OA的发病机制仍不清楚,临床上并无有效的治疗药物。因此,探讨OA可能的发病机制以及找到安全、有效的药物来应用于临床是目前防治OA最迫在眉睫的事。
近年来国内外学者研究发现,iNOS炎症途径在OA的发病历程中起着非常重要的作用[5]。在OA的发病环节中,炎性因子是造成软骨基质降解的最直接病因,软骨退变与炎症之间相互促进,共同加速OA病情进展。而早期OA的iNOS、NO的合成与炎症细胞因子的表达量是否具有关系,目前未见报道。玻璃酸钠又称透明质酸钠,其不仅能够润滑关节、减轻关节磨损及其造成的疼痛,而且在关节内调节水及电解质代谢平衡、营养关节细胞等方面也起着非常重要的作用,是OA临床治疗的药物之一[6-8]。而玻璃酸钠的治疗作用与iNOS炎症途径之间的关系,目前仍不清楚。本文将以兔OA为疾病模型,探讨玻璃酸钠对骨关节炎早期炎性细胞因子及iNOS炎症途径表达的影响。
1 材料与仪器
1.1 实验动物
48只新西兰兔,体重2.5~3.0kg,雌雄各半,购于中国人民解放军军事医学科学院实验动物中心(许可证号:SCXK(军)2012-0004)。所有动物随机分为三组,即空白对照组、模型组和治疗组,模型组和治疗组做ACLT模型,空白对照组不做任何处理。所有动物严格饲养在CL级动物房内,自由进食、饮水,12小时交替照明。
1.2 实验药物与试剂
玻璃酸钠注射液购自于上海景峰制药股份有限公司(批准文号:国药准字H2000016),规格:0.5 mg/0.5mL;苏木素伊红Y染液购自于北京益利精细化学品有限公司;总一氧化氮检测试剂盒:碧云天生物技术研究所,批号:20140329;兔诱导型NO合酶(iNOS)Elisa试剂盒:南京森贝伽生物科技有限公司,批号:SBJ-T0017;、IL-6和IL-17 ELISA kit购自于杭州联科生物技术股份有限公司。
1.3 实验仪器
Synergy HIM型全功能微孔板检测仪:美国BioTek公司;DM6 B倒置显微镜、ASP300S组织脱水机、VT1200S全自动振动切片机均采用德国Leica公司;5430R型冷冻高速离心机:德国Eppendorf公司。
2 方法
2.1 兔OA模型的制备
采用25%的乌拉坦以4mL/kg剂量耳缘静脉注射,麻醉动物。剪除右后肢膝关节周围毛发,75%酒精消毒周围皮肤,髌旁内侧切开3 cm皮肤,逐层切开关节囊,将髌骨向外翻转,切断前交叉韧带和内侧副韧带,止血,一号线逐层缝合关节囊及皮肤。术后给予青霉素抗感染治疗4天。空白对照组不手术。造模4周后,耳缘静脉注射空气处死模型动物,解剖膝关节行大体观察及取手术侧股骨内髁软骨标本行普通病理检查。结果表明,手术侧膝关节股骨髁软骨光泽度差,软骨面部分糜烂;光镜检查发现软骨浅层基质变性,浅层细胞减少,证实兔OA模型制备成功。
模型组和治疗组造模4周后关节内分别注射生理盐水、玻璃酸钠,每周一次,共注射4周。术后8周给予过量乌拉坦处死各组动物,打开各组动物膝关节腔,用锐刀切取股骨内髁下面全层关节软骨,留作实验标本。
2.2 软骨组织学观察及组织病理评分
将各组动物的软骨标本经10%福尔马林固定48小时以上后,梯度乙醇脱水,二甲苯透明,石蜡包埋,与滑膜或软骨表面垂直行间断连续切片,切片厚度5 m,HE染色,显微镜下观察软骨组织的病理改变情况。
通过对各组动物软骨组织的石蜡切片进行HE染色,观察软骨表面细胞排列、潮线分布情况,将软骨退变定为4级,计分为0~3[9]。
2.3 NO和iNOS的含量检测
耳缘静脉取血1mL,4℃过夜,2000 g离心10min,取上层血清分装于EP管中,-80℃冰箱内保存,待测。1 mL注射器抽取无菌PBS溶液,注射到手术关节腔内,摇晃整条右后腿,再将液体回抽,分装后保存于-80℃冰箱内,待测。总一氧化氮检测试剂盒和诱导型NO合酶(iNOS)Elisa试剂盒用于血清中和关节腔内NO、iNOS的检测,实验详细步骤参照各试剂盒说明书。
2.4 关节腔内炎症相关细胞因子的测定
2.5 数据分析
3 结果
3.1 各组动物关节软骨光镜观察
HE染色显示空白对照组动物关节软骨表面整洁光滑,软骨细胞层次清晰,结构完整(图1A);术后8周后OA模型组可见软骨表层出现缺损,中层细胞显著性减少,坏死细胞较多(图1 B),病理学评分为(2.76±0.41);关节腔内注射玻璃酸钠4周后,治疗组可见明显的增生细胞团,坏死细胞数也显著下降(图1 C),病理学评分为(1.25±0.39),显著性低于模型组,略高于空白对照组,表明玻璃酸钠对ACLT制备的兔早期OA模型具有较好治疗作用。
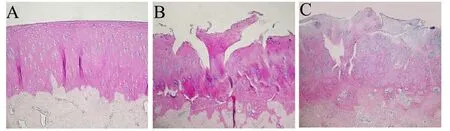
图1 各组动物膝关节软骨组织HE染色结果(200×),A空白对照组,B模型组,C玻璃酸钠治疗组。
3.2 各组动物血清和关节腔内NO、iNOS的含量比较
由表1可知,术后8周模型组动物血清和关节积液内NO、iNOS的含量都显著性高于空白对照组,与OA疾病发展的严重程度呈正相关趋势;与模型组相比,经玻璃酸钠治疗4周后,治疗组动物血清和关节积液内NO、iNOS的含量均显著性下降,且关节积液内NO、iNOS的含量下降更为迅速;此外,图3表明,玻璃酸钠对iNOS的抑制作用明显强于对NO的抑制作用。

图2 各组动物膝关节软骨组织病理学评分
术后8周各组滑膜iNOS形态分析,计算出光密度值(AIOD)(表2所示)。
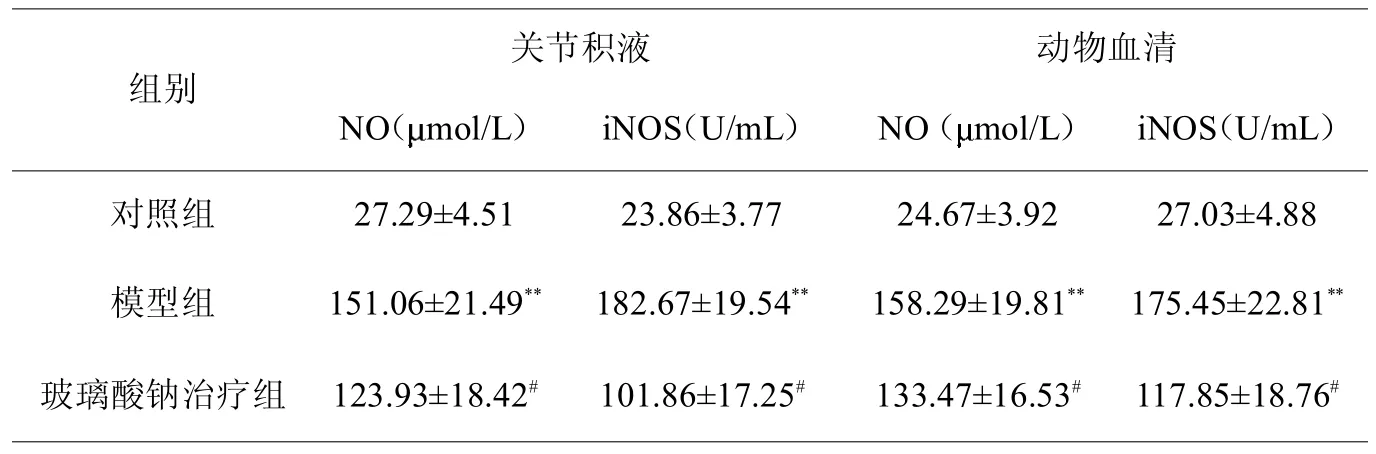
表1 各组动物血清和关节积液内NO、iNOS的含量
表2 各组兔骨关节炎滑膜iNOS的光密度表达
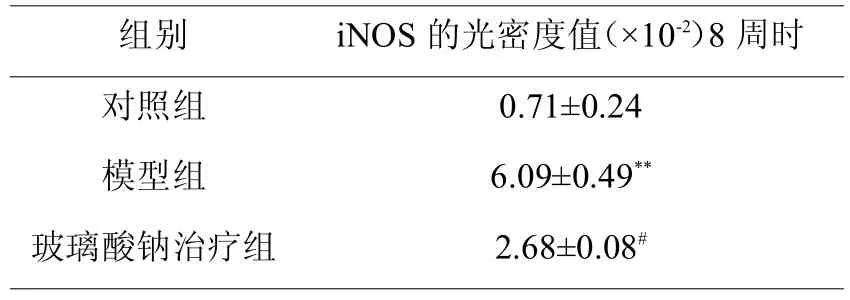
表2 各组兔骨关节炎滑膜iNOS的光密度表达
与同期对照组比较**<0.05,#<0.05
组别iNOS的光密度值(×10-2)8周时对照组模型组玻璃酸钠治疗组0.71±0.24 6.09±0.49**2.68±0.08#
3.3 各组动物关节腔内炎性相关细胞因子的比较
4 讨论
OA是影响老年人活动的最常见原因之一,是以膝关节的反复疼痛、肿胀为主要临床表现,对患者的生活质量造成了严重影响[10]。随着人口寿命的延长与老龄社会的到来,临床上OA患者愈来愈多,随着病情进行性加重,患者的精神压力和经济负担越来越沉重。OA作为常见的和重大的慢性疾病之一,具有发病隐匿,病程反复以及病程长等特点,成为日益严峻的一个公共健康问题。
本研究采用前交叉韧带切断(ACLT)的方法来制备兔OA疾病模型。造模4周后,膝关节肉眼即可见软骨光泽度差且局部糜烂;光镜下见软骨浅层基质变性,软骨细胞层次不清,表明利用ACLT方法成功制备了兔OA疾病模型。造模8周内的软骨病理改变多以粗糙糜烂为主,这与OA临床早期病理表现非常类似。由于ACLT法操作简单、重复性好,通过将兔膝关节前交叉韧带切断来造成软骨退变,对膝关节的生理结构改变较少,与临床上OA软骨的病理进程非常相似,是目前应用最为广泛的一种造模方法[11,12]。
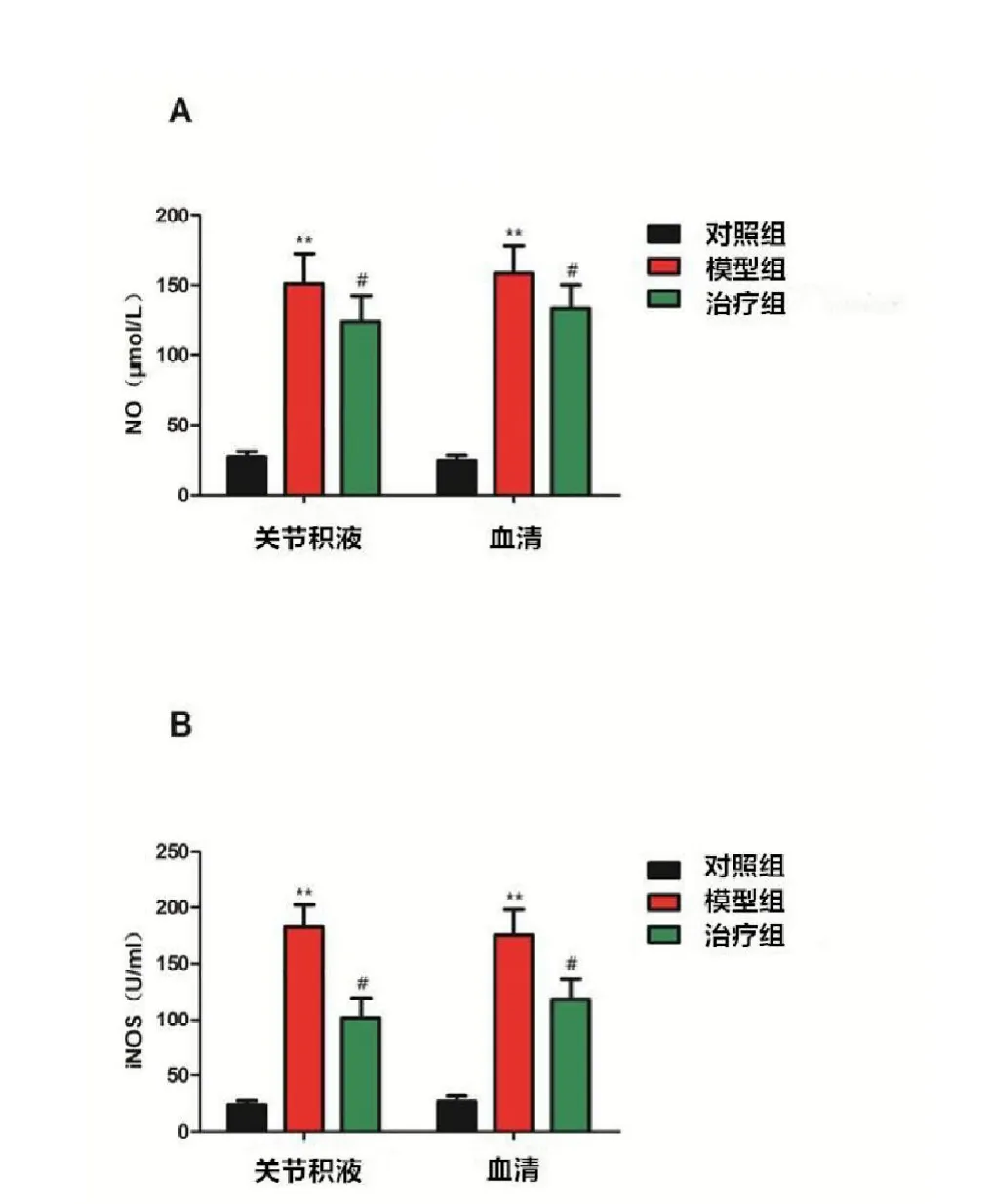
图3 各组动物血清和关节积液内NO、iNOS的含量。
表3 各组动物关节腔内以及IL-17的表达量(pg/mL)
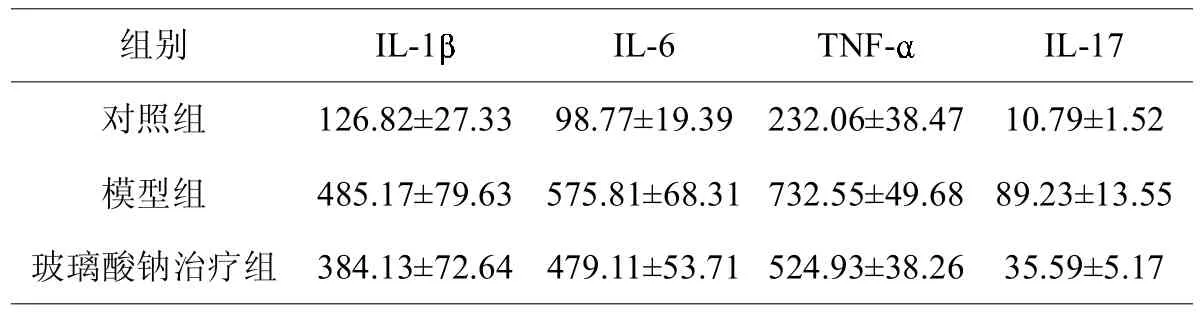
表3 各组动物关节腔内以及IL-17的表达量(pg/mL)
组别对照组模型组玻璃酸钠治疗组IL-1IL-6TNF-IL-17 126.82±27.3398.77±19.39232.06±38.4710.79±1.52 485.17±79.63575.81±68.31 732.55±49.6889.23±13.55 384.13±72.64479.11±53.71 524.93±38.2635.59±5.17
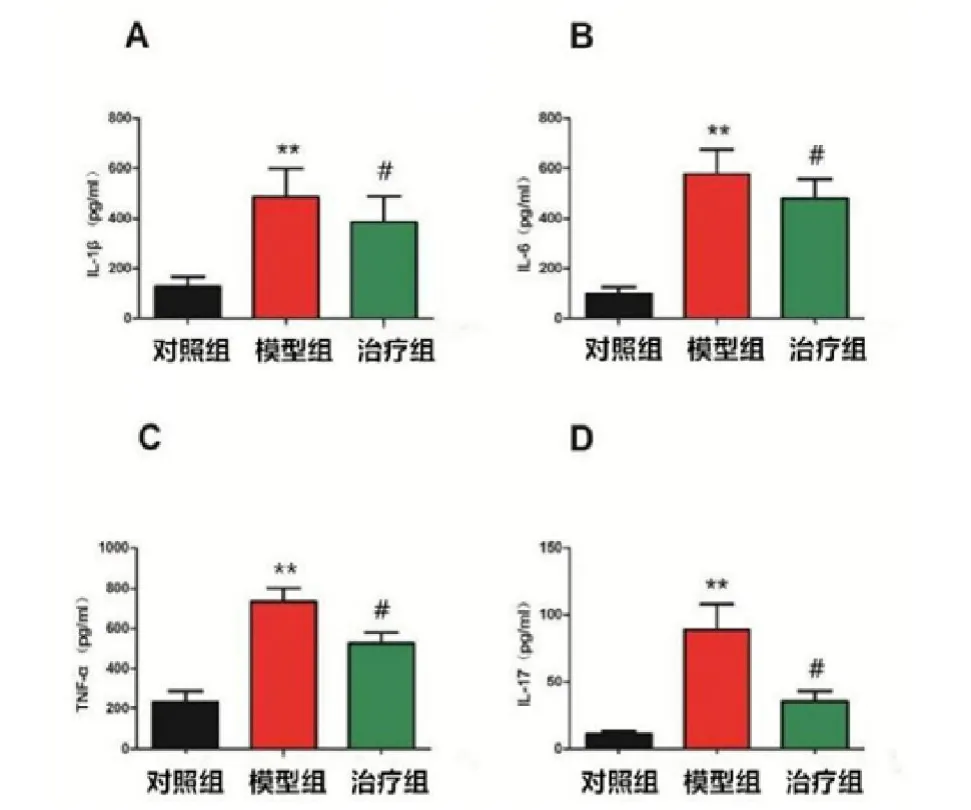
图4 各组动物关节腔内以及IL-17的表达量(pg/mL)。;D IL-17
关节软骨的组成,除了软骨细胞外,还包括由蛋白多糖和胶原(多以Ⅱ型胶原为主)构成的软骨基质。其由蛋白多糖和胶原按一定方式结合形成的网状结构,作为关节软骨粘弹性的基础。任何能够影响蛋白多糖和胶原代谢的因素,均有可能影响到关节的生理功能,导致关节炎的发生。其中,关节部位产生的大量NO就是OA发病的诱因之一[13]。
机体内的NO多是由一氧化氮合酶(NOS)催化产生[14]。NOS有两种来源,即结构型cNOS和诱导型iNOS,前者在正常生理状态下产生少量的NO,而后者可在内毒素或某些细胞因子的作用下持续的产生大量的NO。高浓度NO可扩散入血,导致血清中的NO水平也随之升高。
近年来,越来越多的研究表明[15,16]NO参与了OA的发病进程。NO不仅可以通过抑制蛋白多糖的合成和干扰胶原的代谢来抑制关节基质的产生,还可以激活MMP-1、MMP-3以及MMP-9等基质金属蛋白酶来促进关节基质的降解[17-19]。此外,持续高浓度的NO还会对关节内层的软骨细胞产生影响,诱导软骨细胞凋亡[20]。
本研究发现,造模8周后,模型动物血清和关节腔内的NO和iNOS的表达量远远大于空白对照组,且伴随着以及IL-17等促炎因子的高表达,表明局部高浓度的NO会诱发关节部位的炎症反应,而被募集而来的炎症细胞,特别是巨噬细胞,很有可能会进一步诱导产生更多的NO,如此恶性循环,最终导致OA的发病[21]。经玻璃酸钠治疗4周后,血清和关节腔内的NO和iNOS的表达量显著性低于模型组,且玻璃酸钠对iNOS的抑制作用明显强于对NO的抑制作用(图4)。通过对iNOS光密度值的测定,实验组的iNOS光密度值表达较对照组明显下降(表2),有统计学意义(与同期对照组比较**<0.05,#<0.05)。随着NO表达量的降低,以及IL-17等细胞因子的释放量也随之下调,表明OA早期病理生理变化中iNOS、NO的合成与炎症性细胞因子以及IL-17的表达水平呈正相关。
故我们推测玻璃酸钠可能通过抑制炎性因子NO-iNOS这一炎症途径而发挥抗炎、保护关节软骨作用,但是玻璃酸钠究竟以何种途径对iNOS起抑制作用,目前不排除与其抑制以及IL-17等促炎因子的高表达有关,后续将进一步通过检测iNOS炎症途径下游基因或蛋白的表达水平进行深入研究。
[1]Felson DT,Zhang Y.An update on the epidemiology of knee and hip osteoarthritis with a view to prevention[J].Arthritis and rheumatism 1998,41(8):1343-1355.
[2]Martin AS,Awan HM.Metacarpophalangeal Arthroplasty for Osteoarthritis[J].The Journal of hand surgery 2015,40(9):1871-1872.
[3]Pap T,Korb-Pap A.Cartilage damage in osteoarthritis and rheumatoid arthritis-two unequal siblings[J].Nature reviews Rheumatology 2015,11(10):106.
[4]Remst DF,Blaney Davidson EN,van der Kraan PM.Unravelling osteoarthritis-related synovial fibrosis:astepcloserto solving joint stiffness[J].Rheumatology(Oxford,England)2015,54(11): 1954-1963.
[5]Winyard PG,Ryan B,Eggleton P,et al.Measurement and meaning ofmarkersof reactive species ofoxygen,nitrogenandsulfur inhealthy human subjects and patients with inflammatory joint disease [J].Biochemical Society transactions 2011,39(5):1226-1232.
[6]Altman RD,SchemitschE,Bedi A.Assessment of clinical practice guideline methodology for the treatment of knee osteoarthritis with intra-articular hyaluronic acid[J].Seminars in arthritis and rheumatism 2015,45(2):132-139.
[7]Migliore A,Procopio S.Effectiveness and utility of hyaluronic acid in osteoarthritis[J].Clinical cases in mineral and bone metabolism: the official journal of the Italian Society of Osteoporosis,Mineral Metabolism,and Skeletal Diseases 2015,12(1):31-33.
[8]Henrotin Y,Raman R,Richette P,et al.Consensus statement on viscosupplementation with hyaluronic acid for the management of osteoarthritis[J].Seminarsinarthritis andrheumatism2015,45(2):410.
[9]董刚,乐军,周辉,等.PDTC关节腔注射对兔创伤性OA软骨MMP-1、MMP-9 mRNA表达的影响[J].浙江中西医结合杂志2013,(08):609-612.
[10]Goldring MB,Goldring SR.Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis[J].Annals of the New York Academy of Sciences 2010,1192:230-237.
[11]Setton LA,Elliott DM,Mow VC.Altered mechanics of cartilage with osteoarthritis:humanosteoarthritis and anexperimental model of joint degeneration[J].Osteoarthritis and cartilage/OARS, Osteoarthritis Research Society 1999,7(1):2-14.
[12]Garner BC,Stoker AM,Kuroki K,et al.Using animal models in osteoarthritis biomarker research[J].The journal of knee surgery 2011,24(4):251-264.
[13]Lee AS,Ellman MB,Yan D,et al.A current review of molecular mechanisms regarding osteoarthritis and pain[J].Gene 2013;527 (2):440-447.
[14]Amin AR,Attur M,Abramson SB.Nitric oxide synthase and cyclo-oxygenases:distribution,regulation,and intervention in arthritis[J]. Current opinion in rheumatology 1999,11(3):202-209.
[15]Vuolteenaho K,Moilanen T,Knowles RG,et al.The role of nitric oxide in osteoarthritis[J].Scandinavian journal of rheumatology 2007,36(4):247-258.
[16]Abramson SB,Attur M,Amin AR,et al.Nitric oxide and inflammatory mediators in the perpetuation of osteoarthritis[J].Current rheumatology reports 2001,3(6):535-541.
[17]Chen WX,Shan FJ,Jin HT,et al.Research on application of determinationofMMP-13inosteoarthritis[J].ZhongguogushangChina journal of orthopaedics and traumatology 2014,27(7):617-620.
[18]Li NG,Tang YP,Duan JA,et al.Matrix metalloproteinase inhibitors:a patent review(2011-2013)[J].Expert opinion on therapeutic patents 2014,24(9):1039-1052.
[19]Li NG,Shi ZH,Tang YP,et al.New hope for the treatment of osteoarthritis through selective inhibition of MMP-13[J].Current medicinal chemistry 2011,18(7):977-1001.
[20]Needleman P,Manning PT.Interactions between the inducible cyclooxygenase(COX-2)and nitric oxide synthase(iNOS)pathways:implications for therapeutic intervention in osteoarthritis[J]. Osteoarthritis and cartilage/OARS,Osteoarthritis Research Society 1999,7(4):367-370.
[21]Sylvester J,Liacini A,Li WQ,et al.Interleukin-17 signal transduction pathways implicated in inducing matrix metalloproteinase-3, -13 and aggrecanase-1 genes in articular chondrocytes[J].Cellular signalling 2004,16(4):469-476.
Experimental study of sodium hyaluronate on the expression of iNOS and inflammatory cytokines in rabbit osteoarhitis
Wei Zhuo1,Yuan Bing1,Ma Qin1,et al.1 Department of Orthopedics,Liyuan Hospital affiliated to Tongji Medical College,Huazhong University of Science and Technology;2 Department of Rehabilitation,Liyuan Hospital affiliated to Tongji Medical College,Huazhong University of Science and Technology,Wuhan,Hubei,430070,China
Objective To investigate the correlation between the production of NO,iNOS and the expressions of、IL-1、IL-6andIL-17inthearticularcartilage of rabbits withtraumatic osteoarthritis(OA),andtoexploretheinfluence of Sodium hyaluronate(SH)on cartilage degeneration in traumatic OA.Methods 48 New Zealand rabbits underwent anterior cruciateligament transaction(ACLT)of the right knee and then were divided into three groups.The animals in the SH-treatmentgroup were injected with SH(0.3mg)intheknees 4 weekafteroperation,oncea week for 4weeks. Rabbits in the model group were treated with normal saline under the same condition and the control group does nothing. All rabbits were sacrificed after the last treatment.Cartilagineus changes of the medial femoral condyles were grossly checkedandOAseverity was evaluated under light-microscope.Theconcentration of NOand iNOSin jointfluid,serum and the expressions ofIL-6 and IL-17 in joint fluid were assessed ELISA kit.Results The results of HE staining and pathological score show that cartilage degeneration in the SH-treatment group was significantly slighter than that in the model group.The concentration of NO and iNOS in joint fluid,serum and the expressions ofIL-6 and IL-17 in joint fluid were significantly lower than those in the model group(<0.01)after SH treatment.Conclusion The expression of NO was positively correlated with inflammatory Cytokines in the early stages of OA.And SH may protect articular cartilage by inhibiting synthesis of NO.
Osteoarthritis;Sodium hyaluronate;NO;Cytokines
R684.3
A
10.3969/j.issn.1672-5972.2017.04.004
swgk2017-03-00066
韦卓(1960-)男,本科,主任医师。研究方向:骨科。
*[通讯作者]马琴(1973-)女,本科,护士长。研究方向:骨科。
2017-03-28)
湖北省卫生和计划生育委员会科研项目立项(WJ2015MB018)
1华中科技大学同济医学院附属梨园医院骨科;2华中科技大学同济医学院附属梨园医院康复科,湖北武汉430077
