人β防御素3体内抑制耐甲氧西林葡萄球菌内植物生物膜感染的机制研究*
2017-09-03朱晨尚希福孔荣王英明吴科荣刘应生马锐祥李多玉
朱晨 尚希福 孔荣 王英明 吴科荣 刘应生 马锐祥 李多玉
人β防御素3体内抑制耐甲氧西林葡萄球菌内植物生物膜感染的机制研究*
朱晨 尚希福 孔荣 王英明 吴科荣 刘应生 马锐祥 李多玉
目的明确耐甲氧西林金黄色葡萄球菌(MRSA)注入大鼠胫骨的骨髓腔后,应用人防御素3(HBD-3)抑制耐药菌植入物表面生物膜感染的机制。方法将MRSA注入SD大鼠左胫骨骨髓腔中构建耐药植入物细菌生物膜感染的模型:各实验组(包括空白对照组,HBD-3组和万古霉素组,每组20只)髓腔感染24小时后腹膜内注射药物,对照组注射2mL生理盐水,HBD-3组注射(1 MIC)HBD-3,万古霉素组注射2 mL(1 MIC)万古霉素,每组分别在腹腔注射后第1,7,14和21天处死5只;激光共聚焦显微镜观察植入物表面上的生物膜和活菌的数量,免疫组化评估和TLR-4的表达,ELISA法检测IL-10及结果对照组白细胞数和中性粒细胞的百分比,以及生物膜形态和对照组的存活细菌的数目随时间逐渐增加,而HBD-3组和万古霉素组随时间下降(<0.05)。HBD-3组和TLR-4表达量在第1天增加,在第7天达到峰值,在第14天开始下降,每个时间点的相对差异均有统计学差异(<0.05)。和TLR-4表达量各时间点在HBD-3组中较对照组和万古霉素组中均有统计学差异。IL-10及的表达在对照组中均显著高于其它两组(<0.05)。结论防御素3可以通过调节炎症反应和免疫应答,抑制大鼠胫骨骨髓MRSA引起的耐药菌植入物生物膜感染。
人防御素3;耐甲氧西林金黄色葡萄球菌;生物膜;;TLR-4
植入物感染的治疗是一个已经困扰骨科很久的难题[1]。一种新的抗菌剂内源性抗菌肽—人防御素3(fensin-3,HBD-3)在抑制生物膜形成和免疫调节中发挥着重要作用[2]。我们前期的研究发现,HBD-3可以抑制耐药金黄色葡萄球菌(Methicillin-resistant strains of Staphylococcusaureus,MRSA)生物膜的形成并对其内的细菌有杀灭作用[3]。此外,HBD-3还可以抑制成膜基因icaAD和耐药基因MecA的表达[4]。耐药金黄色葡萄球菌上清液能够通过活化p38MAPK诱导大鼠成骨细胞分泌HBD-3同源物鼠防御素14(MBD-14)[5]。此外,在感染了耐药金黄色葡萄球菌的急性化脓性骨髓炎模型中,应用p38MAPK通路激动剂增加了感染部位MBD-14的释放并抑制了骨髓炎的进展[6]。然而,体内环境下,HBD-3如何调控免疫反应以及抑制骨内感染的机制仍然是未知的。本研究拟通过体内实验验证,HBD-3对细菌感染后免疫调控及炎症反应的影响,以提供抑制炎症反应的药物作用靶点,并为临床应用HBD-3提供新的理论依据。
1 材料和方法
1.1 构建MRSA引起的植入物细菌生物膜急性感染的模型
主要试剂:金黄色葡萄球菌标准菌株ATCC25923从第三军医大学的细菌培养实验室购买,使用VITEK 2自动化鉴定系统(BioMérieux,Marcy I’étoile)进行菌种的鉴定和药敏试验。耐甲氧西林菌株的决定基因(MecA)证实菌株是否为MRSA[7]。使用微孔板法(MTP)检测形成生物膜的能力[8]。HBD-3(Sigma)以冻干粉的形式储存,稀释溶解于0.1%乙酸,并制备成1mg/mL的原液储存。HBD-3的最低抑菌浓度(Minimum inhibitory concentration,MIC)由液体微量稀释法进行测定[2]。TSA(胰蛋白酶大豆琼脂培养基)和TSB(胰蛋白酶大豆肉汤,pH值7.2±0.2)从青岛海博生物技术有限公司购买。将钛棒置于6孔平底细胞培养板中,过夜孵育的细菌稀释成1:1000,50 L的ATCC25923细菌悬液(~106)被添加到含钛棒的0.5×TSB培养板内37℃孵化20小时。选择正常饲养的健康成年雄性SD大鼠,平均体重230 g。小鼠行腹腔麻醉,切开显露左胫骨平台并扩大髓腔,将已形成生物膜感染的钛棒植入髓腔,感染24小时待生物膜熟化后再通过腹膜注射药物。
1.2 实验分组及观察指标
本实验共分以下三组:对照组,HBD-3组和万古霉素组(商品名称:稳可信,适用于耐甲氧西林金黄色葡萄球菌所致的感染,生产厂商:希腊VIANEX S.A.(PLANT C) ),每组20只大鼠,对照组用2 mL注射生理盐水,HBD-3组注射含(1MIC)的2mL生理盐水,万古霉素组注射含万古霉素0.5 ug/mL(1MIC)的2 mL生理盐水,每组分别在腹腔注射后第1,7,14和21天处死5只;观察局部是否有肿胀,伤口是否有脓性分泌物;眼周静脉窦采血1mL检测血常规和血培养;在激光扫描共聚焦显微镜下观察植入物表面上的生物膜和活菌的数量,通过免疫组织化学染色测试和TLR-4的表达,并用ELISA法检测IL-10及TNF-的表达水平。鼠抗蛋白,TLR-4的单克隆抗体和生物素标记的第二抗体购自美国圣克鲁斯,DAB试剂盒从北京中山金桥生物技术有限公司购买,ELISA试剂盒从美国Invitrogen公司购买。
1.3 激光扫描共聚焦显微镜观察
使用激光共聚焦显微镜(Confocal laser scanning microscopy,CLSM,Leica)观察生物膜形态,使用LIVE/DEAD BacLightTM细菌生存力试剂盒染色,观察材料表面生物膜的形态结构及细菌活力。SYT09能使活菌发射绿色荧光,PI能使死细菌发射红色荧光,活菌和死菌便可以根据不同的荧光颜色区分开。SYT09:PI:蒸馏水按照1.5:1.5:1在黑暗条件下制备,使用去离子水进行洗涤去除培养液。用于染色的荧光染料,在37℃暗处培养15分钟,使用Image-Pro Plus版本6.0(Media Cybernetics,USA)图像分析软件处理,并计算最终菌落IOD,堆积密度和多糖基质染色区域。
1.4 免疫组化染色
胫骨组织切片进行脱蜡,用PBS洗涤,3%过氧化氢进行酶变性抗原修复,5%正常山羊血清封闭,工作液初级抗体滴加(1:1000,肌动蛋白1:500),并在37℃孵育4h,用PBS洗涤,生物素标记的二抗工作液(1:500,肌动蛋白1:50),在37℃温育30分钟。PBS洗涤后,DAB显影,苏木精再染色,脱水洗涤封闭。阳性细胞的百分比是在每高倍视野(400×)下棕色和黄色细胞计数占总细胞计数的比值,随机选取三个视野,然后求平均值。
1.5 统计方法
2 结果
2.1 一般情况观察
对照组中有三只死于感染,伴有肿胀和白色脓性分泌物(15%);其它两组无一因感染死亡,两组中各有1例出现明显的伤口肿胀,但没有脓性分泌物。
2.2 血常规检查和血液培养
对照组中血白细胞数和中性粒细胞的百分比随时间逐渐增加,而HBD-3组和万古霉素组中则随时间降低(<0.05),在每个时间点HBD-3组和万古霉素组与对照组相比均显著降低(<0.05),HBD-3组和万古霉素组之间比较,无显著的统计学差异(>0.05),见表1。通过血液培养显示,这三组的感染的细菌均为MRSA。

表1 各实验组血白细胞总数和中性粒细胞的百分比比较
2.3 生物膜内活菌数
对照组生物膜内存活细菌的数目逐渐随时间增加,而HBD-3组和万古霉素组则随时间减少(<0.05),每个时间点的HBD-3组和万古霉素组的存活细菌数目与对照组相比均显著减少(<0.05);HBD-3组和万古霉素组之间比较,差异无统计学意义(>0.05)。见图1。
2.4 NF-B和TLR4的表达
2.5 IL-10与TNF-的表达水平
对照组中的每个时间点的IL-10和TNF-的表达水平比其它两组高,差异有统计学意义(<0.05);HBD-3组和万古霉素组之间比较,差异无统计学意义(>0.05)。参见图4。
3 讨论
人防御素是一种分子量为2~6 kDa的阳离子蛋白多肽,是一种新型的细菌感染抑制剂,其特征为广泛的抗菌谱、作用快速、低耐药率、先天免疫的兼容性和骨感染的免疫调节,其独特的作用引起了越来越多的学者在临床与基础研究方面的浓厚兴趣。与其它抗微生物肽相比,HBD-3具有更广泛的抗菌谱,稳定的物理和化学性质,以及对革兰氏阳性,阴性和真菌很强的杀菌作用,可通过toll样中介受体(TLR),并能连接先天性和获得性免疫反应[2]。人防御素类抗菌机理是阳离子电荷的肽分子可以与带阴离子电荷的细菌细胞膜首先结合,然后在分子中的疏水性链段和两亲性-螺旋被插入到质膜,最终取代细胞膜的分子形成离子通道,由此导致细菌膜由于膜电位损失而损坏并最终导致细菌死亡。由于人防御素类抗菌机理主要是物理效应,这与传统抗生素的作用机制显著不同。因此,微生物很难对它产生突变抗药性,这是人防御素仍然对许多耐药细菌甚至包括耐万古霉素的粪肠球菌具有杀菌作用的原因,而且不会损坏自身的细胞和内脏器官[2]。有人发现MRSA上清液能够诱导成骨细胞的TLR-2和TLR-4释放和表达HBD-3[9]。此外,HBD-3在急性感染部位的骨组织和假体周围关节感染的边界组织中的表达增加了一倍,这表明内源性抗菌肽HBD-3是细菌入侵到骨组织后第一道防线。
TLR是在天然免疫系统的重要模式识别受体,它不仅可以介导对病原微生物及其产物的识别,而且还能够参与获得性免疫反应,它已被确认为是连接自然免疫与获得性免疫的桥梁[10]。TLR是未成熟DC,和Mo广泛表达,并在识别革兰氏阳性磷壁酸,热休克蛋白60,LPS和脂多糖介导的信号途径中起重要作用[11]。相关研究表明,在体内和体外HBD-3已经显示出抑制巨噬细胞的脂多糖刺激分泌肿瘤坏死因子和白细胞介素-6(IL-6)的能力。HBD-3还可以通过依赖性TLR-1和TLR-2受体途径活化促分裂原活化蛋白激酶(MAPK),细胞外信号调节激酶(ERK)信号通路,和抗原呈递细胞(APC)[12]。因此,有人推测,HBD-3具有抗菌与抑制炎症反应的双向调节作用。
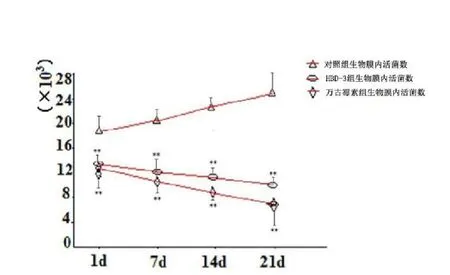
图1 比较各组生物膜内的活菌数(**表示与对照组相比,<0.05)

图2 免疫组化标记的表达水平(如图黑箭头标记,400×)

图3 免疫组化标记TLR-4的表达水平(如图黑箭头标记,400×)

图4 各组中IL-10与的表达水平(*表示与对照组相比,<0.05;#表示两组之间相比,>0.05)
我们研究结果表明,在HBD-3组和万古霉素组中,没有出现因感染死亡。虽两组中各有1例出现伤口肿胀,但没有脓性分泌物。HBD-3组和万古霉素组中血白细胞总数和中性粒百分比以及生物膜形态和活菌数随时间明显下降,与对照组比较在各时间点均显著降低,各组间和对照组的比较差异有统计学意义;HBD-3组和万古霉素组之间比较,差异无统计学意义,表明与万古霉素相比,HBD-3也具有极强的抗菌活性,HBD-3对抑制细菌生长和生物膜形成均具有很强的作用。和TLR-4的表达,在对照组和万古霉素组中不随时间改变,在HBD-3组第1天开始增加,在第7天到达峰值并在第14天开始降低,在每个时间点HBD-3组均显著高于对照组和万古霉素组,差异有统计学意义,表明HBD-3的抑菌作用可能与和TLR-4的表达上调有关,而万古霉素的抑菌作用可能通过其它途径来实现。在对照组中,IL-10和的表达在各时间点均显著高于其他两组,差异有统计学意义;在HBD-3组和万古霉素组之间,差异无统计学意义。HBD-3和万古霉素均可以显著减少IL-10和介导的炎症反应。
总之,HBD-3可以通过直接杀菌、调节炎症和免疫反应抑制MRSA引起的植入物细菌生物膜急性感染。
[1]Montanaro L,Speziale P,Campoccia D,et al.Scenery of Staphylococcus implant infections in orthopedics[J].Future Microbiol, 2011,6(11):1329-1349.
[2]Maisetta G,Batoni G,Esin S,et al.In vitro bactericidal activity of human beta-defensin 3 against multidrug-resistant nosocomial strains[J].Antimicrob Agents Chemother,2006,50(2):806-809.
[3]Zhu C,Tan H,Cheng T,et al.Humandefensin 3 inhibits antibiotic-resistant Staphylococcus biofilm formation[J].J Surg Res, 2013,183(1):204-213.
[4]Zhu C,He N,Cheng T,et al.Ultrasound-targeted microbubble destruction enhances humandefensin 3 activity against antibioticresistant Staphylococcus biofilms[J].Inflammation,2013,36(5): 983-996.
[5]Zhu C,Qin H,Cheng T,et al.Staphylococcus aureus supernatant induces the release of mousedefensin-14 from osteoblasts via the p38 MAPK andpathways[J].Int J Mol Med,2013,31 (6):1484-1494.
[6]Zhu C,Wang J,Cheng T,et al.The potential role of increasing the release of mousedefensin-14 in the treatment of osteomyelitis in mice:A primary study[J].PLoS One,2014,9(1):e86874.
[7]Nihonyanagi S,Kanoh Y,Okada K,et al.Clinical usefulness of multiplex PCRlateral flowinMRSA detection:a novel,rapid genetic testing method[J].Inflammation,2012,35(3):927-934.
[8]Arciola CR,Campoccia D,Baldassarri L,et al.Detection of biofilm formation in Staphylococcus epidermidis from implant infections:Comparison of a PCR method that recognizes the presence of ica genes with two classic phenotypic methods[J].J Biomed Mater Res A,2006,76(2):425-430.
[9]VarogaD,Wruck CJ,Tohidnezhad M,et al.Osteoblasts participate in the innate immunity of the bone by producing human beta defensin-3[J].Histochem Cell Biol,2009,131(2):207-218.
[10]Wang M,Chen Y,Zhang Y,et al.Mannan-binding lectin directly interacts with Toll-like receptor 4 and suppresses lipopolysaccharide-induced inflammatory cytokine secretion from THP-1 cells [J].Cell Mol Immunol,2011,8(3):265-275.
[11]Spadaro M,Montone M,Arigoni M,et al.Recombinant humanlactoferrin induces human and mouse dendritic cell maturation via Toll-like receptors 2 and 4[J].FASEB J,2014,28(1):416-429.
[12]FunderburgN,LedermanMM,FengZ,etal.Humanbeta-defensin-3 activates professional antigen-presenting cells via Toll-like receptors 1 and 2[J].Proc Natl Acad Sci USA 2007,104:18631-18635.
The mechanismof human-defensin 3in methicillin-resistant Staphylococcus aureus-induced infectionof implant biofilm in the rat tibial bone marrow
Zhu Chen,Shang Xifu,Kong Rong,etal.Departmentof Orthopaedics,AffiliatedProvincial HospitalofAnhui Medical University,Hefei Anhui,230001,China
Objective To study the mechanism of human-defensin 3(HBD-3)in methicillin-resistant Staphylococcus aureus(MRSA)-induced infectionof implant drug-resistantbacteria biofilm in the rattibial bone marrow.Methods The SD rats were selected to construct the model of MRSA-induced implant biofilm infection in the left tibial bone marrow. The drugs were intraperitoneally injected after 24 h medullary cavity infection,and the experimental groups included the model group,HBD-3 group,and vancomycin group(20 rats in each group).The model group was injected with 2 mL saline,HBD-3 group was injected with 2 mL(1MIC)HBD-3 and vancomycin group was injected with 2 mL(1 MIC)vancomycin.Five animals that had been injected in each group were sacrificed on the 1st,7th, 14th,and 21st day,respectively.The laser scanning confocal microscopy was used to observe the morphology of the biofilm and the number of viable bacteria.Immunohistochemical staining was adopted to test the expressions ofand TLR-4,and ELISA was used to test IL-10 andexpression levels.Results The percentage of the neutrophile granulocytes,totalwhite bloodcells and the numberof viable bacteria inthemodelgroup was graduallyincreased,while those in the HBD-3 and vancomycin groups were decreased gradually(<0.05).Theand TLR-4 expressions in the HBD-3 group began to increase on the 1st day,reached the peak on the 7th day and began to be fallen on the 14th day;those in the HBD-3 group were significantly higher than the model group and vancomycin group at each time point (<0.05).The IL-10 andexpressions in the model group at each time were significantly higher than the other two groups(<0.05).ConclusionHBD-3caninhibitthebacterial growthbyregulatinginflammationsandimmuneresponses in the MRSA-induced implant biofilm infection in the rat tibial bone marrow.
Human-defensin 3;Methicillin-resistant strainsofStaphylococcusaureus;Biofilm;;TLR-4
Q939
A
10.3969/j.issn.1672-5972.2017.04.001
swgk2017-02-00007
朱晨(1979-)男,博士,副主任医师。研究方向:关节外科,运动创伤与关节镜外科。
2017-02-06)
国家自然科学基金(No 81401815),中国博士后科学基金(No 2015M582900),江苏省博士后科学基金(No 1501146C)
安徽医科大学附属省立医院骨科关节外科,安徽合肥230001
