NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响
2017-09-03杨宏伟刘文瑜沈宝云李朝周
杨宏伟,刘文瑜,沈宝云,李朝周*
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省作物遗传改良和种质创新重点实验室,甘肃 兰州 730070;3.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;4.甘肃条山农林科学研究所,甘肃 白银 730400)
NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响
杨宏伟1,2,刘文瑜3,沈宝云4,李朝周1,2*
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省作物遗传改良和种质创新重点实验室,甘肃 兰州 730070;3.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;4.甘肃条山农林科学研究所,甘肃 白银 730400)
本研究报道了不同浓度NaCl处理对藜麦种子萌发及幼苗生理特性的影响,以确定藜麦的耐盐阈值,为藜麦在盐渍土地种植提供理论依据。结果表明,不同浓度NaCl处理对藜麦种子萌发和幼苗生理特性均产生显著影响,主要表现为,1)随着NaCl浓度的升高,藜麦种子的发芽率、发芽势、发芽指数和活力指数均呈逐渐降低的趋势,当NaCl浓度达到3.0%时,藜麦种子几乎不发芽;2)幼苗叶片含水量逐渐降低,可溶性糖、脯氨酸、丙二醛含量、相对电导率及O2-·产生速率呈逐渐升高的趋势,叶绿素含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性在NaCl浓度为1.8%时达到最大值,而后随着NaCl浓度的升高呈降低的趋势;3)NaCl胁迫显著抑制了藜麦幼苗株高、茎粗的增加,根长的生长随着NaCl浓度的升高呈先增加后减少的趋势,在NaCl浓度为1.8%时根长最长,达到11.73 cm。说明低浓度(≤1.8%)NaCl处理对藜麦幼苗生长具有促进作用,而高浓度的NaCl处理则对其有抑制作用。藜麦耐盐阈值为1.8%。
NaCl;藜麦;种子萌发;生理特性
土壤盐渍化是影响农业生产的主要因素之一[1]。全世界盐碱地面积约9.54亿hm2,其中我国为9913万hm2。由于全球气候变化、人口不断增长、工业污染加剧、灌溉农业的发展和化肥使用不当等因素影响,导致土壤次生盐渍化问题不断加剧,给农业生产带来了严重威胁,已成为阻碍现代农业生产发展的重要因素之一[2]。盐胁迫对植物的伤害主要有4种表现形式,分别为渗透胁迫、离子毒害、营养失衡和氧化破坏[3]。当植物遭受盐胁迫时其自身可通过合成渗透调节物质、产生抗氧化酶等来缓解由于盐胁迫所造成的损伤。不同植物的耐盐性表现各异,因此通过研究植物在盐生环境中适应性表现,揭示其耐盐机理,为解决盐渍化对植物生长发育产生的不良影响,具有一定的理论指导和现实意义。
藜麦(Chenopodiumquinoa)是苋科藜亚科藜属一年生自花授粉植物[4]。原产于南美洲安第斯山区,是印加土著居民的主要传统食物,至今已有5000~7000多年的种植历史。由于其营养丰富,食用价值高且植株在自然肥力低的情况下仍能生长良好,因此被誉为未来最具潜力的农作物之一[5]。近年来,相关研究发现藜麦具有全方位的营养价值,尤其在预防肥胖、心血管疾病、糖尿病和癌症等方面具有显著的功效,尤其是从2000年以后藜麦的营养价值被众多的营养学家所认可,将其推荐为20世纪末的特色农作物,以藜麦为原料的食品和保健品得到了消费者的热烈追捧[6]。藜麦具有耐盐、耐寒、耐旱、耐贫瘠等生物学特性,Jacobsen等[7]和 Prado等[8]研究发现,藜麦是一种耐盐性强的盐生物种,其中许多品种能够在浓度类似海水盐浓度(4 S/m)的条件下生长,这一特征使其深受一些盐渍问题突出地区的青睐。由于藜麦原产地在海拔3000 m以上的高山区,气候及环境条件相对恶劣,产量低而不稳,难以满足市场需求,2014年南美洲总产量约为6万t,其中85%以上出口到美国、欧洲及日本、新加坡等国家和地区,其强劲的需求使目前许多国家和地区开始引种栽培。中国西藏农牧学院和西藏农业科学院早在1987年就开始了藜麦的引种栽培实验,随后在西藏境内试种成功,目前在中国的甘肃、青海、陕西、浙江等地均有种植[9]。为了使藜麦在甘肃地区更好的引种和适种,本研究设置了5个NaCl浓度梯度,以蒸馏水为对照(CK),根据不同盐浓度处理下藜麦种子的萌发率及幼苗生长的生理形态特征来探讨不同浓度盐处理对藜麦种子萌发和幼苗生长的影响,以确定藜麦的耐盐阈值,为藜麦在盐渍土地种植提供理论依据。
1 材料与方法
1.1 材料及处理
1.1.1 种子萌发试验 试验材料为藜麦(品种为Kasala quinoa),由甘肃省景泰县农林科学研究所提供。实验于2016年5月在甘肃农业大学生命科学技术学院植物生理实验室进行。共设置6个NaCl浓度梯度,分别为CK(蒸馏水),0.6%,1.2%,1.8%,2.4%,3.0%。选取籽粒饱满、大小均匀一致的藜麦种子,经75% 的酒精消毒1 min后用去离子水反复冲洗数次,置于垫有双层滤纸的培养皿(φ=9 cm)中,每皿均匀放入50粒种子,每个浓度处理重复3次,加入10 mL处理盐溶液,以蒸馏水为对照,将所有培养皿置于(25±1) ℃,12 h光照/12 h黑暗、湿度80%恒温培养箱中培养,每天早晚各一次用称重法补充蒸发失去的水分以保持盐浓度的恒定,培养7 d,统计每天种子发芽数。
1.1.2 幼苗生长试验设计 本试验于2016年5-7月在甘肃农业大学生命科学技术学院植物生理实验室进行。选取籽粒饱满、大小均匀一致的藜麦种子,经75%的酒精消毒1 min后用自来水和去离子水冲洗干净并自然风干后,均匀播入装有1 kg蛭石、直径26 cm、高8 cm的塑料花盆中,每盆播种50粒种子,每个盐浓度设3次重复,正常浇水,待幼苗长至四叶时进行定苗,每盆留苗10株,在第10天分别向各花盆中加入等量的不同浓度的NaCl盐溶液进行盐胁迫处理,以蒸馏水处理为对照(CK),所加溶液使土壤完全浸透,处理20 d后测定藜麦幼苗相关生理指标。
1.2 测定指标与方法
1.2.1 种子发芽指标 发芽以胚根长为种子长的2倍,胚芽与种子等长作为萌发标准,每天统计发芽的种子数后计算发芽率、发芽势、发芽指数和活力指数。计算公式如下:
发芽率(germination percentage,GP)=(7 d发芽种子数/测试种子总数)×100%[10]
发芽势(germination energe,GE)=(前3 d发芽种子数/种子总数)×100%[10-11]
发芽指数(germination index,GI) =∑(Gt/Dt)[12]
式中:Dt为日发芽种子数;Gt为与Dt相应的每天的发芽种子数。
活力指数(vigor index,VI)=GI×第7天正常幼苗平均鲜重[13]
式中:幼苗鲜重为称取5株幼苗的重量。
1.2.2 生长指标的测定 直接用尺子测量各处理下藜麦幼苗的株高和主根长,茎粗以植株与土面的交界处地上茎直径代表,用游标卡尺测量。每处理取样5株,取其平均值。
1.2.3 生理指标测定 叶片含水量采用称重法[14];叶绿素含量采用乙醇提取法[15];脯氨酸(Pro)含量采用水合茚三酮法[15];可溶性糖含量采用蒽酮比色法[15];MDA含量采用硫代巴比妥酸法[15];超氧阴离子产生速率采用王爱国等[16]的方法;相对电导率采用电解质外渗法[15];超氧化物歧化酶(SOD)活性采用Giannopolitis等[17]的方法;过氧化物酶(POD)活性采用Shi等[18]的方法;过氧化氢酶(CAT)活性采用Aebi[19]的方法。
1.3 数据分析
采用Office 2010软件对数据进行处理和绘图,数据用“平均值±标准误”表示,采用SPSS 17.0统计分析软件对数据进行差异显著性检验,取P<0.05为显著相关,各项指标测定重复3次。
2 结果与分析
2.1 不同浓度NaCl处理对藜麦种子萌发的影响
发芽率是衡量种子质量好坏的重要指标。随着NaCl浓度的升高,藜麦种子的发芽率、发芽势、发芽指数和活力指数均呈现逐渐下降的趋势,各处理间变化差异显著(P<0.05)(表1)。当NaCl浓度升高到1.8%时,藜麦种子发芽率虽有显著降低,但发芽个数仍达到供试种子的一半以上,当NaCl浓度增加到2.4%时,藜麦种子的发芽率、发芽势、发芽指数和活力指数显著降低,仅为5.36%、0.00%、0.82和0.01。当NaCl浓度为3.0%时,种子几乎不发芽。由此说明,盐浓度1.8%是藜麦种子萌发的耐盐阈值,高浓度的NaCl处理抑制种子萌发。
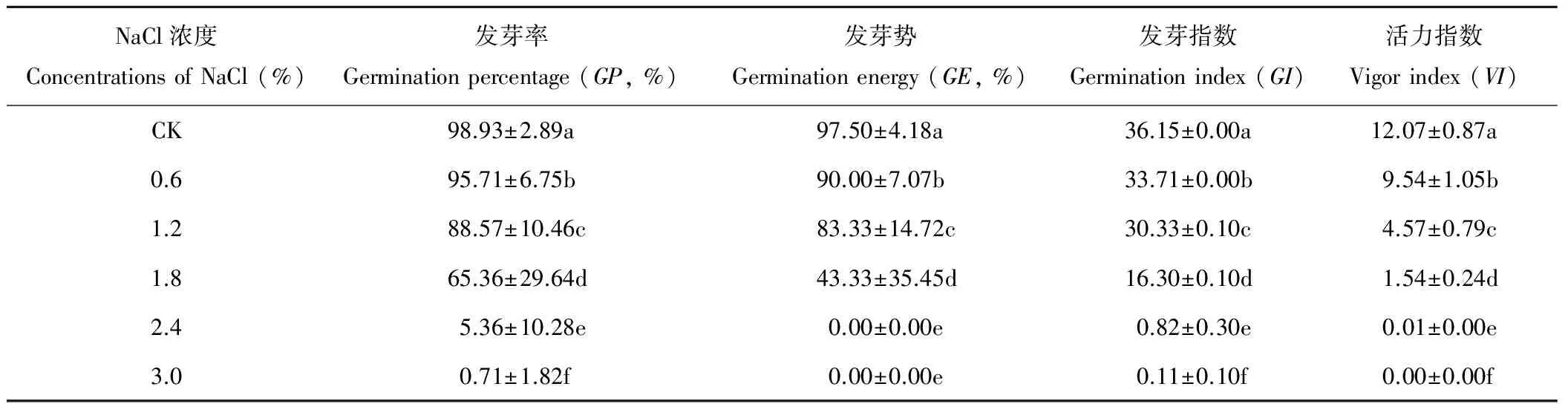
表1 不同浓度NaCl处理对藜麦种子萌发的影响
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note:The different lowercase letters in the same column indicate significant differences (P<0.05), the same below.
2.2 不同浓度NaCl处理对藜麦幼苗叶片含水量及叶绿素含量的影响
由图1可知,藜麦叶片含水量随着NaCl浓度的升高呈现下降的趋势,其中对照(CK)的叶片含水量显著高于盐胁迫处理,当NaCl浓度为3.0%时,藜麦幼苗叶片含水量由CK的90.34%下降为86.67%(图1A)。叶绿素含量随着NaCl浓度的升高呈先升高后下降的趋势,其中1.2%处理下的叶绿素含量达到最大值,较CK增加了27.96%(图1B)。
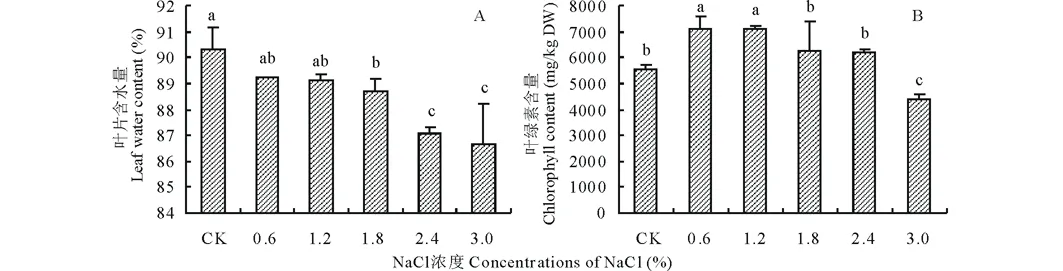
图1 不同浓度NaCl处理对藜麦幼苗叶片含水量及叶绿素含量的影响Fig.1 Effect of different concentrations of NaCl on leaf water and chlorophyll contents of C. quinoa seedlings 不同小写字母表示差异显著(P<0.05),下同。The different lowercase letters indicate significant differences (P<0.05), the same below.
2.3 不同浓度NaCl处理对藜麦幼苗叶片渗透调节物质含量的影响
随着NaCl浓度的升高,藜麦幼苗叶片可溶性糖和脯氨酸含量整体均呈现逐渐升高的变化趋势(图2),在3.0%NaCl浓度处理下达到最大值,其中可溶性糖含量较CK处理增加了31.2%。脯氨酸含量在0~1.8%NaCl浓度处理下差异不显著,升高趋势缓慢,在NaCl浓度为2.4%和3.0%时,脯氨酸含量急剧上升,分别是CK处理下的3.5和6.8倍。
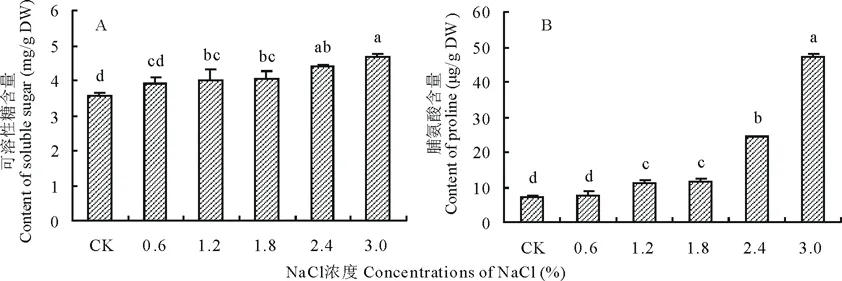
图2 不同浓度NaCl处理对藜麦幼苗叶片可溶性糖和脯氨酸含量的影响Fig.2 Effects of different concentrations of NaCl on soluble sugar and proline contents of C. quinoa seedlings
2.4 不同浓度NaCl处理对藜麦幼苗叶片活性氧含量的影响
随NaCl浓度升高,藜麦幼苗叶片丙二醛含量、相对电导率以及超氧阴离子产生速率均呈现升高的变化趋势(图3)。当盐浓度≤1.2%时,叶片丙二醛含量和相对电导率升高缓慢,在3.0%NaCl浓度下,丙二醛含量较CK处理下增加了478.31%,相对电导率较CK处理下增加了515.9%,O2-·产生速率较CK处理下增加了93.5%。
2.5 不同浓度NaCl处理对藜麦幼苗叶片抗氧化酶活性的影响
植物在受到外界胁迫时,体内细胞代谢的动态平衡会被打破,引起代谢紊乱,此时植物自身会启动由SOD、POD、CAT等组成的抗氧化酶促系统,来维持植株的正常生理功能。随着NaCl浓度的升高,藜麦幼苗叶片中抗氧化酶活性均呈先升高后降低的趋势,各处理间差异显著(P<0.05)(图4)。在0.6%~1.8%盐浓度范围内藜麦幼苗叶片中SOD、POD以及CAT活性均显著高于CK(P<0.05),在1.8%NaCl浓度处理下较CK处理分别高出42.6%、110.7%和50.0%。在2.4%和3.0%NaCl浓度处理下SOD和CAT活性均显著低于CK。
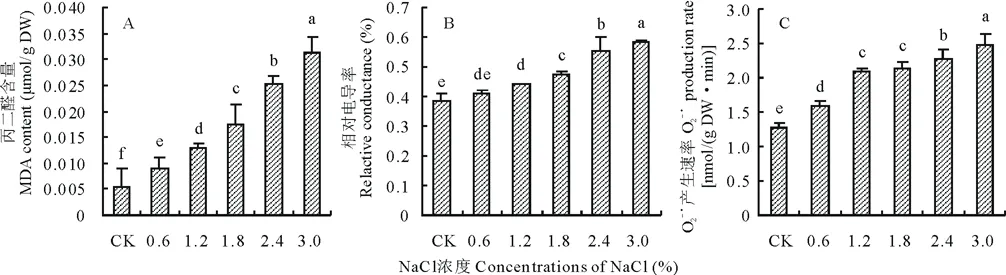
图3 不同浓度NaCl处理对藜麦幼苗叶片丙二醛含量、相对电导率及O2-·产生速率的影响Fig.3 Effects of different concentrations of NaCl on MDA content, relative conductance and O2-·production rate of C. quinoa seedlings

图4 不同浓度NaCl处理对藜麦幼苗叶片SOD、POD和CAT活性的影响Fig.4 Effects of different concentrations of NaCl on activities of SOD, POD and CAT of C. quinoa seedlings
2.6 不同浓度NaCl处理对藜麦幼苗生长发育的影响
藜麦在NaCl胁迫下生长受到抑制,不同NaCl浓度处理对藜麦幼苗地上和地下生物量的影响不同。由表2可知,随着NaCl浓度的升高,藜麦的株高和茎粗呈现逐渐降低的变化趋势,而根长、地上部鲜干比以及地下部鲜干比均呈现先升高后降低的变化趋势,各处理间差异显著(P<0.05),在1.8%NaCl浓度处理下达到最大值,藜麦根长、地上部鲜干比和地下部鲜干比分别比CK增加了126.8%、26.4%和40.7%。
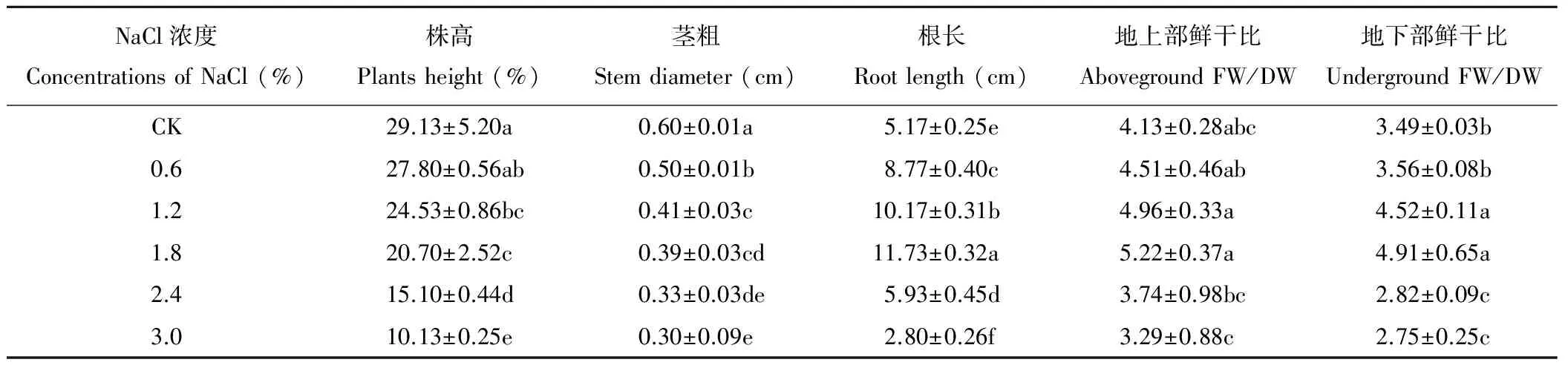
表2 不同浓度NaCl处理对藜麦幼苗生长发育的影响
FW: Fresh weight; DW: Dry weight.
3 讨论
盐分类型及浓度直接影响种子萌发质量,表现为降低种子的发芽率,推迟种子的初始萌发时间、延长种子的萌发时间等[20-22]。Waisel[23]认为盐生植物在盐胁迫时种子发生休眠,高盐浓度胁迫时不萌发或延缓萌发,从而避免植株受高浓度的盐害。本试验结果表明随着NaCl浓度的升高,藜麦种子的发芽率,发芽势,发芽指数以及活力指数均显著降低,当盐浓度达到1.8%时,其发芽率仍保持在50%以上,而当浓度达到2.4%时藜麦种子的发芽率降为5.36%,当浓度达到3.0%时藜麦种子几乎不萌发,说明藜麦种子萌发的耐盐阈值为1.8%。
形态变化是植物遭受逆境胁迫时最直接的反映。研究表明盐胁迫下由于植物碳同化量减少,渗透调节能耗和维持生长能耗增加等原因,常导致植株生长量减少[24-25]。本试验中,盐胁迫下藜麦的株高、茎粗均有不同程度降低,而根长随着NaCl浓度的增加呈先升高后降低的趋势。这与 Jaleel等[26]的报道一致。这可能是藜麦幼苗对低浓度NaCl 胁迫的一种应激反应,通过促进根的生长以增强根系吸收水的面积,从而抵抗高盐浓度引起的渗透胁迫[27],但是关于它发生的机制还需进一步研究,而地上部分生长均受NaCl胁迫所抑制。叶绿素是植物进行光合作用所必需的,植物在受到盐胁迫时会积累光合色素,有利于植株在盐胁迫下维持正常的光合作用,从而增强植株对盐胁迫的耐受能力[28]。本试验结果表明藜麦幼苗叶片叶绿素含量在0.6%~1.2%NaCl浓度下显著升高,之后随着NaCl浓度的升高,叶绿素含量急剧下降,说明低盐浓度处理可促进藜麦幼苗生长,这与对超大甜椒种子的研究结果相近[29]。
可溶性糖和脯氨酸作为渗透调节物质在植物适应盐分环境中发挥着重要作用,能够提高细胞的渗透调节能力,降低因渗透失水而造成的细胞膜、酶及蛋白质结构与功能的损伤[30]。本研究发现随着NaCl浓度的升高,藜麦幼苗叶片可溶性糖和脯氨酸含量均显著升高,造成这一结果可能是由于盐胁迫导致藜麦幼苗叶片细胞内外出现渗透不平衡,可溶性糖和脯氨酸含量大量增加,以提高植株吸水能力、抵御盐胁迫造成的损伤。植物遭受盐胁迫后体内活性氧产生和清除动态被破坏,活性氧水平上升导致MDA大量累积,造成膜脂过氧化作用,使膜蛋白受损,细胞结构损害[31]。本研究结果表明,当盐浓度低于1.2%时,藜麦幼苗叶片MDA含量、相对电导率和超氧阴离子产生速率增加平缓,当盐浓度高于1.8%时,藜麦幼苗叶片中上述各指标急剧增加,这与NaCl胁迫对茄子幼苗生理指标的影响[29]结果相近,表明NaCl胁迫破坏了藜麦幼苗叶片的质膜结构和功能,加剧了膜脂过氧化作用,细胞膜受到损伤。植物的保护酶体系可以清除体内累积的活性氧来缓解由盐胁迫对植物造成的损伤,SOD作为膜保护的第一道防线,将毒性较强的O2-·转化为毒性较轻的H2O2,最终由POD和CAT将H2O2歧化为H2O和O2[11]。本试验结果表明,NaCl浓度在0.6%~1.8%时,藜麦幼苗叶片中SOD、POD和CAT活性显著升高,说明低盐胁迫下藜麦植株叶片能够通过提高自身的 SOD 活性来清除过量积累的活性氧;当NaCl浓度在2.4%~3.0%时,藜麦植株叶片SOD和CAT活性显著低于对照,说明过高的盐浓度导致藜麦植株的抗氧化酶系统受损,清除活性氧能力下降,导致藜麦生长发育受阻,最终死亡。
References:
[1] Yang S H, Ji J, Wang G,etal. Effect of salt stress on the plant.Molecular Plant Breeding, 2006, 4(3): 139-142. 杨少辉, 季静, 王罡, 等. 盐胁迫对植物影响的研究进展. 分子植物育种, 2006, 4(3): 139-142.
[2] Lv J Y, Zhao H, Feng W J. Effect of NaCl stress on activity of protective enzyme and physiological characteristics in sweet sorghum.Agricultural Research in Arid Areas, 2008, 26(6): 133-137. 吕金印, 赵晖, 冯万健. NaCl 胁迫对甜高粱幼苗保护酶活性等生理特性的影响. 干旱地区农业研究, 2008, 26(6): 133-137.
[3] Royar, Aliakbar E, Nagib A,etal. Proteome analysis of tobacco leaves under salt stress. Peptides, 2009, 30(9): 1651-1659.
[4] Zhou H T, Liu H, Yao Y,etal. Evaluation of agronomic and quality characters of quinoa cultivated in Zhangjiakou. Journal of Plant Genetic Resources, 2014, 15(1): 222-227. 周海涛, 刘浩, 么杨, 等. 藜麦在张家口地区试种的表现与评价. 植物遗传资源学报, 2014, 15(1): 222-227.
[5] Tan B, Tan H Z, Liu M,etal. Making activated protein feed from starch Wastewater. Journal of the Chinese Cereals and Oils Association, 2010, (4): 100-107. 谭斌, 谭洪卓, 刘明, 等. 粮食(全谷物)的营养与健康. 中国粮油学报, 2010, (4): 100-107.
[6] Wang L M, Ma N, Li S,etal. Nutritional properties of quinoa and its application prospects. Science and Technology of Food Industry, 2014, (1): 381-389. 王黎明, 马宁, 李颂, 等. 藜麦的营养价值及其应用前景.食品工业科技, 2014, (1): 381-389.
[7] Jacobsen S E, Quispe H. An alternative crop for saline soils in Ands[R]// Scientists and Farmer-Partners in Research for the 21st Century. CIP Program Report, 1999-2000: 403-408.
[8] Prado F E, Boero C, Gallardo M,etal. Effect of NaCl on germination, growth, and soluble sugar content inChenopodiumquinoaseeds. Botanical Bulletin of Academia Sinica, 2000, 41: 27-34.
[9] Wang C J, Zhao X W, Lu G Q,etal. A review of characteristics and utilization ofChenopodiumquinoa. Journal of Zhejiang Agricultural and Forestry University, 2014, 31(2): 296-301. 王晨静, 赵习武, 陆国权, 等. 藜麦特性及开发利用研究进展. 浙江农林大学学报, 2014, 31(2): 296-301.
[10] Li B B, Wei X H, Xu Y. The causes ofGentianastramineaMaxim. seeds dormancy and the methods for its breaking. Acta Ecologica Sinica, 2013, 33(15): 4631-4638. 李兵兵, 魏小红, 徐严. 麻花秦艽种子休眠机理及其破除方法. 生态学报, 2013, 33(15): 4631-4638.
[11] Liu W Y, Yang H W, Wei X H,etal. Effect of exogenous nitric oxide on seed germination, physiological characteristics and active oxygen metabolism ofMedicagotruncatulaunder NaCl stress. Acta Prataculturae Sinica, 2015, 24(2): 85-95. 刘文瑜, 杨宏伟, 魏小红, 等. 外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究. 草业学报, 2015, 24(2): 85-95.
[12] Zeng X L, Cao C Y, Gao F F,etal. Toxicological effects of Cd2+and Pb2+on the seed germination and seedling growth ofAstragalusadsurgens. Acta Prataculturae Sinica, 2008, 17(4): 71-77. 曾祥玲, 曹成有, 高菲菲, 等. 镉、铅对沙打旺种子萌发及早期生长发育的毒性效应. 草业学报, 2008, 17(4): 71-77.
[13] Jiang Y B, Zheng Q H, Wang C Z,etal. Effects of ultradrying storage on vigor and antioxidase activity ofCichoriunintybusseeds. Acta Prataculturae Sinica, 2009, 18(5): 93-97. 姜义宝, 郑秋红, 王成章, 等. 超干贮藏对菊苣种子活力与抗氧化性的影响. 草业学报, 2009, 18(5): 93-97.
[14] Guo Z P. Effects of Phosphorus and Potassium Fertilizers Influence Tuber Yield and Quality and Relevant Physiological Processes of Potatoes[D]. Wuhan: Huazhong Agricultural University, 2009. 郭志平. 施用磷钾肥对马铃薯产量和品质及相关生理指标的影响[D]. 武汉: 华中农业大学, 2009.
[15] Li H S. The Experiment Principle and Technique on Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2000: 169-184. 李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2000: 169-184.
[16] Wang A G, Luo G H. Quantitative relation between the of hydroxylamine and superoxide anion radicals in plants. Plant Physiology Communication, 1990, 26(2): 55-57. 王爱国, 罗广华. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, 1990, 26(2): 55-57.
[17] Giannopolitis C N, Ries S K. Purification and quantitative relationship with water-soluble protein in seedling. Plant Physiology, 1977, 59: 315-318.
[18] Shi J, Fu X Z, Peng T,etal. Spermine pretreatment confers dehydration tolerance of citrusinvitroplants via modulation of antioxidative capacity and stomatal response. Tree Physiology, 2010, 30(7): 914-922.
[19] Aebi H. Catalaseinvitro. Methods in Enzymology, 1984, 105: 121-126.
[20] Macke A J, Unger I A. The effect of salinity on germination and early growth ofPuccinellanuttalliana. Canadian Journal of Botany, 1971, 49: 515-520.
[21] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189. 刘凤岐, 刘杰琳, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[22] Wang F, Liu S Z, Liu Y J,etal. Response ofPiceamongolicaandPiceacrassifoliaseed germination and seedling growth to drought and salt stress. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(11): 2309-2316. 王飞, 刘世增, 刘有军, 等. 沙地云杉和青海云杉种子萌发和幼苗生长对干旱盐碱胁迫的响应. 西北植物学报, 2014, 34(11): 2309-2316.
[23] Waisel Y. Biology of Halophytes[M]. New York: Academic Press, 1972.
[24] Li Y, Zhang Y P, Sun M,etal. Research advance in the effects of salt stress on plant and the mechanism of plant resistance. Chinese Agricultural Science Bulletin, 2008, 24(1): 258-263. 李彦, 张英鹏, 孙明, 等. 盐分胁迫对植物的影响及植物耐盐机理研究进展. 中国农学通报, 2008, 24(1): 258-263.
[25] Duan J J, Zhang C, Zheng M M,etal. Evaluation for salt tolerance ofMarigoldcultivars. Journal of Nuclear Agricultural Sciences, 2015, 29(7): 1406-1418. 段九菊, 张超, 郑梅梅, 等. 万寿菊不同品种的耐盐性综合评价. 核农学报, 2015, 29(7): 1406-1418.
[26] Jaleel C A, Gopi R, Sanka R B,etal. Studies on germination, seedling vigour, lipid peroxidation and proline metabolism inCatharanthusroseusseedlings under salt stress. South African Journal of Botany, 2007, 73(2): 190-195.
[27] Song X L, Hou X L, Hu C M,etal. Seed germination and seedling growth of sweet pepper under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(3): 569-575. 宋旭丽, 侯喜林, 胡春梅, 等. NaCl胁迫对超大甜椒种子萌发和幼苗生长的影响. 西北植物学报, 2011, 31(3): 569-575.
[28] Ding J, Huang Z, Zhang X X,etal. Physiological effects onBrassicanapusseedling under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(11): 2270-2276. 丁娟, 黄镇, 张学贤, 等. 甘蓝型油菜苗期生长阶段对NaCl胁迫的生理响应. 西北植物学报, 2014, 34(11): 2270-2276.
[29] Zhang L, Wang H, Xu Q,etal. Effects of NaCl stress on physiological indexes of eggplant seedlings. Journal of Anhui Agricultural University, 2014, 41(6): 965-970. 张玲, 王华, 徐强, 等. NaCl胁迫对茄子幼苗生理指标的影响. 安徽农业大学学报, 2014, 41(6): 965-970.
[30] Liu Y H, Wang X P, Zhang G X,etal. Study on selection of physiological indices for salt tolerance and comprehensive evaluation of cotton during seedling stage. Chinese Agricultural Science Bulletin, 2012, 28(6): 73-78. 刘雅辉, 王秀萍, 张国新, 等. 棉花苗期耐盐生理指标的筛选及综合评价. 中国农学通报, 2012, 28(6): 73-78.
[31] Wang Y X, Sun G R, Wang J B,etal. Relationships among MDA content, plasma membrane permeability and the chlorophyll fluorescence parameters ofPuccinelliatenuifloraseedlings under NaCl stress. Acta Ecologica Sinica, 2006, 26(1): 122-129. 汪月霞, 孙国荣, 王建波, 等. NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系. 生态学报, 2006, 26(1): 122-129.
Seed germination and physiological characteristics ofChenopodiumquinoaunder salt stress
YANG Hong-Wei1,2, LIU Wen-Yu3, SHEN Bao-Yun4, LI Chao-Zhou1,2*
1.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China; 2.GansuKeyLaboratoryofCropGenetics&GermplasmEnhancement,Lanzhou730070,China; 3.AnimalHusbandryPastureandAgricultureInstitute,GansuAcademyofAgricultureScience,Lanzhou730070,China; 4.JingtaiTiaoshanResearchInstituteofAgricultureandForestry,Baiyin730400,China
In this study, we evaluated the effects of different concentrations of NaCl on seed germination and seedling growth ofChenopodiumquinoa. Seeds and seedlings ofC.quinoawere exposed to different concentrations of NaCl, and seed germination, physiological indexes, and biochemical indexes were determined. The germination percentage, germination energy, germination index, and vigor index ofC.quinoaseeds decreased as the concentration of NaCl increased. When the concentration of NaCl was 3.0%, none of the quinoa seeds germinated. As the concentration of NaCl increased, the leaf water content decreased, the contents of soluble sugars, proline, malondialdehyde, relative conductance, and O2-·production rate increased, and the activities of superoxide dismutase, peroxidase, and catalase increased and then decreased. The plant height and stem diameter decreased as the NaCl concentration increased, but root lengths increased and then decreased. The longest root length was in the 1.8% NaCl treatment. In conclusion, seedling growth ofC.quinoawas promoted by low concentrations of NaCl, but inhibited by high concentrations of NaCl. The threshold of salt tolerance was 1.8% NaCl.
NaCl;Chenopodiumquinoa; seed germination; physiological characteristics
10.11686/cyxb2016394
http://cyxb.lzu.edu.cn
2016-10-31;改回日期:2017-01-10
国家科技支撑计划项目(2012BAD06B03)和十三五马铃薯产业体系(CARS-10-02A,CARS-10-07B)资助。
杨宏伟(1992-),男,甘肃庄浪人,在读硕士。E-mail:yiluxiangbei0676@163.com*通信作者Corresponding author. E-mail:licz@gsau.edu.cn
杨宏伟, 刘文瑜, 沈宝云, 李朝周. NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响. 草业学报, 2017, 26(8): 146-153.
YANG Hong-Wei, LIU Wen-Yu, SHEN Bao-Yun, LI Chao-Zhou. Seed germination and physiological characteristics ofChenopodiumquinoaunder salt stress. Acta Prataculturae Sinica, 2017, 26(8): 146-153.
