海藻糖对盐胁迫下玉米幼苗生长及生理特性的影响
2017-09-03田礼欣曲丹阳毕文双谢腾龙李晶
田礼欣,曲丹阳,毕文双,谢腾龙,李晶
(东北农业大学农学院,黑龙江 哈尔滨 150030)
海藻糖对盐胁迫下玉米幼苗生长及生理特性的影响
田礼欣,曲丹阳,毕文双,谢腾龙,李晶*
(东北农业大学农学院,黑龙江 哈尔滨 150030)
本研究以玉米品种“郑单958”为材料,采用水培试验,探究了外源施加海藻糖对盐胁迫下玉米幼苗生物量、叶绿素含量、膜脂过氧化、抗氧化酶活性以及渗透调节物质等生长和生理特性的影响。结果表明,与对照处理比较,150 mmol/L的盐胁迫显著降低了玉米幼苗地上部干鲜重、叶面积及叶绿素含量,丙二醛(MDA)、脯氨酸(Pro)及可溶性蛋白含量增加、质膜相对透性增大,抗氧化酶活性下降。与盐胁迫处理比较,施加10 mmol/L的海藻糖处理显著增加了盐胁迫下玉米幼苗的生物量和叶绿素含量,降低了MDA含量、Pro含量及质膜相对透性,提高了超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性,促进了可溶性蛋白含量的积累。上述结果表明外源施加海藻糖对盐胁迫下玉米幼苗生长具有一定的缓解作用,从而增强玉米幼苗对盐胁迫的抗性。
海藻糖;盐胁迫;玉米;抗氧化酶;渗透调节
土壤盐渍化是世界性问题,据已有资料统计,全世界大约有20%土地受到盐渍化影响。中国是全球盐渍化土地面积较大的国家之一,约有0.36亿hm2的盐碱地,其中660万hm2是农业耕地,占据全国耕地面积的7%左右[1]。土壤中盐分的积累对植物生长有很大的危害,土壤中盐分会导致植物由离子失衡而引起离子毒害、营养亏缺和渗透胁迫[2]等。目前,对于土壤盐渍化领域关注的热点是植物对盐胁迫的适应能力,这种适应能力是一个综合的生理调节过程,需要各种生理生化过程的共同调控[3]。玉米(Zeamays)作为一种典型的盐敏感高等植物,当盐浓度较高时,盐胁迫会干扰离子稳态,产生活性氧,破坏膜脂透性,生理代谢紊乱,抑制玉米生长,最终导致植株减产甚至死亡[4]。赵莹等[5]研究表明,外源葡萄糖和蔗糖处理可以显著促进盐胁迫下玉米幼苗干物质的积累以及提高叶片超氧化物歧化酶(SOD)的活性等。薛盈文等[6]研究发现,外源施加NO显著缓解盐胁迫对玉米幼苗生长的抑制作用并且降低玉米幼苗叶片中可溶性蛋白含量。中国作为世界上第二大玉米生产国,玉米占全国粮食种植面积的25%左右,研究提高玉米耐盐性的合理措施,对于未来农业可持续发展具有重要意义。
海藻糖(trehalose)是一种非还原性双糖,在水稻(Oryzasativa)[7]、小麦(Triticumaestivum)[8]和烟草(Nicotianatabacum)[9]等植物体中含量很低,逆境条件下植物可以通过调节自身的海藻糖含量,稳定蛋白质的结构与功能[10]。海藻糖还是一种渗透调节物质,既能保护抗氧化酶系统和亚细胞结构,又能介导渗透调节和清除活性氧[6,11]。已有大量研究表明,外源施加海藻糖能够提高生物体对低温[12]、干旱[13]和盐害[14]等逆境条件的抗性。海藻糖能缓解盐胁迫对小麦幼苗生长的抑制作用[15]、有效提高盐胁迫下甜瓜(Cucumismelo)幼苗的抗氧化酶活性[16]、提高盐胁迫对水稻幼苗的光合作用[17]、还能提高盐胁迫下拟南芥(Arabidopsisthaliana)幼苗的渗透调节物质含量[18]。但是对于外源施加海藻糖缓解盐胁迫下对玉米幼苗的伤害机理却鲜有报道。为此,本研究以玉米为材料,旨在探究盐胁迫下施加海藻糖对玉米幼苗光合作用生理指标、渗透调节物质、抗氧化酶活性以及膜脂过氧化的变化,以期筛选出适宜的海藻糖浓度,为玉米在盐胁迫下能够合理栽培提供理论与技术依据。
1 材料与方法
1.1 试验材料与方法
玉米种子为黑龙江唯农种业公司提供的“郑单958”。海藻糖为国药集团化学试剂有限公司生产的分析纯试剂。
本试验于2016年7月在东北农业大学农学院玉米栽培生理实验室进行。选择籽粒饱满的玉米种子于75%乙醇中浸泡10 s,然后放置在2%次氯酸钠溶液中消毒5 min,用蒸馏水冲洗数次后于蒸馏水中浸泡24 h,均匀摆放在长40.5 cm,宽31.0 cm,高10.0 cm的长槽中,放置在(温度28 ℃,湿度70%,光照4000 lx)HPG-280HX型人工智能培养箱(北京东联哈尔仪器制造有限公司生产)中培养。种子胚芽生长至0.5 cm左右,选取均匀一致植株,移栽至盛有1/2 Hoagland营养液的硬质塑料盒(1 L)中,每盒定苗6株,待幼苗生长到三叶一心时开始海藻糖预处理,24 h后进行盐胁迫处理。
盐处理采取每12 h递增50 mmol/L的方式,直至最终浓度150 mmol/L(前期筛选最适浓度)。水培过程中保持通气,调节pH在6.2±0.1,营养液每2 d更换1次。处理3 d后取玉米第2片伸展叶进行相关生理指标测定。试验设置6个处理,每个处理4次重复。分别为:1) CK (1/2 Hoagland营养液);2) T0(0 mmol/L海藻糖+150 mmol/L NaCl);3) T1(5 mmol/L海藻糖+150 mmol/L NaCl);4) T2(10 mmol/L海藻糖+150 mmol/L NaCl);5) T3(15 mmol/L海藻糖+150 mmol/L NaCl);6) T4(20 mmol/L海藻糖+150 mmol/L NaCl)。
1.2 测定指标与方法
幼苗干、鲜重的测定,将植株的地上部和地下部分开,用清水冲洗表面杂物,经蒸馏水冲洗干净,用滤纸吸干表面水分,称鲜重,105 ℃下杀青30 min,80 ℃下烘干至恒重,称干重;幼苗叶面积采用YMJ-B便携式叶面积仪测定;叶绿素含量参照张志良等[19]的方法测定;丙二醛(MDA)含量参照张志良等[19]的方法测定;相对电导率测定,选取同等节位叶片(非叶脉)用打孔器对称取叶盘,直径约为1 cm,每次取10个叶盘,去离子水洗净后放入50 mL三角瓶中,加入10 mL去离子水,浸没样品,放置在阴暗处24 h后,用电导率仪(DDS-11A)测其电导率,记为R1,将样品置于沸水浴中加热20 min,杀死组织,使质膜完全破坏,室温自然冷却,测其电导率,记为R2,相对电导率公式为L=R1/R2;超氧化物歧化酶(SOD)活性参照Giannopolitis等[20]的方法测定;过氧化物酶(POD)活性参照愈创木酚法[19]测定;游离脯氨酸(Pro)含量参照郝再彬等[21]的水合茚三酮法测定;可溶性蛋白含量参照张志良等[19]的考马斯亮蓝G-250染色法测定。
1.3 数据处理
采用DPS 7.05和Microsoft Excel 2010软件分析试验中所得数据,采用LSD法进行方差分析。
2 结果与分析
2.1 盐胁迫下不同浓度海藻糖对玉米幼苗生物量的影响
从表1可以看出,盐胁迫显著抑制了玉米幼苗地上部的生长,外源施加海藻糖后缓解了盐胁迫对玉米幼苗地上部生长的抑制作用。与CK处理相比,盐处理后地上部鲜重、干重和叶面积分别减少了37.68%、36.00%和36.79%。与盐胁迫处理相比,施加不同浓度海藻糖后玉米幼苗的生物量均不同程度的增加,其中,T2处理最佳,分别较盐胁迫处理增加了26.99%、26.51%和27.66%。
2.2 盐胁迫下不同浓度海藻糖对玉米幼苗叶绿素含量的影响
从表2可以看出,盐胁迫处理的玉米幼苗叶片的Chla、Chlb、Car和Chl(a+b)含量均较CK处理低,分别较CK处理减少32.52%、38.73%、35.48%和32.69%,与CK均达到显著性差异。说明盐胁迫处理造成玉米幼苗叶片中叶绿体色素的降解。不同浓度海藻糖处理后,各处理的Chla、Chlb、Car和Chl(a+b)含量均高于T0处理,且与T0处理均达到显著性差异,其中10 mmol/L的海藻糖浓度处理最优,分别较盐胁迫处理增加22.19%、29.80%、26.67%和22.68%,说明盐胁迫下海藻糖处理显著促进玉米幼苗叶片中叶绿体色素的合成。
2.3 盐胁迫下不同浓度海藻糖对玉米幼苗膜脂过氧化作用的影响
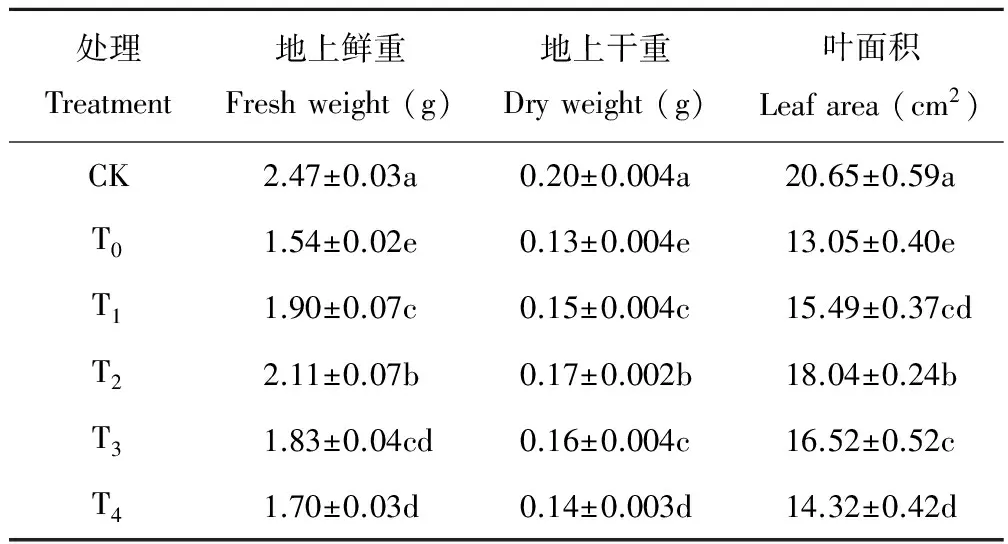
表1 盐胁迫下不同浓度海藻糖处理玉米幼苗生长量的变化
注:同列不同字母表示差异显著(P<0.05),下同。
Note: Different letters in the same column mean significant differences (P<0.05), the same below.

表2 盐胁迫下不同浓度海藻糖处理玉米幼苗叶绿素含量的变化
盐胁迫条件下,玉米幼苗的MDA含量显著高于对照(图1A),与对照相比,盐胁迫处理增加了42.99%;盐胁迫下施加不同浓度海藻糖后,MDA含量的变化呈先下降后上升的趋势,玉米幼苗叶片中MDA含量比盐胁迫处理降低了8.77%~31.32%,其中,T2处理的MDA含量达到最低值。表明盐胁迫导致玉米幼苗叶片的膜脂过氧化,外源施加海藻糖能缓解盐胁迫对膜脂的过氧化作用,减轻膜脂过氧化对玉米幼苗的伤害。
盐胁迫条件下,玉米幼苗的质膜相对透性显著高于对照(图1B),盐胁迫处理较对照增加了45.45%;施加不同浓度海藻糖后,质膜相对透性的变化呈先下降后上升的趋势,玉米幼苗叶片中质膜相对透性比盐胁迫处理降低17.76%~36.02%。表明外源施加海藻糖显著降低了盐胁迫下玉米幼苗叶片的质膜相对透性。

图1 盐胁迫下不同浓度海藻糖处理玉米幼苗MDA含量(A)和质膜相对透性(B)的变化Fig.1 Effects of different concentrations trehalose on MDA content (A) and plasma membrane relative permeability (B) of maize seedlings under salt stress 不同字母表示差异显著(P<0.05),下同。Different letters mean significant differences (P<0.05), the same below.
2.4 盐胁迫下不同浓度海藻糖对抗氧化酶活性的影响
SOD作为植物体内的第一条防线,能特异性将O2-歧化为O2和H2O2[22]。POD能够反映出植物体内代谢状况、生长发育特点和对外界环境的适应性[23]。盐胁迫下玉米幼苗叶片中SOD和POD活性均显著低于对照(图2),与对照相比,SOD活性比对照降低了36.40%(图2A),POD活性比对照降低了32.32%(图2B)。盐胁迫下施加不同浓度海藻糖处理均显著缓解了盐胁迫对SOD和POD活性的抑制作用,不同浓度海藻糖处理的玉米幼苗叶片中SOD活性比盐胁迫处理增加了8.19%~26.68%,POD活性比盐胁迫处理增加了11.76%~22.57%。说明海藻糖处理能够提高盐胁迫下玉米幼苗叶片的抗氧化酶活性,减少活性氧的积累,从而减轻活性氧对玉米幼苗的伤害。
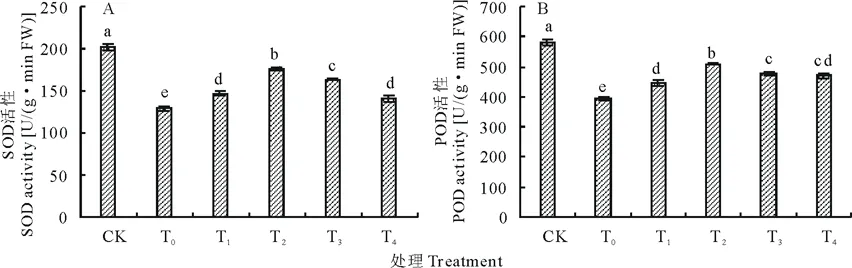
图2 盐胁迫下不同浓度海藻糖处理玉米幼苗SOD(A)、POD(B)活性的变化Fig.2 Effects of different concentrations trehalose on SOD (A)、POD (B) activity of maize seedlings under salt stress
2.5 盐胁迫下不同浓度海藻糖对玉米幼苗渗透调节物质的影响
盐胁迫下玉米幼苗叶片中脯氨酸含量显著高于对照(图3A),与对照相比,增加了36.67%。盐胁迫下施加不同浓度海藻糖,玉米幼苗叶片中脯氨酸含量显著下降,且均达到显著水平,较盐胁迫处理降低了11.89%~28.62%。
盐胁迫下玉米幼苗叶片中可溶性蛋白含量显著增加(图3B),与对照相比,增加了18.49%。施加不同浓度海藻糖后,玉米幼苗叶片中可溶性蛋白含量的变化呈先上升后下降的趋势,较盐胁迫处理增加了6.94%~22.23%。
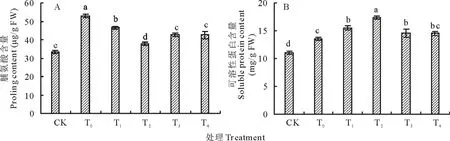
图3 盐胁迫下不同浓度海藻糖处理玉米幼苗脯氨酸(A)、可溶性蛋白(B)含量的变化 Fig.3 Effects of different concentrations trehalose on the contents of proline (A) and soluble protein (B) of maize seedlings under salt stress
3 讨论
生物量是植物对盐胁迫的综合体现,也是植物抗盐性最直接指标[24]。盐分是抑制植物生长最普遍和最主要的非生物因素。已有大量研究表明,盐胁迫使小麦和麻黄(Ephedraaphylla)等植物地上部的生物量显著降低[25-26]。Theerakulp等[27]研究发现,施加海藻糖后,显著提高了盐胁迫下水稻幼苗的干、鲜重等地上部生物量。本研究中,受盐胁迫影响玉米幼苗的生长受到抑制,地上部鲜重、干重和叶面积显著降低。盐胁迫下施加不同浓度海藻糖后,促进了玉米幼苗地上部的鲜重、干重以及叶面积的生长,其中10 mmol/L的海藻糖浓度处理最佳,且达到显著水平,说明施加适当浓度海藻糖能够缓解盐胁迫对玉米幼苗生长的抑制作用。
叶绿素和类胡萝卜素均能保证植物进行正常的光合作用。盐分胁迫使玉米幼苗叶片的光合作用减弱,色素漂白加重,叶绿素含量下降。同时,较高浓度的盐分能够加速叶绿素的分解[5,28]。本研究表明,盐胁迫导致玉米幼苗叶片叶绿素含量显著降低,导致玉米幼苗叶片光合作用降低,延缓玉米生长,与秦雪峰等[28]研究表现一致。进一步分析发现,外源施加不同浓度海藻糖处理在一定程度上缓解了玉米幼苗叶片叶绿素的下降幅度,与Theerakulp等[27]在水稻上的研究结果相似,这可能与施加海藻糖增强活性氧的清除能力,保护玉米幼苗叶绿体膜的稳定性,降低叶绿素分解速率有关。
植物细胞膜的主要功能是维持细胞微环境的稳定以及正常的生理代谢,对物质具有选择透过性[29]。盐胁迫会破坏植物细胞内活性氧的产生与消除之间动态平衡,产生的活性氧会分解质膜内双分子层的不饱和脂肪酸链,打破生物膜结构的稳定性,产生膜脂过氧化产物MDA。因此,MDA含量是衡量膜脂受损程度的重要指标[30]。前人大量研究表明,盐胁迫条件下,外源施加适当浓度海藻糖可以明显降低小麦[31]和水稻[32]幼苗叶片中MDA含量,本研究规律与此一致,盐胁迫导致玉米幼苗叶片MDA含量和质膜相对透性增加,生物膜受到损害,施加适当浓度海藻糖可以有效降低细胞质膜透性,抑制丙二醛在细胞质膜内的积累,其原因可能是由于海藻糖具有很强的抗脱水作用,可以在盐胁迫下保护生物膜结构的完整性,从而缓解活性氧对膜脂的伤害作用[33]。
为了防御活性氧对细胞膜的伤害,植物在长期进化过程中形成了一套有效的活性氧清除系统,即抗氧化酶系统,主要包括SOD、POD和CAT等,它们在植物抗逆方面起着重要的作用[34]。这几种酶在一定程度上可以清除逆境下产生的活性氧,使植物体内活性氧保持在一个较低的水平,从而抑制其在植物体内的积累[35]。已有研究发现,盐胁迫下小麦幼苗叶中SOD活性均显著降低[15],而Yang等[18]对拟南芥的研究表现却有不同,盐胁迫下拟南芥幼苗中SOD酶活性均增加,可能是由于处理时间的差异而导致的。本研究中盐胁迫下玉米幼苗叶片中SOD和POD活性显著降低,10 mmol/L海藻糖处理显著增强了盐胁迫下玉米幼苗的抗逆性,可能是海藻糖提高盐胁迫下玉米幼苗叶片中SOD和POD活性,并保持在相对较高的水平上,从而提高对活性氧自由基的清除能力,降低MDA含量,缓解膜脂过氧化作用对细胞膜的损害,保护膜脂的完整性。这与徐婷等[16]在薄皮甜瓜上的研究也表现出相同规律。
盐胁迫条件下,有机渗透调节物质,如脯氨酸、可溶性蛋白等,可以使细胞保持适当的渗透势而防止细胞失水,同时能够起到保护和稳定生物大分子的功能和结构作用[36]。王宁等[37]和杜锦等[38]发现,盐胁迫下玉米幼苗叶片中脯氨酸和可溶性蛋白含量增加。王三根等[39]研究表明,盐胁迫下显著提高小麦幼苗叶片中脯氨酸含量,外源施加海藻糖后降低了小麦幼苗中脯氨酸含量。本试验中,盐胁迫下玉米幼苗叶片中脯氨酸和可溶性蛋白含量显著增加,其含量的增加可以提高玉米幼苗对盐胁迫的抵抗能力,施加10 mmol/L海藻糖显著降低玉米幼苗叶片中脯氨酸含量,同时也提高盐胁迫下玉米幼苗叶片中可溶性蛋白含量,从而可以增加细胞质浓度,降低细胞渗透势,缓解盐胁迫对玉米幼苗的伤害。
4 结论
综上所述,盐胁迫条件抑制了玉米幼苗叶片地上部的生长,使得叶绿素含量、类胡萝卜素含量、SOD活性和POD活性显著下降,MDA含量、质膜相对透性、脯氨酸和可溶性蛋白含量显著升高;施加不同浓度海藻糖后,均不同程度缓解了盐胁迫对玉米幼苗光合的抑制、维持了幼苗叶片渗透压、保护了生物膜系统的完整性和稳定性,从而增强了玉米幼苗的耐盐性。综合本研究数据得出,海藻糖浓度为10 mmol/L时,是玉米幼苗盐胁迫下生长的最佳浓度。
References:
[1] Sun Y L, Xu Y C, Li S,etal. Research progress on regulatory mechanisms of maize in response to salinity stress. Shandong Agricultural Sciences, 2016, 48(11): 157-163. 孙验玲, 徐远超, 李帅, 等. 玉米耐受盐胁迫的调控机理研究进展. 山东农业科学, 2016, 48(11): 157-163.
[2] Manzoor K, Ilyas N, Batool N,etal. Effect of salicylic acid on the growth and physiological characteristics of maize under stress conditions. Journal-Chemical Society of Pakistan, 2015, 37(3): 587-593.
[3] Zhang J L, Li H R, Guo S Y,etal. Research advances in higher plant adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236. 张金林, 李惠茹, 郭姝媛, 等. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236.
[4] Zhang H, Dong S T. Research progress on the physiological and biochemistry responses of salt tolerance and strategies of salt resistance in maize. Maize Science, 2011, 19(1): 64-69. 张红, 董树亭. 玉米对盐胁迫的生理响应及抗盐策略研究进展. 玉米科学, 2011, 19(1): 64-69.
[5] Zhang Y, Yang K J, Zhao C J,etal. Alleviation of the adverse effects of salt stress by regulating photosynthetic system and active oxygen metabolism in maize seedlings. Scientia Agricultura Sinica, 2014, 47(20): 3962-3972. 赵莹, 杨克军, 赵长江, 等. 外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫. 中国农业科学, 2014, 47(20): 3962-3972.
[6] Xue Y W, Wang Y F, Yang K J,etal. Effects of exogenous nitric oxide on growth and osmoregulatory capability of maize (ZeamaysL.) seedlings under salt stress. Agricultural Research in the Arid Areas, 2016, 34(2): 171-176, 200. 薛盈文, 王玉凤, 杨克军, 等. 外源NO对NaCl胁迫下玉米幼苗生长和渗透调节能力的影响. 干旱地区农业研究, 2016, 34(2): 171-176, 200.
[7] Goddijn O, Verwoerd T C, Voogd E,etal. Inhibition of trehalase activity enhances trehalose accumulation in transgenic. Plant Physiology, 1997, 113(1): 181-190.
[8] Gerats T, Montagu M V, Caplan A B,etal. Effects of osmoprotectants upon NaCl stress in rice. Plant Physiology, 1997, 115(1): 159-169.
[9] Tarek E B, Haluk H, Hüseyin Ö A,etal. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions. Plant Science, 2005, 169(1): 47-54.
[10] Fernandez O, Bethencourt L, Quero A,etal. Trehalose and plant stress responses: friend or foe. Trends Plant Science, 2010, (15): 409-417.
[11] Liu J, Jiang D G. Research advance on trehalose synthesis related genes in crops. Genomics and Applied Biology, 2014, 33(2): 432-437. 刘姣, 姜大刚. 作物海藻糖合成相关基因的研究进展. 基因组学与应用生物学, 2014, 33(2): 432-437.
[12] Xie D W, Wang X N, Fu L S,etal. Effect of exogenous trehalose on germ length and seeding freeze resistance of wheat under cold stress. Journal of Triticeae Crops, 2015, 35(2): 215-223. 谢冬微, 王晓楠, 付连双, 等. 外源海藻糖对冬小麦低温下胚芽长及幼苗抗寒性的影响. 麦类作物学报, 2015, 35(2): 215-223.
[13] Ali Q, Ashraf M, Anwar F,etal. Trehalose-induced changes in seed oil composition and antioxidant potential of maize grown under drought stress. Journal of the American Oil Chemists’ Society, 2012, 89(8): 1485-1493.
[14] Nounjan N, Teerakulpisut P. Effects of exogenous proline and trehalose on physiological responses in rice seedlings during salt-stress and after recovery. Plant Soil & Environment, 2012, 58(7): 309-315.
[15] Ding S H, Li Y Y, Wang B S. Effect of exogenous trehalose on salt tolerance of wheat seedlings. Acta Botanica Boreali-occidentalia Sinica, 2005, 25(3): 513-518. 丁顺华, 李艳艳, 王宝山. 外源海藻糖对小麦幼苗耐盐性的影响. 西北植物学报, 2005, 25(3): 513-518.
[16] Xu T, Zhou C Y, Zhou C,etal. Effect of trehalose on antioxidant system of melon seeding under salt stress. Northern Horticulture, 2014, (19): 28-30. 徐婷, 周传余, 周超, 等. 海藻糖对盐胁迫下薄皮甜瓜幼苗抗氧化系统的影响. 北方园艺, 2014, (19): 28-30.
[17] Abdallah M S, Abdelgawad Z A, El-Bassiouny H M S. Alleviation of the adverse effects of salinity stress using trehalose in two rice varieties. South African Journal of Botany, 2016, 103: 275-282.
[18] Yang L, Zhao X, Zhu H,etal. Exogenous trehalose largely alleviates ionic unbalance, ROS burst, and PCD occurrence induced by high salinity inArabidopsisseedlings. Frontiers in Plant Science, 2014, 5: 1-11.
[19] Zhang Z L, Zhai W J. Plant Physiology Experiment Guide[M]. Beijing: Higher Education Press, 2003. 张志良, 翟伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003.
[20] Giannopolitis C N, Ries S K. Superoxide dismutase. I. occurrence in higher plants. Plant Physiology, 1977, 59: 309-314.
[21] Hao Z B, Cang J, Xu Z. Plant Physiology Experiment[M]. Harbin: Harbin Institute of Technology Press, 2004. 郝再彬, 苍晶, 徐仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2004.
[22] Carl N, Ayah D. Snapshot: reactive oxygen intermediates. Cell, 2010, 140: 952.
[23] Yang S Y, Chen X Y, Hui W K,etal. Progress in responses of antioxidant enzyme systems in plant to environmental stresses. Journal of Fujian Agriculture and Forestry University: Natural Science Edition, 2016, 45(5): 481-489. 杨舒贻, 陈晓阳, 惠文凯, 等. 逆境胁迫下植物抗氧化酶系统响应研究进展. 福建农林大学学报: 自然科学版, 2016, 45(5): 481-489.
[24] Wang L Y, Zhao K F. Some physiological response ofZeamaysunder salt-stress. Acta Agronomica Sinica, 2005, 31(2): 264-266. 王丽燕, 赵可夫. 玉米幼苗对盐胁迫的生理响应. 作物学报, 2005, 31(2): 264-266.
[25] Abebe T, Guenzi A C, Martin B,etal. Tolerance of mannitol-accumulating wheat to water stress and salinity. Plant Physiology, 2003, 131(4): 1748-1755.
[26] Alqarawi A A, Allah E F A, Hashem A. Alleviation of salt-induced adverse impact via mycorrhizal fungi inEphedraaphyllaForssk. Journal of Plant Interactions, 2014, 9(1): 802-810.
[27] Theerakulp P, Phongngarm S. Alleviation of adverse effects of salt stress on rice seedlings by exogenous trehalose. Asian Journal of Crop Science, 2013, 5(4): 405-415.
[28] Qin X F, Gao Y F, Lv W Y. Effects of NaCl stress on the seed germination and the seeding growth of four kinds of corn varieties. Seed, 2007, 26(5): 24-26. 秦雪峰, 高扬帆, 吕文彦. NaCl胁迫对玉米种子萌发和幼苗生长的影响. 种子, 2007, 26(5): 24-26.
[29] Wang F, Chang P P, Chen Y P,etal. Effect of exogenous nitric oxide on seeding growth and physiological characteristics of maize seedings under cadmium stress. Acta Prataculturae Sinica, 2013, 22(2): 178-186. 王芳, 常盼盼, 陈永平, 等. 外源NO对镉胁迫下玉米幼苗生长和生理特性的影响. 草业学报, 2013, 22(2): 178-186.
[30] Mittler R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 2002, 7(9): 405-410.
[31] Yan D L, Zheng B S. Effects of soaking seeds in trehalose on physiological characteristics of wheat Yangmai-19 under salt stress. Acta Agriculturae Zhejiangensis, 2016, 28(8): 1271-1276. 闫道良, 郑炳松. 海藻糖浸种对盐胁迫下扬麦19生理特性的影响. 浙江农业学报, 2016, 28(8): 1271-1276.
[32] Theerakulpisut P, Gunnula W. Exogenous sorbitol and trehalose mitigated salt stress damage in salt-sensitive but not salt-tolerant rice seedlings. Asian Journal of Crop Science, 2012, 4(4): 165-170.
[33] Chen S L, Peng Y, Zhou H,etal. Research advances in trehalose metabolism and trehalose-6-phosphate signaling in plants. Plant Physiology Journal, 2014, 50(3): 233-242. 陈素丽, 彭瑜, 周华, 等. 植物海藻糖代谢及海藻糖-6-磷酸信号研究进展. 植物生理学报, 2014, 50(3): 233-242.
[34] Liu J X, Wang X, Li B P. Effects of exogenous nitric oxide donor SNP on ascorbate-glutathione cycle metabolism in ryegrass seedling leaves under NaCl stress. Acta Prataculturae Sinica, 2010, 19(2): 82-88. 刘建新, 王鑫, 李博萍. 外源一氧化氮供体SNP对NaCl胁迫下黑麦草幼苗叶片抗坏血酸-谷胱甘肽循环的影响. 草业学报, 2010, 19(2): 82-88.
[35] Wang L X, Zhao Z G, Wang S M. Effect of nitric oxide on metabolism of reactive oxygen species and membrane lipid peroxidation inTriticumaestivumleaves under water stress. Acta Prataculturae Sinica, 2006, 15(4): 104-108. 王罗霞, 赵志光, 王锁民. 一氧化氮对水分胁迫下小麦叶片活性氧代谢及膜脂过氧化的影响. 草业学报, 2006, 15(4): 104-108.
[36] Tian X Y, Liu Y J, Guo Y C. Effect of salt stress on Na+, K+, proline, soluble sugar and protein of NHC. Pratacultural Science, 2008, 25(10): 34-38. 田晓艳, 刘延吉, 郭迎春. 盐胁迫对NHC牧草Na+、K+、Pro、可溶性糖及可溶性蛋白的影响. 草业科学, 2008, 25(10): 34-38.
[37] Wang N, Cao M J, Yu J L. Effects of NaCl stress on organic osmotica of maize seedlings. Maize Science, 2009, 17(4): 61-65, 69. 王宁, 曹敏建, 于佳林. NaCl胁迫对玉米幼苗有机渗透调节物质的影响. 玉米科学, 2009, 17(4): 61-65, 69.
[38] Du J, Xiang C Y, Zhang H Y,etal. Effects of NaCl stress on osmosis-regulating substance and Na+, K+, Ca2+contents of maize seedling. Seed, 2014, 33(7): 19-23. 杜锦, 向春阳, 张红颖, 等. NaCl胁迫对玉米幼苗渗透调节物质及Na+、K+、Ca2+含量的影响. 种子, 2014, 33(7): 19-23.
[39] Wang S G, Deng R F, Zhuang Y,etal. Effects of trehalose pretreatments on salt resistance in wheat seedings. Journal of Southwest Agricultural University, 1992, 14(2): 182-185. 王三根, 邓如福, 装炎, 等. 海藻糖提高绵阳15号小麦幼苗耐盐能力的研究. 西南农业大学学报, 1992, 14(2): 182-185.
Trehalose alleviates the negative effects of salinity on the growth and physiological characteristics of maize seedlings
TIAN Li-Xin, QU Dan-Yang, BI Wen-Shuang, XIE Teng-Long, LI Jing*
CollegeofAgronomy,NortheastAgriculturalUniversity,Haerbin150030,China
The aim of this study was to investigate the effects of exogenous trehalose on the growth of maize seedings under salt stress. We evaluated the plant biomass, chlorophyll content, membrane lipid peroxidation, antioxidant enzyme activities, and contents of osmotic adjustment substances in maize seedlings (variety Zhengdan 958) in the control (no NaCl) and under salinity stress (150 mmol/L NaCl) with and without trehalose treatment. The results showed that, compared with the control, salt-stressed seedlings showed significantly lower dry weight, fresh weight, leaf area, chlorophyll content, and antioxidant enzyme activities, and significantly higher malondialdehyde (MDA) content, proline (Pro) content, soluble protein content, and membrane permeability. Among the salt-stressed maize seedlings, those treated with 10 mmol/L trehalose showed significantly increased biomass and chlorophyll content, decreased MDA content, Pro content, and membrane permeability, increased superoxide dismutase (SOD) and peroxidase (POD) activities, and increased soluble protein contents. These results indicated that exogenous trehalose could alleviate the negative effects of salinity stress on maize seedlings, and increase the resistance of maize seedlings to salinity stress.
trehalose; salinity stress; maize; antioxidant enzymes; osmotic adjustment
10.11686/cyxb2017156
http://cyxb.lzu.edu.cn
2017-03-29;改回日期:2017-04-10
国家科技支撑计划项目(2012BAD14B06)和东北春玉米减灾保产调控关键技术研究(2017YFD0300405)资助。
田礼欣(1993-),男,黑龙江绥化人,在读硕士。E-mail:tian930322@163.com*通信作者Corresponding author. E-mail:jingli1027@163.com
田礼欣, 曲丹阳, 毕文双, 谢腾龙, 李晶. 海藻糖对盐胁迫下玉米幼苗生长及生理特性的影响. 草业学报, 2017, 26(8): 131-138.
TIAN Li-Xin, QU Dan-Yang, BI Wen-Shuang, XIE Teng-Long, LI Jing. Trehalose alleviates the negative effects of salinity on the growth and physiological characteristics of maize seedlings. Acta Prataculturae Sinica, 2017, 26(8): 131-138.
