静原鸡ELOVL2和ELOVL5基因表达的组织特异性研究
2017-09-03顾亚玲刘丽元杨彦军安克龙
母 童,张 娟,赵 平,顾亚玲,刘丽元,杨彦军,安克龙,王 有
(宁夏大学 农学院,宁夏 银川 750021)
静原鸡ELOVL2和ELOVL5基因表达的组织特异性研究
母 童,张 娟*,赵 平,顾亚玲,刘丽元,杨彦军,安克龙,王 有
(宁夏大学 农学院,宁夏 银川 750021)
采用实时荧光定量PCR(qRT-PCR)技术对宁夏地方优良品种静原鸡的肝脏、肌肉、心脏、睾丸、卵巢、腹脂6个组织中ELOVL2和ELOVL5基因的表达量进行了测定,并通过SAS8.2软件进行分析统计。结果表明,ELOVL2和ELOVL5基因在静原鸡6个不同组织中均有表达。其中ELOVL2基因在肝脏中的相对表达量最高,为71.52±0.41,显著高于其他组织(P<0.05);其次是卵巢、睾丸、腹脂、心脏及肌肉,在另外5个组织中表达量虽有差异,但均差异不显著(P>0.05)。ELOVL5基因在静原鸡不同组织中的相对表达量依次为:肝脏>腹脂>卵巢>睾丸>心脏>肌肉,同样在肝脏中的表达量最高,为110.94±0.02,显著高于其他组织(P<0.05),在腹脂中的表达量显著高于卵巢、睾丸、心脏和肌肉(P<0.05)。另外在心脏和肌肉中的表达量均差异不显著(P>0.05)。对ELOVL2和ELOVL5基因分别在不同组织中的表达差异进行分析比较,发现两个基因在腹脂中的表达量差异显著(P<0.05),ELOVL5基因在腹脂中的表达量较高。研究结果说明,ELOVL2和ELOVL5基因在静原鸡6种组织中的表达存在差异,并以肝脏组织最为明显,这为地方品种的开发与利用、种质资源遗传评定及地方品种分子育种技术平台的构建奠定了一定的理论基础。
静原鸡;ELOVL2;ELOVL5;相对表达量
固原鸡在2006年农业部重新认定地方优良畜禽品种时改名为静原鸡(详见“中华人民共和国农业部公告第662号公告”),属国家级畜禽遗传资源保护品种[1],其分布地域较广,以六盘山东麓彭阳县北部及原州区东部的寨科、马渠、官厅等乡镇为优良产区。由于得天独厚的地理环境条件、独特的饲养方式,静原鸡肉质细嫩,营养价值高,滋补性好,其氨基酸含量丰富,比例适当,尤其含有较高对人体有特殊营养价值的多不饱和脂肪酸(二十碳五烯酸、二十二碳六烯酸),实属鸡肉中首选的“绿色营养保健”食品。有研究表明,鸡肉的营养价值、风味与脂肪酸的组成和含量密切相关[2]。脂肪酸(FA)的基本化学结构由一条碳氢链和一个末端羧基组成,是生物机体内代谢调控、能量存储及信息传递的重要细胞组成部分[3],根据碳氢链双键的有无又可分为不饱和脂肪酸和饱和脂肪酸两类。极长链脂肪酸延伸酶家族基因(elongation of very-long-chain fatty acids,ELOVLs)是哺乳动物脂肪酸合成的起始酶和限速酶,在催化生成长链脂肪酸(C16、C18)和超长链脂肪酸(≥C20)的过程中起重要作用[4]。己被发现并确定的ELOVLs共有7个成员,其中主要参与饱和脂肪酸和单不饱和脂肪酸合成的有ELOVL1、ELOVL3、ELOVL6和ELOVL7,多不饱和脂肪酸合成主要与ELOVL2、ELOVL4和ELOVL5有关[5-6]。目前对ELOVLs基因的研究已经是国内外的研究热点之一。有研究表明,ELOVL2基因rs3798713和rs2281591位点及其组成的单倍型与乳母乳汁DHA水平无关联[7]。哺乳动物细胞CHO-K1细胞内的EPA向DHA的转化可以通过ELOVL2延长酶和△6desaturase的过表达来实现,从而提高DHA的产量[8]。ELOVL2过表达还可以导致过氧化物体增殖物激活受体γ所调控的生脂基因如FABP4、DGAT2等的表达,增强甘油三酯TG的合成和脂滴积累[9]。Zadravec等[10]研究发现,ELOVL2在由C24∶5n-6合成C30∶5n-6不饱和脂肪酸过程中起重要作用。ELOVLs基因在生物机体内的表达较为广泛,其中ELOVL2在肝脏和性腺中高表达[11]。谢帝芝等[12]研究认为,植物油饲料中添加的LNA/LA比(1.09∶1)可促进鲤鱼肝脏内ELOVL5-a mRNA的表达,进而提高鱼体内源LC-PUFA的合成量。ELOVLs基因的表达特异性研究目前已在多种动物中展开,但对静原鸡ELOVL2和ELOVL5基因在不同组织中表达的相关研究未见报道。
本研究采用qRT-PCR技术对静原鸡ELOVL2和ELOVL5基因mRNA在不同组织中表达规律进行研究,旨在为进一步研究该基因在禽类不同组织中的表达情况提供理论依据,为开展地方品种种质资源遗传评定及构建地方品种分子育种的技术平台奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
本试验所用静原鸡各组织采自宁夏回族自治区固原市彭阳县朝那鸡繁育中心,随机选取提纯复壮后的第五世代种鸡(150日龄)18只,屠宰后分别采集母鸡的卵巢、脂肪、肌肉、心脏、肝脏和公鸡的睾丸共6种组织,迅速放入液氮罐中带回实验室并保存在-80 ℃低温冰箱中备用。
1.1.2 引物设计与合成
根据NCBI上提供的鸡ELOVL2(登录号:NM_001197308)和ELOVL5(登录号NM_001199197)以及β-actin(登录号:NM_205518)的基因序列,通过Primer Premier 5.0软件设计目的基因(ELOVL2、ELOVL5)和内参基因(β-actin)的引物,并由上海生工生物工程技术服务有限公司合成,引物序列见表1。
表1 静原鸡ELOVL2、ELOVL5、β-actin基因引物序列
Table 1 Primer sequences ofELOVL2、ELOVL5、β-actingene of Jingyuan chicken
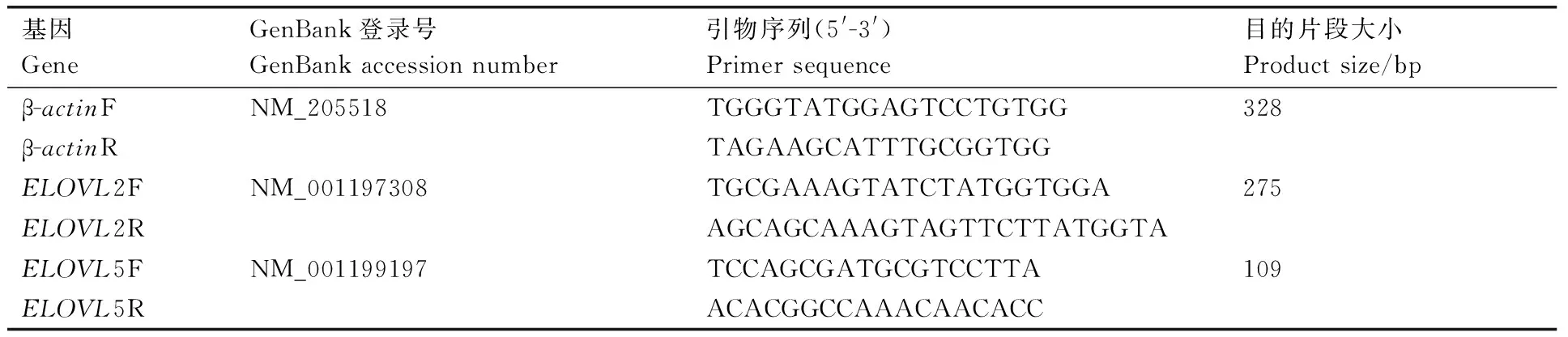
基因GeneGenBank登录号GenBankaccessionnumber引物序列(5'-3')Primersequence目的片段大小Productsize/bpβ-actinFNM_205518TGGGTATGGAGTCCTGTGG328β-actinRTAGAAGCATTTGCGGTGGELOVL2FNM_001197308TGCGAAAGTATCTATGGTGGA275ELOVL2RAGCAGCAAAGTAGTTCTTATGGTAELOVL5FNM_001199197TCCAGCGATGCGTCCTTA109ELOVL5RACACGGCCAAACAACACC
1.2 试剂
Trizol购自TaKaRa公司,RT-PCR试剂盒购自DBI公司,DEPC购自美国Sigma公司,RNasin购自美国Promega公司,反转录试剂盒购自DBI公司等。
1.3 试验方法
1.3.1 静原鸡不同组织总RNA的提取及cDNA合成
用RNA提取试剂盒提取总RNA,以1 μg RNA为模板,按照BestarTM qPCR RT Kit说明书配制反转录反应体系,其中预先配置好的反应液7.5 μL,5×RT Buffer 2 μL,RT Enzyme Mix 0.5 μL,总体系为10 μL,合成cDNA第一链。
1.3.2 实时荧光定量PCR反应
本研究采用Agilent Stratagene荧光定量PCR仪(Mx3000P)进行荧光定量PCR实验,扩增反应总体系为20 μL,其中Bestar®SybrGreen qPCRmasterMix 10.0 μL,PCR Forward Primer(10.0 μmol·L-1)0.5 μL,PCR Reverse Primer(10.0 μmol·L-1)0.5 μL,cDNA模板 2.0 μL,ddH2O 7.0 μL。扩增程序:95 ℃ 2 min;94 ℃ 20 s,58 ℃ 20 s,72 ℃ 34 s;40个循环,每个样重复3次。在收集荧光信号的过程中通过熔解曲线分析引物扩增的特异性。
1.4 数据处理
目的基因相对表达水平采用2-ΔΔCt方法计算,其中△Ct=Ct目的基因-Ct内参基因,△△Ct=△Ct组织-△Ct心脏(或待检组织中任一组织),表达量以Mean±SEM表示。数据经过Microsoft Excel 整理后利用SAS8.2进行统计分析,其中P<0.05表示差异显著。
2 结果与分析
2.1 总RNA纯度分析
提取的总RNA利用2%琼脂糖凝胶电泳进行检测,结果如图1所示,清晰可见RNA的3条带,分别为28S、18S、5S,无明显降解。总RNA的纯度通过分光光度计(UV-1206)检测,结果显示D260/D280为1.8~2.0,说明提取的RNA纯度较高,可以进行后续试验。
2.2 RT-PCR扩增产物特异性分析
对ELOVL2、ELOVL5、β-actin三种基因分别进行荧光定量PCR反应,得到的扩增曲线和扩增产物熔解曲线如图2所示,从a、c、e图可以看出其结果都呈现S型,有明显的背景期、指数增长期、线性增长期和平台期,并且每个曲线的起峰都在15~30 ct,曲线之间基本平行,说明扩增效率较高。从b、d、f图扩增产物的熔解曲线可以看出,都只有一个主峰,而且形状尖而窄,说明扩增的特异性较高,没有引物二聚体及其他非特异性的产物。由熔解曲线可以看出,ELOVL2、ELOVL5、β-actin三种基因的熔解温度分别为86.5、85.0、86.0 ℃,在正常值范围内(80~90 ℃)。
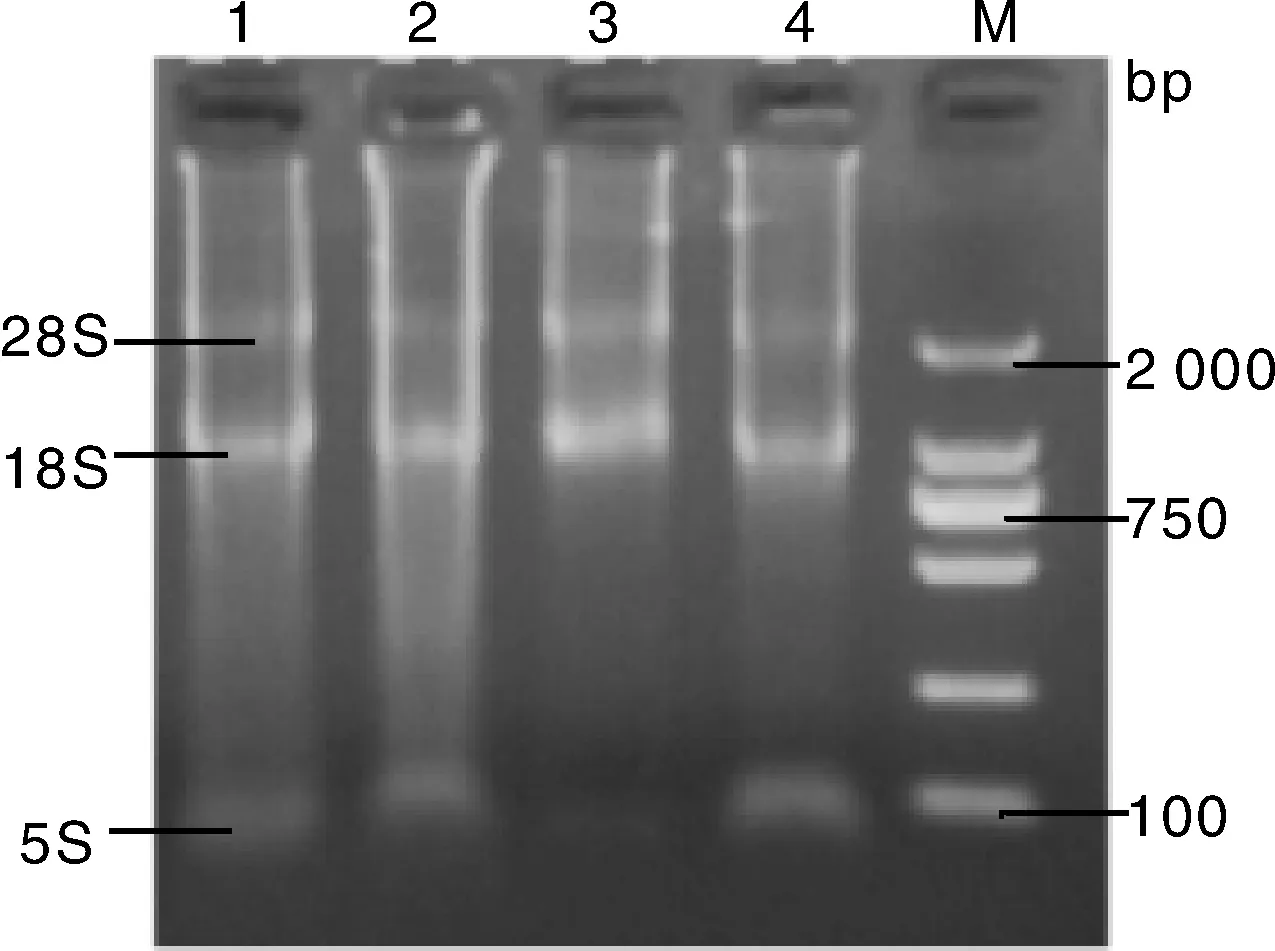
1~4, 提取的总RNA;M, DL2000 DNA Marker1-4, Extracted total RNA; M, DL2000 DNA Marker图1 总RNA琼脂糖凝胶电泳检测结果Fig.1 The results of agarose gel electrophoresis of total RNA
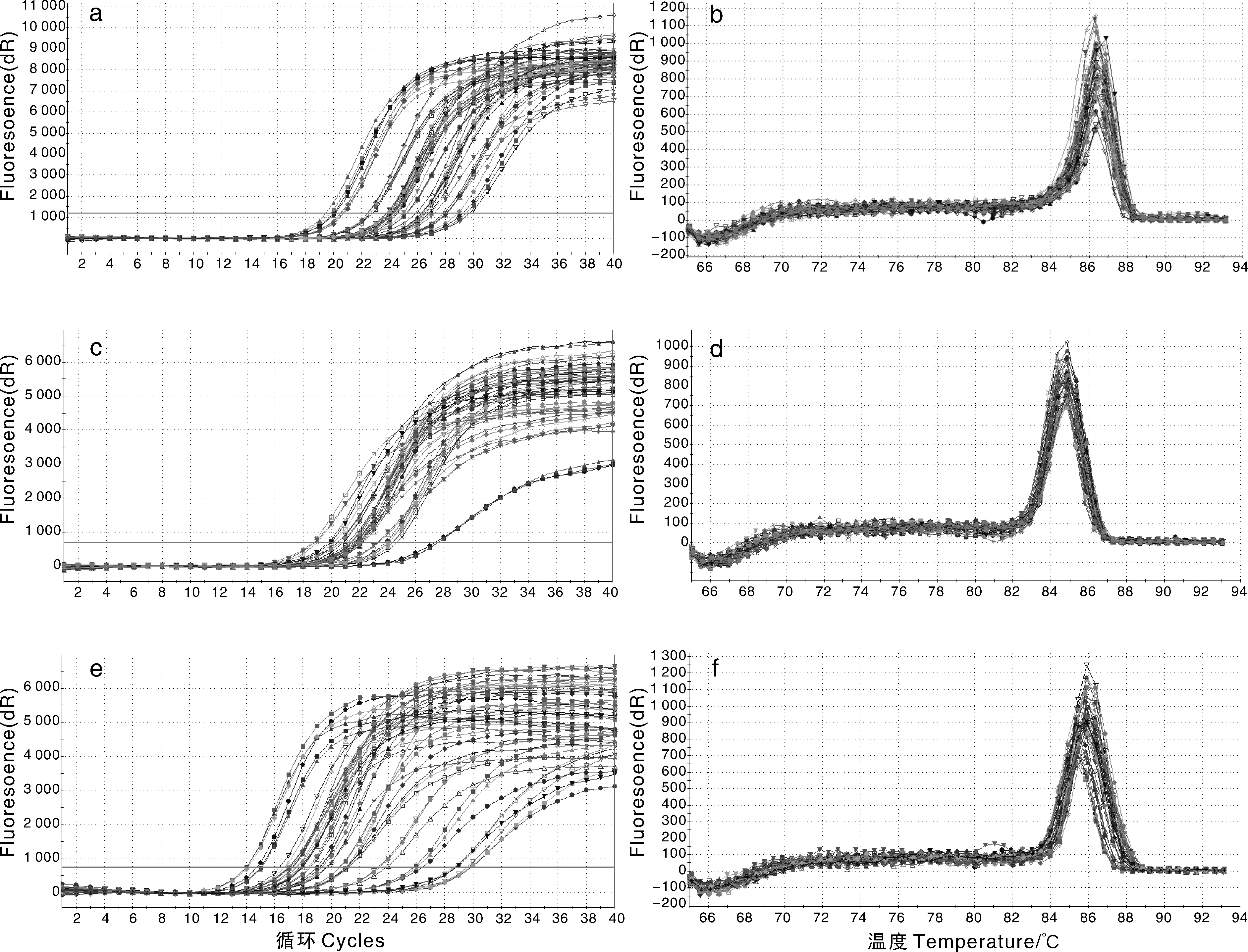
a, ELOVL2扩增曲线; b, ELOVL2扩增产物熔解曲线; c, ELOVL5扩增曲线; d, ELOVL5扩增产物熔解曲线; e, β-actin扩增曲线;f, β-actin扩增产物熔解曲线a, Amplification curve of ELOVL2; b, Dissociation curve of ELOVL2; c, Amplification curve of ELOVL5; d, Dissociation curve of ELOVL5; e, Amplification curve of β-actin; f, Dissociation curve of β-actin图2 ELOVL2、ELOVL5、β-actin的扩增曲线和扩增产物熔解曲线Fig.2 Amplification curve and melting curve of amplified products of ELOVL2, ELOVL5, β-actin
2.3 静原鸡ELOVL2基因的组织表达差异
本研究采集的静原鸡各组织均来自同一饲养场且饲养方式相同,通过实时荧光定量PCR反应,同时以β-actin作为内参基因。ELOVL2基因在不同组织中的表达量如图3所示,ELOVL2基因在静原鸡卵巢、肌肉、心脏、睾丸、腹脂、肝脏中均有表达,表达量由大到小依次为肝脏>卵巢>睾丸>腹脂>心脏>肌肉。ELOVL2基因在肝脏中的表达量与卵巢、鸡肉、心脏、睾丸和腹脂相比差异显著(P<0.05),在除肝脏组织外的其他五个组织中的表达量差异均不显著(P>0.05)。其中ELOVL2基因在肝脏中的表达量最高,为71.52±0.41,其次是卵巢与睾丸,分别为0.37±0.01和0.34±0.01,相对而言,ELOVL2在腹脂和心脏中的表达量较低,分别为0.04±0.01和0.03±0.00,而在肌肉中的表达量最低,仅为0.02±0.00。
2.4 静原鸡ELOVL5基因的组织表达差异
ELOVL5基因在不同组织中的表达量如图4所示,ELOVL5基因在静原鸡6个不同组织中均有表达,其中表达量最高的为肝组织,表达量为110.94±0.02,相比其他组织差异显著(P<0.05);其次为卵巢,表达量为0.98±0.02,显著高于心脏、睾丸、肌肉和腹脂。ELOVL5基因在腹脂中的表达量也显著高于心脏、睾丸和肌肉组织,为0.22±0.01。睾丸组织ELOVL5的表达量为0.11±0.01,显著高于肌肉和心脏(P<0.05)。表达量最低的是心脏(0.05±0.01)和肌肉组织(0.04±0.00),两者差异不显著(P>0.05)。
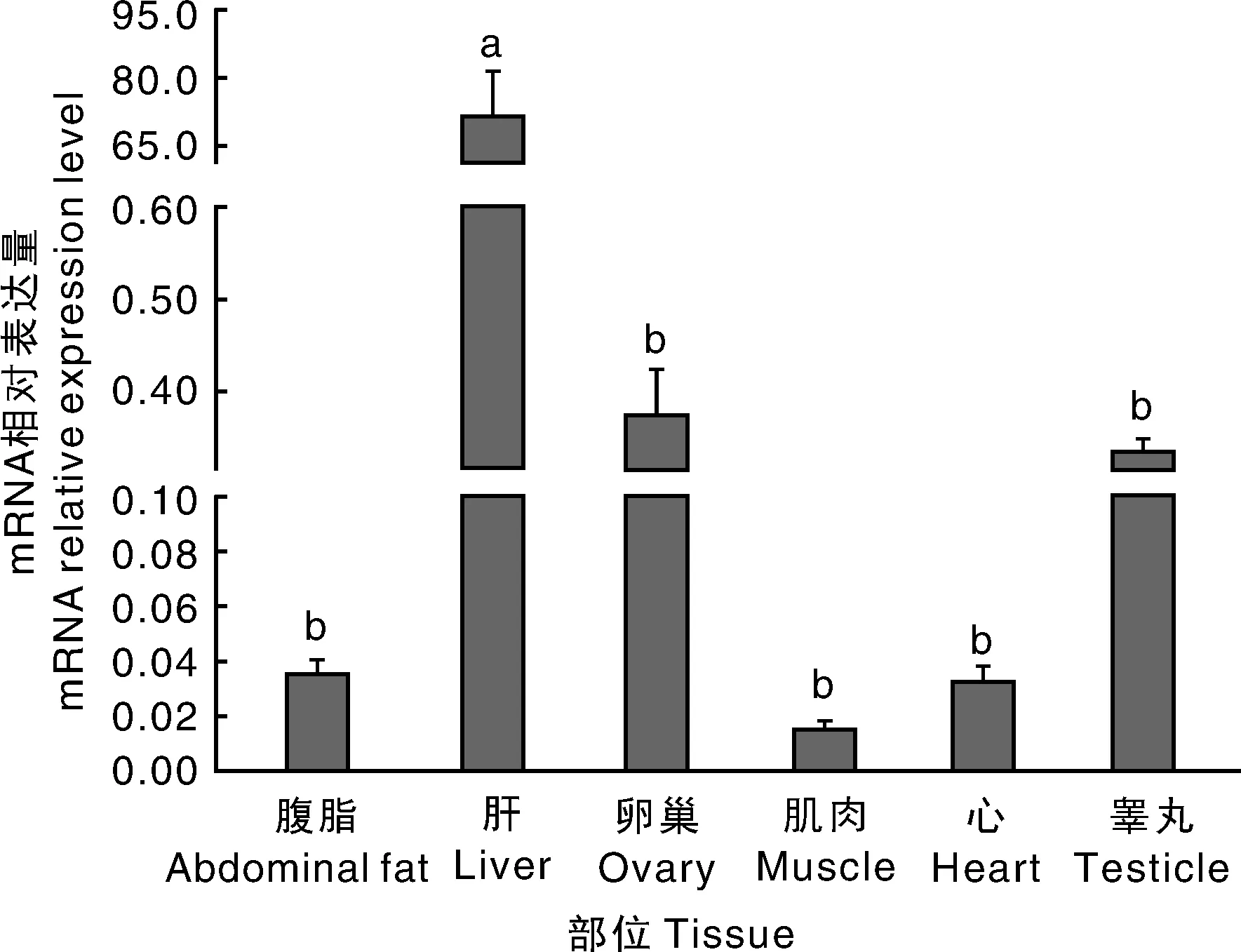
不同部位间没有相同字母表示差异显著(P<0.05)The bars with different letters show the significant difference(P<0.05)图3 静原鸡ELOVL2基因在不同组织中的相对表达量Fig.3 The relative expression of ELOVL2 gene in different tissues from Jingyuan chicken
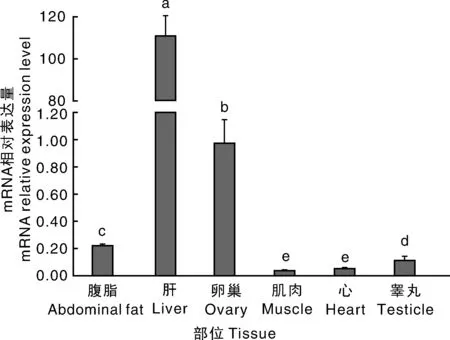
图4 静原鸡ELOVL5基因在不同组织中的相对表达量Fig.4 The relative expression of ELOVL5 gene in different tissues from Jingyuan chicken
2.5 静原鸡ELOVL2和ELOVL5基因分别在不同组织中的表达差异
从表2可以看出,静原鸡ELOVL5基因在腹脂中的表达量显著高于ELOVL2基因(P<0.05),这两个基因在其他组织中表达均差异不显著(P>0.05)。
表2 静原鸡ELOVL2和ELOVL5基因mRNA分别在不同组织中的表达差异
Table 2 Differential expression ofELOVL2 andELOVL5 gene in different tissues from Jingyuan chicken
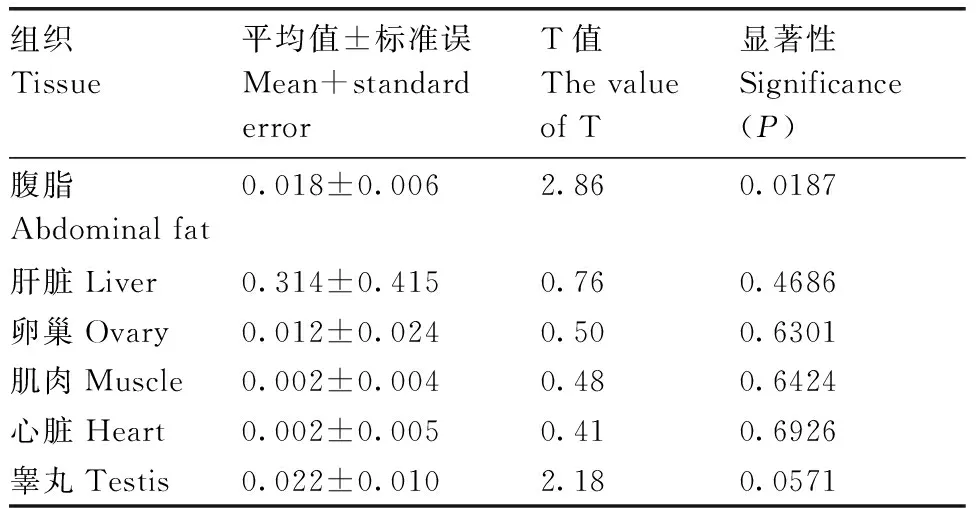
组织Tissue平均值±标准误Mean+standarderrorT值ThevalueofT显著性Significance(P)腹脂Abdominalfat0.018±0.0062.860.0187肝脏Liver0.314±0.4150.760.4686卵巢Ovary0.012±0.0240.500.6301肌肉Muscle0.002±0.0040.480.6424心脏Heart0.002±0.0050.410.6926睾丸Testis0.022±0.0102.180.0571
3 讨论
ELOVLs是极长链脂肪酸延伸酶家族基因,最早来源于酵母ELO家族(ELO1、ELO2、ELO3)[13-14]。人ELOVL5基因定位于6号染色体,编码的氨基酸个数为299[15-16]。ELOVL2基因也已定位到染色体上,但基因结构尚不清楚,有待深入研究[13]。有研究表明,ELOVLs基因家族在动物体内具有重要的表达调控作用[17]。杨志刚等[18]对中华绒螯蟹脂肪酸延长酶(ELOVL)基因表达分析中显示,各组织中均有ELOVL基因表达,表达量最高的组织为肝胰腺和肠道,在心脏中表达量最低。杨琴[11]研究发现,在二郎山山地鸡中肝和脑为ELOVL2、ELOVL5基因的优势表达组织,在腿肌、性腺和胸肌中ELOVL2只有较低水平的表达,而ELOVL5在皮脂、胸肌、腹脂和腿肌中表达最低。本研究对宁夏地方品种静原鸡ELOVL2和ELOVL5基因在腹脂、肝脏、肌肉、睾丸、心脏和卵巢6个组织中的相对表达量进行了检测,结果表明,这两个基因在6种组织中均有表达,其中ELOVL2和ELOVL5基因的mRNA在肝中的表达量均最高,与杨志刚等[18]、杨琴[11]、Wang等[19]的研究结果一致。ELOVL2基因在肝脏中的表达量为71.52±0.41,显著高于其他组织(P<0.05)。肝是动物体内较大的腺体,具有代谢、免疫、解毒等重要作用,而ELOVL2基因主要参与极长链多不饱和脂肪酸的合成,加之动物日粮中脂肪酸的饱和度以及浓度与肝脏的重量有着密切的关系,因此,这可能是肝脏中ELOVL2基因高表达的原因之一。而在另外5个组织中的表达量虽然有差别,但差异均不显著(P>0.05)。ELOVL2基因肌肉中的表达量最低,仅为0.02±0.00,这与杨琴[11]的研究结果不太一致,二郎山山地鸡ELOVL2基因在肌肉中的表达量显著高于腹脂,这可能和静原鸡的饲养环境、肌肉中所含的脂肪和油脂的量非常少有关。ELOVL5基因在肝中的表达量同样显著高于其他组织(P<0.05),可能因为主要组织相容性复合物的编码与ELOVL5基因有关,从而对动物的免疫调节起到至关重要的作用。ELOVL5基因在肌肉和心脏中表达量最低,与ELOVL2基因的表达情况基本相同。在卵巢中的表达量为0.98±0.02,居第二,显著高于腹脂和睾丸。对静原鸡ELOVL2和ELOVL5基因在不同组织中的表达差异分析表明,两个基因在腹脂中的表达有显著差异(P<0.05),并且ELOVL5基因在腹脂中的表达量高于ELOVL2基因。有研究表明,ELOVL5基因定位于6号染色体,并且许多遗传病均与6号染色体所编码的基因有关[13],因此,腹脂可能与某些遗传病的发生有关,具体机制还有待进一步研究。
通过对宁夏地方优良品种静原鸡ELOVL2和ELOVL5基因在腹脂、肌肉、肝脏、心脏、卵巢及睾丸中的相对表达量的研究,发现ELOVL2和ELOVL5基因在静原鸡肝脏组织中均呈现最高表达水平,推测它们在该组织中可能发挥重要生物学功能。本研究揭示了这两个基因在静原鸡不同组织中mRNA表达情况,为进一步研究该基因在禽类不同组织中的功能提供理论依据,对开展地方品种种质资源遗传评定及构建地方品种分子育种的技术平台奠定基础。
[1] 杨彦军.彭阳县朝那鸡产业发展中存在的问题及对策[J].养殖与饲料,2011(10):59-60. YANG Y J. Problems and countermeasures on the development of chicken industry in Pengyang county[J].AnimalsBreedingandFeed,2011(10):59-60. (in Chinese)
[2] 姜琳琳, 刘华贵, 齐德生, 等.鸡肉中脂肪酸的研究进展[J].肉类研究,2006 (1):37-40. JIANG L L, LIU H G,QI D S, et al. Research progress of fatty acids in chicken meat[J].MeatResearch, 2006 (1):37-40. (in Chinese with English abstract)
[3] SIMOPOULOS A P. The importance of the ratio of omega-6/omega-3 essential fatty acids[J].Biomedicine&Pharmacotherapy,2002,56(8):365-379.
[4] NAGANUMA T, SATO Y, SASSA T, et al. Biochemical characterization of the very long-chain fatty acid elongaseELOVL7 [J].FEBSLetters, 2011, 585(20):3337-3341.
[5] GUILLOU H, ZADRAVEE D, MARTIN P G P, et al. The key roles of elongases and desaturases in mammalian fatty acid metabolism: Insights fromTransgeniemiee[J].ProgressinLipidResearch,2010,49(2):186-199.
[6] MONROIG O, ROTLLANT J,CERDA-REVERTER J M, et al. Expression and role ofELOVL4 elongases in biosynthesis of very long-chain fatty acids during zebrafishDaniorerioearly embryonic development[J].BiochimicaEtBiophysicaActa,2010, 1801 (10) :1145.
[7] 李响,丁珍,吴义霞,等.ELOVL2基因多态性与乳母乳汁DHA水平的关联性分析[J].吉林大学学报(医学版),2015,41(6):1230-1233. LI X, DING Z,WU Y X, et al. Association betweenELOVL2 gene polymorphism and DHA levels in the milk of lactating mothers[J].JournalofJilinUniversity(MedicineEdition) ,2015,41(6):1230-1233. (in Chinese with English abstract)
[8] 孙晓艳.小鼠ELOVL2与Δ6 desaturase及线虫sfatl三基因共转促进EPA向DHA转化的研究[D].西安:陕西师范大学,2012. SUN X Y. Study on co-transformation of the three genes Nematode’s sfatl gene, mice’sELOVL2 gene and Δ6 desaturase gene promotes EPA to turn into DHA[D].Xi’an: Shanxi Normal University,2012. (in Chinese with English abstract)
[9] KOBAYASHI T, ZADRAVEC D, JACOBSSON A. ELOVL2 overexpression enhances triacylglycerol synthesis in 3T3-L1 and F442A cells[J].FEBSLetters,2007,581(17):3157-3163.
[10] ZADRAVEC D, TVRDIK P, GUILLOU H, et al. Elovl2 controls the level of n-6 28: 5 and 30: 5 fatty acids in testis, a prerequisite for male fertility and sperm maturation in mice[J].JournalofLipidReseareh,2011,52(2):245-255.
[11] 杨琴.不同饲养方式下二郎山山地鸡脂肪酸含量及ELOVL2、ELOVL5基因的组织表达研究[D].雅安:四川农业大学,2011. YANG Q. Study on fatty acid contents andELOVL2,ELOVL5 gene expression patterns with developmental stages of erlang mountainous chicken under different housing sisterms[D].Ya’an: Sichuan Agricultural University,2011. (in Chinese with English abstract)
[12] 谢帝芝,于若梦,陈芳, 等.饲料LNA/LA比对鲤幼鱼生长性能,肝脏脂肪酸组成及Δ6 fad,ELOVL5 mRNA表达的影响[J].水产 学报,2017,41(5):757-759. XIE D Z,YU R M,CHEN F, et al. Effects of feed LNA/LA ratio on growth performance, hepatic fatty acid composition and expression of the Δ6 fad andELOVL5 mRNA in juvenileCyprinuscarpio[J].JournalofFisheriesofChina, 2017, 41(5):757-759. (in Chinese with English abstract)
[13] 王海燕,苏玉虹. 编码极长链脂肪酸延长酶基因家族的结构及其产物的功能[J].生命的化学,2005,25(1):29-30. WANG H Y, SU Y H. The structure and function of the coding long chain fatty acid gene family[J].ChemistryofLife, 2005,25(1):29-30. (in Chinese with English abstract)
[14] JAKOBSSON A, WESTERBERG R, JACOBSSON A. Fatty acid elongases in mammals: Their regulation and roles in metabolism[J].JournalofLipidResearch, 2006,45(3): 237-249.
[15] LEONARD A E,BOBIKE G,DORADO J, et al. Cloning of a human cDNA eneoding a novel enzyme involved in the elongation of long-chain polyunsaturated fatty acids[J].BiochemiealJournal,2000,350(Pt3):765.
[16] ZHANG K, KNIAZEVA M, HAN M, et al. A 5-BP deletion inELOVL4 is assoeiated with two related forms of autosomal dominant maeular dystrophy[J].NatureGeneties,2001,27(1):89-93.
[17] MANDAL M N A, AMBASUDHAN R, WONG P W, et al. Charaeterization of mouse orthologue ofELOVL4: Genomic organization and spatial and temporal expression[J].Genomies,2004,83(4):626-635.
[18] 杨志刚,施秋燕,成永旭,等.中华绒螯蟹脂肪酸延长酶(ELOVL)基因全长 cDNA 的克隆及其表达分析[J].中国水产科学,2016,23(1): 53-63. YANG Z G,SHI Q Y,CHENG Y X, et al. Cloning and expression analysis of cDNA gene of Fatty acid elongation enzyme ofEriocheirsinensis(ELOVL)[J].JournalofFisherySciencesofChina,2016,23(1): 53-63. (in Chinese with English abstract)
[19] WANG Y, BOTOLIN D, CHRISTIAN B, et al. Tissue-specific, nutritional, and developmental regulation of developmental fatty acid elongases[J].JournalofLipidResearch,2005,46(4):706-715.
(责任编辑 张 韵)
Tissue-specific expression analysis ofELOVL2 andELOVL5 genes in Jingyuan chicken
MU Tong, ZHANG Juan*, ZHAO Ping, GU Yaling, LIU Liyuan, YANG Yanjun, AN Kelong, WANG You
(CollegeofAgriculture,NingxiaUniversity,Yinchuan750021,China)
By using real-time quantitative PCR (qRT-PCR) expression ofELOVL2 andELOVL5 in six different tissues (liver, muscle, heart, testis, ovary, abdominal fat) of Ningxia local varieties of Jingyuan chicken were determined, and the statistical analysis was carried out by SAS 8.2 software. The results showed that the expression ofELOVL2 andELOVL5 genes were observed in six different tissues from Jingyuan chicken. The relative expression ofELOVL2 gene in liver was the highest, 71.52±0.41, significantly higher than that in other tissues (P<0.05), followed by the ovaries, testicles, abdominal fat, heart and muscle. There was a difference between the latter five tissues, but the difference was not significant (P>0.05). The relative expression ofELOVL5 gene in different tissues of Jingyuan chicken was as followed: liver>abdominal fat>ovary>testicle>heart>muscle. The highest expression level in liver was 110.94±0.02, which was significantly higher than that in other tissues (P<0.05), and the expression in abdominal fat was significantly higher than that in ovary, testis, heart and muscle (P<0.05). In addition, there was no significant difference in the expression in heart and muscle (P>0.05). The expression ofELOVL2 andELOVL5 genes in different tissues was analyzed and compared. The results showed that the expression of two genes in abdominal fat was significantly different (P<0.05), and the expression ofELOVL5 gene in abdominal fat was higher. The research results showed that there were differences in the expression ofELOVL2 andELOVL5 genes in six tissues from Jingyuan chicken, and liver tissue was the most obvious, which lays the foundation for the development of local technology platform to build local varieties of molecular breeding and genetic evaluation of germplasm resources.
Jingyuan chicken;ELOVL2;ELOVL5; relative expression
10.3969/j.issn.1004-1524.2017.08.09
2017-01-12
宁夏自然科学基金资助项目(NZ15011)
母童(1995—),男,宁夏银川人,硕士研究生,主要从事动物遗传育种与繁殖方面的研究。E-mail: 1227415848@qq.com
*通信作者,张娟,E-mail: zhangjkathy@126.com
S831
A
1004-1524(2017)08-1290-07
母童,张娟,赵平,等. 静原鸡ELOVL2和ELOVL5基因表达的组织特异性研究[J].浙江农业学报,2017,29(8): 1290-1296.
