介孔碳纳米粒的构建及化疗-光疗联合抗多药耐药肿瘤研究Δ
2017-09-03李方舟俞燕娜沈园园上海交通大学药学院上海200240
李方舟,俞燕娜,朱 浩,沈园园(上海交通大学药学院,上海 200240)
介孔碳纳米粒的构建及化疗-光疗联合抗多药耐药肿瘤研究Δ
李方舟*,俞燕娜,朱 浩,沈园园#(上海交通大学药学院,上海 200240)
目的:构建负载化疗药物并具有光热和光动力联合治疗效果的介孔碳纳米粒(MCNs),研究其体外抗多药耐药肿瘤的作用。方法:利用低浓度水热法制备MCNs,通过混酸超声法将MCNs表面羧基化制成MCNs-COOH(MCNC),对其形貌、表面性质等进行表征。利用吸附法构建负载阿霉素(ADR)的ADR/MCNC,通过紫外吸光度计算其载药量,利用透析法考察其释放特性。选用耐ADR人乳腺癌MCF-7/ADR细胞通过共聚焦激光显微镜观察ADR/MCNC的细胞摄取和定位,MTT法考察ADR/MCNC的细胞毒性,用流式细胞术测定NIR光照下细胞内活性氧自由基(ROS)水平。结果:所制备的MCNC的粒径约为90 nm,表面含有羧基,BET比表面积为541.62 m2/g,孔容为0.34 cm3/g,孔径分布约为2.5 nm,具有显著光热效应。ADR/MCNC的载药量为47.4%,具有pH/NIR响应性释放特性;NIR光照下能促进ADR的细胞摄取和核内蓄积,能诱导MCF-7/ADR细胞产生ROS,并对细胞有显著的抑制作用。结论:成功制得MCNs,此外ADR/MCNC具有抗多药耐药肿瘤的作用。
介孔碳;纳米给药系统;光热疗法;光动力疗法;响应性;肿瘤多药耐药
肿瘤的多药耐药是癌症治疗的主要瓶颈,是导致传统化学治疗失败的主要原因之一。抗多药耐药肿瘤是改善癌症化学治疗效果亟待解决的关键性问题[1]。
纳米药物递释系统的出现为抗多药耐药肿瘤带来了福音[2]。其利用无机纳米粒的光热、光动力效果直接杀死肿瘤细胞或诱导肿瘤细胞产生抑制多药耐药相关基因的蛋白[3],成为一种抗多药耐药肿瘤的新型手段。
介孔碳材料是一种新型的无机纳米材料。本课题利用低浓度水热法制备了介孔碳纳米粒(MCNs),其具有比表面积大、孔容高、药物负载量大的特性,并且其载药和释药过程具有pH依赖性,此种特性很好地顺应了给药系统在肿瘤组织微酸性条件下释药的需求[4]。MCNs具有近红外(NIR)光热及光动力效应,能在NIR光照下升高温度促进介孔中所负载药物的释放[5],产生活性氧自由基(ROS)直接杀灭肿瘤细胞[6]。结合MCNs的优势,笔者设计并构建了一种负载抗癌药阿霉素(ADR)的ADR/MCNs,并对其体外抗多药耐药肿瘤作用进行了评价。
1 材料
1.1 仪器
JEM-2010透射电镜(TEM)、JSM-7401F扫描电镜(SEM)(日本Jeol公司);Zatasizer Nano S动态光散射仪(DLS,英国Malvern公司);IR/Nicilte 6700傅里叶变换红外光谱仪(FTIR,美国Nicilet公司);sP2010M+C比表面积孔隙度及化学吸附分析仪(美国Micromeritics Instrument公司);Varioskan Flash酶标仪(美国Thermo公司);BD LSRGortessa流式细胞仪(美国BD公司);TCS SP5共聚焦激光显微镜(德国Leica公司);LE-LS-808-2000TFCA 808 nm高温激光器、LENS-808CC-A5 808 nm光纤激光连接器(深圳欧立光电技术有限公司);U-2910紫外-可见光-NIR分光光度仪(日本Hitachi公司)。
1.2 药品与试剂
ADR原料药(北京华奉联博化学材料有限公司,批号:HF150728,纯度:99%);苯酚[阿拉丁试剂(上海)有限公司,批号:C1523045];甲醛溶液(国药集团化学试剂有限公司,批号:20160225);泊洛沙姆(F127,美国Sigma-Aldrich公司,批号:BCBH4538V);1640培养基(美国Gibco公司,批号:1786043);MTT、胰酶、胎牛血清(FBS)(上海索莱宝生物科技有限公司,批号:303H0510、20150623、140716);2′,7′-二氯荧光黄双乙酸盐(DCFHDA,南京碧云天生物技术有限公司,批号:S0033);其余试剂均为分析纯,水为超纯水。
1.3 细胞
耐ADR人乳腺癌MCF-7/ADR细胞由中国科学院上海药物研究所提供。
2 方法与结果
2.1 MCNs的制备
按文献[7]的低浓度水热法制备MCNs。取0.96 g F127超声溶于15 mL水中,备用;取0.6 g苯酚于70℃油浴中搅拌融化,缓慢加入15 mL 0.1 mol/L的NaOH溶液,逐滴加入2.1 mL的甲醛溶液(37%~40%),搅拌30 min;之后逐滴加入F127溶液,66℃油浴,(340±20)r/min搅拌2 h;加入50 mL水稀释,70℃油浴,反应16~18 h,得深红色胶体溶液;取胶体溶液17.7 mL,加入56 mL水稀释,130℃水热24 h,水洗数次,真空干燥,700℃焙烧3 h,最终得到MCNs。
2.2 MCNs表面羧基化改性
焙烧后的MCNs分散性极差,须通过混酸超声法将MCNs表面羧基化,以增强其在水中的分散性[8]。浓硫酸(98%)与浓硝酸(70%)按体积比3∶1配制得到强混酸;取2 mg MCNs与强混酸混合均匀,超声4 h进行羧基化,之后室温搅拌12 h;离心收集羧基化得到的MCNs-COOH(缩写为MCNC),水洗数次,直到上清液呈中性,之后以2 mL水重悬MCNC,超声搅拌后得均匀稳定的MCNC分散液。
2.3 MCNs和MCNC的表征
采用TEM和SEM分别观察MCNs和MCNC的形貌和介孔结构;MCNs和MCNC表面基团由FTIR进行表征;MCNs比表面积和孔径分布由比表面积孔隙度及化学吸附分析仪通过N2吸附-脱附原理进行测定;MCNC的粒径由DLS测定。结果显示,MCNs具有均一的粒径,约为90 nm,但极易团聚,分散性极差;MCNC在水中分散较好,粒径约为85 nm,并且孔道规则,介孔充分暴露,有利于药物的负载。MCNs和MCNC的形貌和结构图见图1。

图1 MCNs和MCNC的形貌和结构图Fig 1 Morphology and structure of MCNs and MCNC
FTIR图谱显示,MCNs的3 440 cm-1和1 382 cm-1分别对应—OH、酚—OH的伸缩振动和弯曲振动峰,1 625 cm-1对应酚环C=C的伸缩振动峰,1 100 cm-1对应C—O的伸缩振动峰;MCNC中未灼烧完全的酚类物质对应的特征峰强度稍有减弱,暴露出了羧酸所对应的1 698 cm-1的C=O特征峰,以及MCNC表面的亚甲基对应的2 915 cm-1和2 848 cm-1的伸缩振动峰。N2吸附-脱附等温线显示,MCNs的BET比表面积为541.62 m2/ g,总孔容为0.34 cm3/g,孔径分布约为2.5 nm。MCNs和MCNC的表征结果见图2。
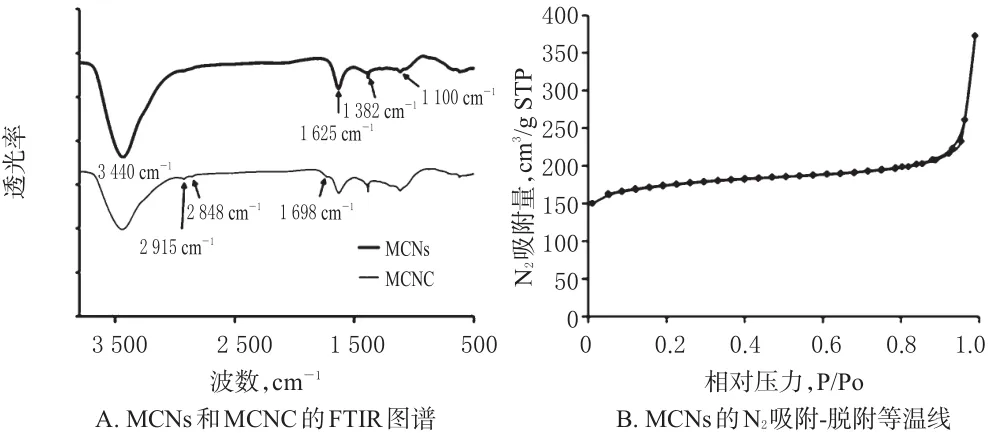
图2 MCNs和MCNC的表征结果Fig 2 Characterization of MCNs and MCNC
2.4 统计学方法
2.5 MCNC的载药性质考察
将ADR溶于pH 9.0的缓冲液中制备成200 μg/mL的溶液;取1 mg MCNC超声5 min分散于5 mL的上述ADR溶液中,室温下避光磁力搅拌24 h,离心收集ADR/ MCNC,并用相应的缓冲液洗涤至上清液无色;合并所有上清液并计算总体积,紫外分光光度计测定上清液的吸光度,计算载药量。分别检测MCNC和ADR/MCNC的粒径、多分散系数(PDI)。结果显示,MCNC、ADR/ MCNC的粒径分别为(88.98±4.48)、(177.1±8.53)nm,PDI分别为0.149±0.04、0.222±0.01(n=3);ADR/ MCNC的载药量为47.4%,包封率为90.2%,表明几乎所有投入的ADR都能被MCNC所负载,显示了MCNC优良的载药特性。
2.6 ADR/MCNC的释药性质考察
以pH 5.5的缓冲液模拟肿瘤细胞的酸性微环境,以pH 7.4的缓冲液模拟正常生理环境,利用透析法对ADR/MCNC的释药进行评价。取500 μg样品加入1 mL不同pH(5.5、7.4)的释放介质,均匀分散;将上述1 mL分散液分别加入至透析袋中,放入含4 mL相应释放介质的离心管中,于37℃水浴摇床中2 000 r/min振摇;分别于不同时间点取出1 mL释放液,并补加等温等体积的新鲜释放介质。分别考察ADR溶液和ADR/MCNC在无或有NIR光照(808 nm波长,10 W/cm2光密度,5 min)下ADR的累积释放度。体外释放结果见图3。
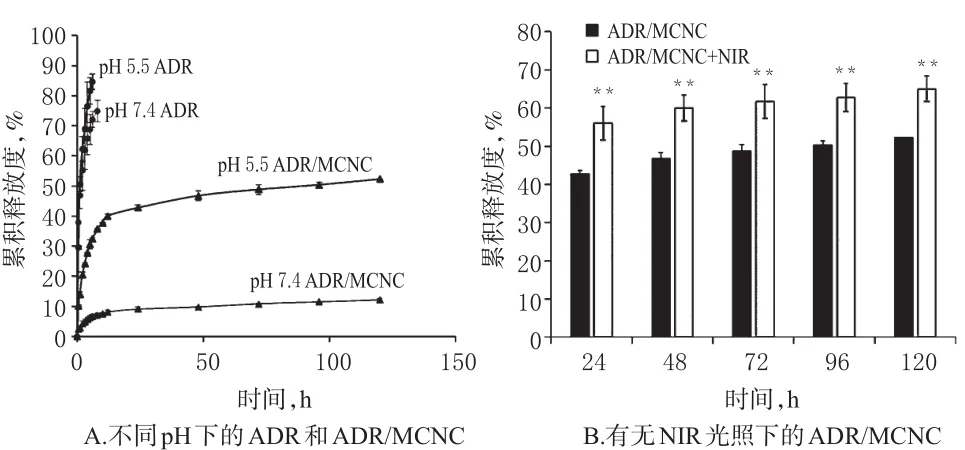
图3 体外释放结果(n=5)Fig 3 Results of release in vitro(n=5)
由图3A可知,游离ADR从透析袋内扩散到外界的速度非常快,表明该过程不是一个限速过程,ADR从纳米粒中释放并扩散至透析袋外的速度取决于ADR从纳米粒中释放出来的速度。此外,ADR/MCNC在pH 5.5时的累积释放度(52.3%)明显高于在pH 7.4时的累积释放度(12.1%)(P<0.01),这说明MCNC对ADR的释放具有pH响应性。由图3B可知,与无NIR光照比较,NIR光照下ADR/MCNC的累积释放度显著增加(P<0.01),达到65.0%,这说明MCNC对ADR的释放具有NIR响应性。
2.7 ADR/MCNC的细胞摄取、蓄积和分布
取对数生长期的MCF-7/ADR细胞以1×105个/孔的密度接种到共聚焦皿中,培养过夜,分别给予ADR和ADR/MCNC,孵育4 h后,对ADR/MCNC以808 nm、10 W/cm2光照5 min,继续培育4 h;吸弃含药培养基,加入6 μg/mL的细胞核染料(Hoechst 33342),孵育20 min;吸弃染料,磷酸盐缓冲液(PBS)洗涤3次,加入2 mL 4%的多聚甲醛固定细胞30 min。共聚焦显微镜拍照(ADR:激发波长480 nm,发射波长590 nm;Hoechst 33342:激发波长350 nm,发射波长440~480 nm)。MCF-7/ADR细胞的共聚焦激光显微图像见图4。
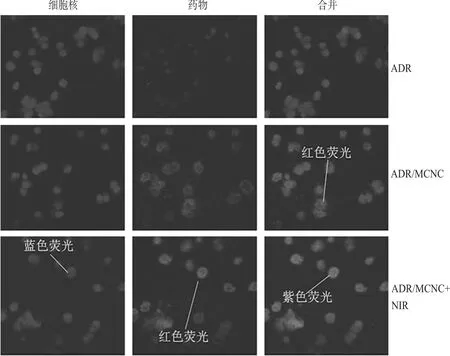
图4 MCF-7/ADR细胞的共聚焦激光显微图像Fig 4 Confocal laser microscopy images of MCF-7/ ADR cells
由图4所示(蓝色荧光表示细胞核,红色荧光表示ADR),ADR能被MCF-7/ADR细胞少量摄取,细胞内整体蓄积量很少;ADR/MCNC的细胞摄取显著提高,细胞内的ADR蓄积量增加,但ADR主要分布在细胞质,很少能进入细胞核(合并图中红色与蓝色不重叠);NIR光照后,细胞内ADR的蓄积量进一步提高,并且进入细胞核内的ADR也显著增多(合并图中红色与蓝色重叠显紫色)。
2.8 ADR/MCNC的体外细胞毒性试验
对数生长期的MCF-7/ADR细胞,按5 000个/孔接种于96孔板,培养过夜后,更换新鲜的含不同质量浓度药物的培养基(6.25~100 μg/mL MCNC和3.125~100 μg/mL ADR、ADR/MCNC),孵育48 h(NIR光照于第24小时给予808 nm、10 W/cm2的光照5 min)。吸弃培养基,用PBS洗涤孔板,每孔加入180 μL的培养基和20 μL的MTT溶液(5 mg/mL),继续孵育4 h后终止培养。吸弃培养基,每孔加入200 μL二甲基亚砜,轻摇10 min溶解蓝色晶体。用酶标仪于570 nm波长检测,计算细胞存活率和半数抑制浓度(IC50)。体外细胞毒性试验结果见图5。
由图5A可知,不论MCNC质量浓度高低,细胞的存活率均较高,说明MCNC对MCF-7/ADR细胞没有明显毒性。以ADR为对照,ADR的IC50约为56.93 μg/mL,ADR/MCNC的IC50约为40.46 μg/mL,NIR光照下ADR/ MCNC的IC50约为19.77 μg/mL,逆转耐药指数(RRI)为2.88(RRI=ADR的IC50/纳米粒的IC50)。这说明NIR光照联合化学疗法能有效地杀灭耐药肿瘤细胞。
2.9 细胞内ROS水平检测

图5 体外细胞毒性试验结果(n=6)Fig 5 Results of cytotoxicity in vitro evaluation(n=6)
利用二氯荧光黄(DCF)法对NIR光照下的MCNC和ADR/MCNC在细胞内产生的ROS水平进行评价,以ADR为对照。将MCF-7/ADR细胞以1×105个/孔接种于24孔板,培养过夜,分别更换含ADR、MCNC、ADR/ MCNC的培养基,孵育24 h后分别给予808 nm、10 W/cm2光照5 min;之后吸弃含药培养基,加入按1∶1 000比例以无血清培养基稀释后的DCFH-DA荧光探针,37℃孵育20 min;吸弃荧光探针培养基,用PBS洗涤细胞3次,胰酶消化,用预冷的PBS洗涤细胞,335×g离心5 min收集细胞。将细胞重悬在0.5 mL 4℃预冷的PBS溶液中,流式细胞仪测定细胞内ROS的平均荧光强度。MCF-7/ ADR细胞内ROS水平测定结果见图6。
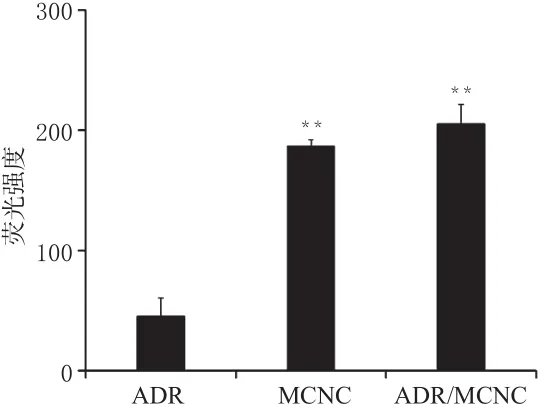
图6 MCF-7/ADR细胞内ROS水平测定结果(n=6)Fig 6 Results of ROS level in MCF-7/ADR cells(n=6)
由图6可知,与ADR比较,MCNC和ADR/MCNC光照后细胞内ROS水平显著提高(P<0.01),且两者ROS水平接近,这证实了MCNC能诱导肿瘤细胞产生ROS,且负载药物并不会影响MCNC光照下诱导细胞产生ROS的能力,这有力地解释细胞毒性试验中ADR/ MCNC光照下的细胞存活率显著降低的现象。
3 讨论
本研究采用低浓度水热法制备的MCNC具有均一的粒径、有序的介孔、高药物负载量。本课题组还考察了MCNC的NIR光照介导的光热性质。结果发现,MCNC的吸收波长范围较广,在NIR波段也有较强吸收,ADR可成功负载到MCNC上;MCNC和ADR/ MCNC的光热效应曲线显示二者具有MCNC浓度依赖性和时间依赖性,即随着MCNC浓度的升高和照射时间的延长,光热效应越明显。但时间依赖性有一定的限度:5 min后的升温进入平台期,温度不会再随着时间的延长而升高。由此笔者选择能使12.5 μg/mL的MCNC和ADR/MCNC达到40℃左右的808 nm、10 W/cm2光照5 min作为最终治疗方法。
本文设计构建了ADR/MCNC,其具有pH/NIR双重响应性释放特性。体外耐药细胞株细胞毒性实验结果证明,ADR/MCNC能通过NIR光热和光动力联合治疗有效杀灭耐药细胞,起到较为显著的抗多药耐药肿瘤的作用。体外ROS水平测定更加直观地表明,NIR光照不仅是通过光热作用促进ADR的释放和核内分布,更是通过诱导肿瘤细胞产生ROS的方式来杀灭肿瘤细胞,起到增强抗多药耐药肿瘤疗效的作用。
笔者所构建的ADR/MCNC的双重响应性释放、化疗-光热/光动力联合治疗的功效已经得到了证实,但具体在体内的应用效果仍有待在动物水平上进行药效学和药动学实验来验证。
[1] Gottesman MM.Mechanisms of cancer drug resistance [J].Annu Rev Med,2002,53(1):615-627.
[2] Patel NR,Pattni BS,Abouzeid AH,et al.Nanopreparations to overcome multidrug resistance in cancer[J].Adv Drug Deliver Rev,2013,65(13/14):1748-1762.
[3] Tian B,Wang C,Zhang S,et al.Photothermally enhanced photodynamic therapy delivered by nano-graphene oxide [J].Acs Nano,2011,5(9):7000-7009.
[4] Zhu J,Liao L,Bian X,et al.pH-controlled delivery of doxorubicin to cancer cells,based on small mesoporous carbon nanospheres[J].Small,2012,8(17):2715-2720.
[5] Xu GJ,Liu SJ,Niu H,et al.Functionalized mesoporous carbon nanoparticles for targeted chemo-photothermal therapy of cancer cells under near-infrared irradiation[J]. Rsc Adv,2014,4(64):33986-33997.
[6] Wang L,Sun Q,Wang X,et al.Using hollow carbon nanospheres as a light-induced free radical generator to overcome chemotherapy resistance[J].J Am Chem Soc,2015,137(5):1947-1955.
[7] Fang Y,Gu D,Zou Y,et al.A low-concentration hydrothermal synthesis of biocompatible ordered mesoporous carbon nanospheres with tunable and uniform size[J].Angew Chem Int Ed Engl,2010,49(43):7987-7991.
[8] 王欢,佘岚,王琳召,等.氧化介孔碳球纳米粒作为紫杉醇载体的研究[J].药学实践杂志,2015,33(2):114-118.
Establishment of Mesoporous Carbon Nano-drug Delivery System and Study on Its Chemotherapy-phototherapy Combination for Anti-multidrug-resistant Tumor
LI Fangzhou,YU Yanna,ZHU Hao,SHEN Yuanyuan(School of Pharmacy,Shanghai Jiao Tong University,Shanghai 200240,China)
OBJECTIVE:To establish the mesoporous carbon nano-drug delivery system(MCNs)with chemotherapy drugs loaded and holding photothermal and photodynamic combined effect,and study its anti-multidrug-resistant tumor effect in vitro. METHODS:MCNs was prepared by low-concentration hydrothermal route,and the MCNs surface was carboxylated by the mixed acid ultrasound method to made MCNs-COOH(MCNC).The morphology and surface properties were evaluated.Adriamycinc(ADR)was loaded into MCNC to fabricate ADR/MCNC via adsorption method.Drug loading capacity was calculated by UV,and drug release profile was investigated by dialysis method.ADR-resistant human breast cancer MCF-7/ADR cells were chosen,and cell uptake and positioning of ADR/MCNC were observed by confocal laser microscopy;cytotoxicity of ADR/MCNC was detected by MTT method;and intracellular reactive oxygen species(ROS)level under NIR irradiation was measured by flow cytometry.RESULTS:The particle size of prepared MCNs was about 90 nm,with carboxyl in surface.The specific surface area was 541.62 m2/ g,pore volume was 0.34 cm3/g,and pore size distribution was 2.5 nm,with significant photothermal effect.The drug loading capacity of ADR/MCNC was 47.4%,showing pH/NIR responsiveness release characteristics.It can promote ADR in cell uptake and nuclear accumulation and induce MCF-7/ADR cell to generate ROS under NIR irradiation,with significant inhibitory effect.CONCLUSIONS:MCNs is prepared successfully,and ADR/MCNC has an effect on anti-multidrug-resistant tumors.
Mesoporous carbon;Nano-drug delivery system;Photothermal therapy;Photodynamic therapy;Responsive;Tumor multidrug resistance
R943;R73
A
1001-0408(2017)22-3117-04
2017-02-27
2017-04-28)
(编辑:邹丽娟)
国家自然科学基金资助项目(No.81573352)
*硕士研究生。研究方向:纳米给药系统、药剂学。电话:021-34204793。E-mail:lfzh1991@126.com
#通信作者:高级工程师,副教授,硕士生导师。研究方向:药剂学。电话:021-34204793。E-mail:shenyuanyuan@sjtu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.22.25
