影响我院药物临床试验质量的关键环节分析与干预Δ
2017-09-03吴建龙佘定平黄晓晗深圳市第二人民医院药物临床试验机构办公室广东深圳518035
吴建龙,陈 斌,佘定平,黄晓晗(深圳市第二人民医院药物临床试验机构办公室,广东深圳 518035)
·药事管理·
影响我院药物临床试验质量的关键环节分析与干预Δ
吴建龙*,陈 斌,佘定平,黄晓晗(深圳市第二人民医院药物临床试验机构办公室,广东深圳 518035)
目的:发现影响我院药物临床试验质量关键环节,探讨提升药物临床试验质量的对策。方法:调取2014年我院药物临床试验机构10个专业14次药物临床试验研究质量检查结果,参照欧洲药品管理署检查发现问题的分级分类方法,对发生问题的关键环节进行分析,并评价对关键环节采取干预措施的效果。结果:2014年发现重要和一般问题总数共125例次,其中病例报告表填写、受试者知情同意、受试者入选和筛查、研究药物管理等4个环节发现质量问题数占全部问题数的79.20%,这些环节是影响药物临床试验质量的关键环节。通过采取加强研究者相关知识培训、完善制度和标准操作规程管理、加强环节质量控制、引入项目临床研究协调员、实行中心化药物管理等干预措施,2015年和2016年发现重要和一般问题总数分别为68、59例次,与2014年比较差异均有统计学意义(P<0.05);2015年和2016年发现重要问题数分别为7、4例次,与2014年发现4例次重要问题数比较差异均无统计学意义(P>0.05);2014-2016年均无严重问题发生。对于药物临床试验项目复杂程度较低的专业,通过采取干预措施后,2016年发现质量问题数明显下降,与2014年比较差异有统计学意义(P<0.05);对于药物临床试验项目复杂程度较高的专业,2016年发现质量问题数没有明显下降,与2014年比较差异无统计学意义(P>0.05)。结论:通过管控药物临床试验过程中关键环节,可明显减少药物临床试验中一般问题的发生,但对重要问题的发生影响不大。不同专业承担药物临床试验项目复杂程度有区别,发生问题的环节和程度也有所不同,应在质量控制检查中加以区分。
药物临床试验;质量控制;干预
提升药物临床试验质量一直是各医院临床试验机构的中心工作,但由于种种原因,试验质量整体水平仍然处于较低水平,且各机构间水平参差不齐也是困扰各临床试验机构的主要问题。除了相关研究人员对临床试验法规认识不够且遵循行为欠佳外,执行制度和标准操作规程(SOP)不严格也是相当重要的原因,临床试验用药品管理不规范甚至造成临床数据造假现象[1-3]。2015年7月22日,国家食品药品监督管理总局发布了《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告(2015年第117号)》,用4个最严要求来确保临床试验数据真实、可靠,从源头上保障药品安全、有效。而药物临床试验全过程质量控制是数据真实、可靠的坚实基础,因此做好质量控制管理是药物临床试验机构重要工作。不少机构开展了多种形式的研究来改进药物临床试验管理方法[4-7]。笔者基于对影响我院药物临床试验质量关键环节的分析,探讨提升药物临床试验质量的对策。
1 资料与方法
调取2014年我院药物临床试验机构10个专业14次药物临床试验研究质量检查结果,对受试者知情同意、受试者入选和筛查、病例报告表(CRF)填写、遵从试验方案、受试者补贴管理、相关试验检查管理、研究药物管理、不良事件报告及处理和监察计划管理等14个环节存在的问题进行汇总分析。参照欧洲药品管理署(EMEA)检查发现问题的分级分类方法[8],即严重问题、重要问题和一般问题,对发生问题的关键环节进行分析,并评价对关键环节采取干预措施的效果。
组间发生质量问题次数数据结果差异性采用t检验,组间问题频次数据采用卡方检验进行统计学分析。P<0.05表示差异有统计学意义。
2 影响药物临床试验质量的关键环节
按照药物临床试验项目检查中发现问题的频次进行排序。2014年药物临床试验各环节发现质量问题分布情况见图1。
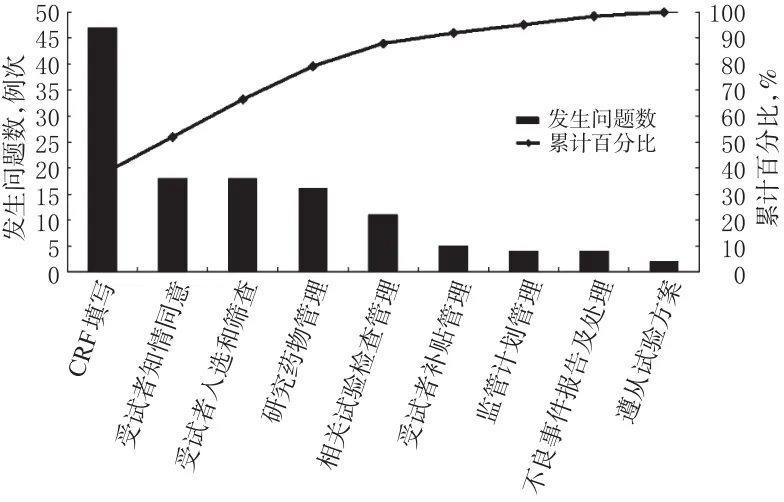
图1 2014年药物临床试验各环节发现质量问题分布情况Fig 1 Distribution of the problems occurring in each link of the drug clinical trials in 2014
如图1所示,CRF填写、受试者知情同意、受试者入选和筛查、研究药物管理等4个环节发现质量问题数占全部问题数的79.20%,表明这些环节是影响药物临床试验质量的关键环节。
3 干预措施
3.1 加强研究者相关知识培训
黄傲等[9]研究表明,研究者对《药物临床试验质量管理规范》(Good clinical practice,GCP)和相关法规要求知识掌握不充分,对研究方案及相关SOP依从性不高是影响临床试验研究质量的重要因素。经常加强对研究者相关知识的培训至关重要。我院通过多种方式来开展相关培训,对重要骨干组织外出培训,在每次启动会组织相关知识培训,并定期检查各专业研究者参加培训和考核情况。
3.2 完善制度和SOP管理
临床试验管理制度建设和SOP推行是保证临床质量的重要内容。我院机构和各专业分别依照相关法规新要求及时修订和更新管理制度和SOP内容,并组织研究者学习;在质控检查时针对新要求进行检查,发现研究者对制度和SOP依从性不高时及时整改。2014年后将相关管理制度和SOP等主要内容更新为新版本。
3.3 加强环节质量控制
临床试验的质量好坏取决于申办方或合同研究组织(CRO)和研究者对法规要求的遵循和对研究方案的依从,但由于目前申办方或CRO存在监查计划不详、力量薄弱、培训不足等诸多问题,导致申办方或CRO监督力量减弱,影响了试验质量[2,10]。另一方面,机构面临内部环节质量数量多、检查人员水平有待提高等问题。因此,加强对内部研究人员的临床试验各环节检查有助于提升试验质量。我院修订了临床试验质量控制的SOP,规定对每个试验项目进行3次环节质量检查,对CRF抽查数不少于5例,同时借鉴EMEA检查发现问题的分级分类方法对环节质控检查表问题性质和程度进行修订,着重从知情同意、临床试验实施、临床试验记录、监查情况和试验药物管理等环节重点检查。
3.4 引入项目临床研究协调员(CRC)
临床试验研究过程复杂、工作量大,需要机构和临床专业投入足够的人力资源,也需要研究者投入足够的精力和时间,但现实情况中多数临床专业难以实现。为解决这些问题,国外临床试验配备CRC已有30多年的历史并取得较好效果。因此,配备经过培训和有经验的专业化CRC将有助于提高试验质量[5]。我院2015年起与一些站点管理组织(Site management organization,SMO)公司引入项目CRC,协助研究者完成临床试验。
3.5 实行中心化药物管理
试验用药品的管理是药物临床试验质量管理中非常重要的一环,管理好坏直接影响到药物临床试验的质量和最终结果。我院先是实行药库和专业卫星药房模式来管理试验用药品,但由于专业药物管理人员由研究医师或护士担任,研究质量存在不少问题。2016年起我院建立符合要求的药物临床试验机构中心药房,实行中心化药物管理,配备2名药物管理员进行管理。
4 干预成效
4.1 干预前后药物临床试验发现质量问题数比较
实行干预措施后,2015年和2016年发现重要和一般问题总数分别为68、59例次,与实行干预措施前的2014年发现重要和一般问题总数125例次比较差异均有统计学意义(P分别为0.045 09和0.004 46,均小于0.05)。实行干预措施后,2015年和2016年发现重要问题数分别为7、4例次,与实行干预措施前的2014年发现4例次重要问题数比较差异均无统计学意义(P分别为0.089 37和0.563 70,均大于0.05)。2014-2016年均无严重问题发生。
4.2 干预前后不同专业药物临床试验发现质量问题数比较
跟踪呼吸、中西医结合、内分泌和重症医学等不同专业每年药物临床试验发现质量问题数,其分布情况见图2。
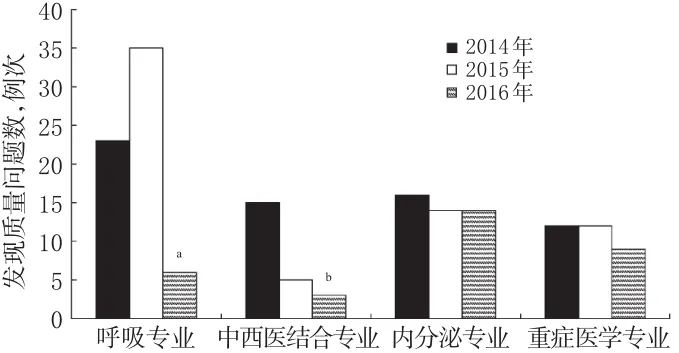
图2 2014-2016年4个不同专业药物临床试验发现质量问题数分布情况Fig 2 Distribution of the problems occurring in drug clinical trials in 4 different majors during 2014-2016
如图2所示,呼吸和中西医结合专业承担药物临床试验项目复杂程度相对较低,2014-2015年发现质量问题较多;采取干预措施后,2016年发现质量问题数明显下降,与2014年比较差异有统计学意义(P<0.05)。而内分泌和重症医学专业承担药物临床试验项目复杂程度相对较高,研究药物与合并药物较多,2016年发现质量问题数没有明显下降,与2014年比较差异无统计学意义(P>0.05)。这表明不同专业药物临床试验发现质量问题数有明显区别,干预效果也有所差异,主要与药物临床试验复杂性和研究药物类型及品种数多少有较大关系。
5 讨论
我院经过对2014年药物临床试验质量管理发现的问题进行分析,结果显示CRF填写、受试者知情同意、受试者入选和筛查、研究药物管理等环节是影响药物临床试验质量的关键环节。通过采取加强研究者相关知识培训、完善制度和SOP管理、加强环节质量控制、引入项目CRC、实行中心化药物管理等干预措施,2015年和2016年药物临床试验过程发生质量问题数有明显下降。通过比较干预前后不同专业开展药物临床试验发生质量问题类型和发生频次,发现采取的干预措施可明显减少药物临床试验中一般问题的发生,但对重要问题的发生影响不大。不同专业承接药物临床试验项目难易程度有区别,发生问题的环节和程度也有所不同,应在质量控制检查中加以区分。
药物临床试验数据质量直接影响到结论的真实可靠,获取完整有效的高质量试验数据受很多因素影响。本研究发现,CRF填写是影响药物临床试验质量的重要因素,这一发现与国内其他研究有相似之处。其中一项研究[9]从10项多中心、随机、双盲临床试验的疑问表调查发现,临床数据质量常见问题涉及很多环节,这些问题产生原因也很复杂,包括CRF设计不合理,研究者对试验方案及SOP依从性不高、GCP知识掌握不充分,研究者、CRC及监查员未尽责,以及申办方及合同研究组织向数据管理人员提供信息不充分。本研究还发现,研究药物管理也是容易发生质量问题的关键环节。黄一玲等[11]利用风险管理理念发现可预防的潜在风险中试验用药管理项目最多,有5项,需要加强相关培训和督查,严格执行SOP。本研究还发现一些其他环节,如受试者知情同意、受试者入选和筛查、试验药物管理等发生问题虽然不算突出,但仍可能导致严重或重要的临床试验质量问题出现,影响试验的科学性和伦理性,值得研究者和管理者高度重视。另一个值得关注的问题是,临床不同专业由于承担药物临床试验项目不同,试验方案复杂程度和项目质量控制要求有所区别,造成发现质量问题的性质和程度也有所不同,如内分泌专业和重症医学专业研究对象分别为慢性疾病和重症患者,观察指标多,合并用药也多,试验方案和过程较为复杂;呼吸专业主要研究某抗菌药的抗感染治疗,中西医结合专业主要承担中成药疗效观察研究,这两个专业试验方案复杂程度较低,观察指标和合并用药相对较少,通过干预后成效比较明显。彭朋等[1]研究虽调查了157项Ⅱ~Ⅳ期药物临床试验项目中存在的质量问题,但未对不同专业进行分类分析。
我院采取的干预措施主要针对发现质量问题的关键环节入手,干预措施实施后取得了一定成效,而其他研究[9,12]仅对措施进行描述,对干预成效未进行更深入的探讨。本研究由于调取的数据仅限于一个机构,研究范围局限于不同时期、不同专业的药物临床试验,因此难免存在缺陷和偏颇,有待后续更系统和包括更大区域的大数据分析来证实。
综上所述,药物临床试验质量管理要重视发现质量问题的关键环节,并采取针对性干预措施,可获得较好的改进效果。各研究机构应持续改进药物临床试验质量方可确保临床研究的科学性和伦理权益保护。今后我院还可从加强信息管理系统的应用、强化试验研究者系统培训和引入第三方检查等方面来提升药物临床试验质量管理水平。
[1] 彭朋,元唯安,胡薏慧,等.药物临床试验的质量问题分析[J].中国新药与临床杂志,2015,34(5):339-342.
[2] 李天萍,沈昊,王辉,等.基于GCP的药物临床试验质量管理探讨[J].中华医学科研管理杂志,2014,27(2):150-152.
[3] 陈达.临床试验用药品管理问题实例分析[J].中国药业,2014,23(4):66-67.
[4] 荆珊,方翼,范华莹,等.加强国际交流与合作完善临床试验体系建立[J].中华医学科研管理杂志,2014,27(3):360-362.
[5] 林阳,所伟,刘文芳,等.药物临床试验机构临床研究协调员管理及运行的经验[J].中国医药,2014,9(10):1564-1566.
[6] 张倩,孙瑞华,李琳,等.基于质量机能展开(QFD)方法的临床试验机构管理系统需求分析研究[J].中华医学科研管理杂志,2014,27(3):329-332.
[7] 肖律,林小小,黄乐松,等.浅谈医院药物临床试验质量控制体系的建设[J].中国药事,2014,28(8):892-895.
[8] European Medicines Agency.Classification and analysis of the GCP inspection findings of GCP inspections conducted at the request of the CHMP[EB/OL].(2014-12-01)[2017-02-15].http://www.ema.europa.eu/docs/en_GB/ document_library/Other/2014/12/WC500178525.pdf.
[9] 黄傲,孙瑞华,王雨萌,等.临床试验数据质量问题与改进措施[J].中日友好医院学报,2015,29(4):224-227.
[10] 高敏洁.美国FDA对新药临床试验申办者和合同研究组织的监管模式[J].中国新药与临床杂志,2016,35(2):109-113.
[11] 黄一玲,许莉,康健,等.药物临床试验机构风险管理模式探讨[J].中国新药杂志,2016,25(3):305-309.
[12] 王彦荣,李薇,戴欣雅,等.我院药物临床试验培训存在的问题与对策[J].中国药房,2015,26(1):18-20.
Analysis and Intervention on the Key Links of the Quality of Drug Clinical Trials in Our Hospital
WU Jianlong,CHEN Bin,SHE Dingping,HUANG Xiaohan(Office of Clinical Trials Institute,Shenzhen Second People’s Hospital,Guangdong Shenzhen 518035,China)
OBJECTIVE:To discuss the countermeasure on the quality improvement of the drug clinical trials in our hospital based on the discovery of key links of the quality of clinical trials.METHODS:Quality results of 14 drug clinical trials in 10 majors from the drug clinical trial institute in our hospital in 2014 were investigated.Referring to the grading and classifying methods of the inspection problems in European Medicines Agency,the key links of occurring problems were analyzed,and the effects of interventions for key links were evaluated.RESULTS:In 2014,totally 125 important and general problems were found,in which,the numbers of problems occurred in case report form filling,informed consent of subjects,enrolling and screening of subjects,investigational products management accounted for 79.20%.The above 4 links were the key links affecting quality of drug clinical trials.According to strengthening the training about relevant knowledge of the researchers,improving system and standard operation procedures management,enhancing link quality control,introducing project clinical research coordinator,developing centralized drug management and other interventions,the total numbers of found important and general problems in 2015 and 2016 were 68 and 59,respectively.Compared with 2014,the differences were statistically significant(P<0.05).The numbers of found important problems in 2015 and 2016 were 7 and 4,respectively.Compared with 2014(4 important problems),the differences were not statistically significant(P>0.05).There were no severe problems during 2014-2016.After interventions,numbers of occurring problems in majors with less complex drug clinical trial had obviously declined in 2016.Compared with 2014,the differences were statistically significant(P<0.05).While the major with relatively high complexity of drug clinical trial had no obvious decline in 2016.Compared with 2014,the differences were not statistically significant(P>0.05).CONCLUSIONS:Controlling the key links in drug clinical trial process can obviously reduce the occurrence of general problems while has little effect on the occurrence of important problems.It is different for different majors in undertaking drug clinical trial projects,so as the links and degree of occurring problems.It should be distinguished in quality control checking.
Drug clinical trial;Quality control;Intervention
R969.4
A
1001-0408(2017)22-3033-04
2017-02-15
2017-05-09)(编辑:余庆华)
深圳市战略性新兴产业发展专项资金2013年第五批扶持计划(No.生物产业类第17号)
*主任药师,博士。研究方向:临床药理、医院药学。电话:0755-83366388
DOI10.6039/j.issn.1001-0408.2017.22.03
