小窝蛋白1脚手架区多肽减轻LPS诱导的小鼠急性肺损伤*
2017-09-03张晓彤田文芳陈俊良苑佳佳陈新杰庞庆丰
翁 平, 张晓彤, 陈 炜, 田文芳, 陈俊良, 苑佳佳, 陈新杰, 庞庆丰△
(1江南大学无锡医学院, 江苏 无锡 214122; 2无锡市第三人民医院急救中心, 江苏 无锡 214041)
小窝蛋白1脚手架区多肽减轻LPS诱导的小鼠急性肺损伤*
翁 平1, 张晓彤1, 陈 炜2, 田文芳1, 陈俊良1, 苑佳佳1, 陈新杰1, 庞庆丰1△
(1江南大学无锡医学院, 江苏 无锡 214122;2无锡市第三人民医院急救中心, 江苏 无锡 214041)
目的: 探究人工合成的小窝蛋白1 (caveolin-1,Cav-1)脚手架区多肽cavtratin对血红素加氧酶1(heme oxygenase-1,HO-1)活性及脂多糖(lipopolysaccharide,LPS)诱导的小鼠急性肺损伤的作用。方法: 成年雄性BALB/c小鼠随机分为6组,每组8~10只,实验分为对照(control)组、触足肽内化序列(Antennapedia internalization sequence,AP)组、LPS组、LPS+血晶素(hemin)组、LPS+hemin+cavtratin组和LPS+hemin+cavtratin+锌原卟啉(zinc protoporphyrin IX,ZnPP)组。小鼠气管滴注LPS 24 h后,苏木素-伊红染色观察肺组织病理形态变化;检测肺组织湿/干重比、肺泡灌洗液中细胞数和血清中乳酸脱氢酶活性。免疫荧光观察HO-1和Cav-1的结合情况并检测HO-1活性;实时荧光定量PCR检测炎症因子(IL-1β、IL-6、TNF-α、MCP-1和iNOS)的mRNA水平。结果: 组织免疫荧光以及HO-1活性检测发现,与LPS组比较,LPS+hemin+cavtratin组HO-1与细胞膜Cav-1的结合减少,HO-1的活性增高(P<0.05); 与LPS组比较,LPS+hemin+cavtratin组肺组织受损程度明显减轻,肺湿/干重比、肺泡灌洗液细胞数和血清中乳酸脱氢酶活性显著降低(P<0.05); 与LPS组比较,LPS+hemin+cavtratin组炎症因子的mRNA表达降低(P<0.05); HO-1活性抑制剂ZnPP可以消除cavtratin的保护作用。结论: Cavtratin可以通过减少HO-1与细胞膜Cav-1的结合使得HO-1活性增加,进而减轻LPS诱导的小鼠急性肺损伤。
小窝蛋白1; 血红素加氧酶1; 急性肺损伤; 脂多糖
急性肺损伤(acute lung injury,ALI)发病机制错综复杂而且目前临床上尚无有效的治疗药物。小窝蛋白1(caveolin-1,Cav-1)是细胞膜小窝的重要组成蛋白,其第82~101位氨基酸被称为小窝蛋白1脚手架区(caveolin-1 scaffolding domain,CSD),在细胞信号转导、跨膜物质转运等生物学功能中发挥重要作用[1-2]。最近研究发现,CSD能够与多种蛋白质结合,抑制这些蛋白质的生物活性[3-4]。血红素加氧酶1(heme oxygenase-1,HO-1)就是能够被CSD结合且生物活性被抑制的典型蛋白质[5-6]。HO-1是血红素分解代谢的限速酶,催化血红素分解产生的Fe2+、一氧化碳和胆绿素。HO-1、一氧化碳和胆绿素具有较强的抗炎、抗氧化及抗凋亡作用,对多种炎症相关疾病具有抑制作用[7]。
本课题前期的研究发现,预先诱导肺泡巨噬细胞HO-1表达可以增加脂多糖(lipopolysaccharide,LPS)刺激的肺泡巨噬细胞精氨酸酶活性和吞噬能力[8];但CSD对HO-1活性内源性抑制的难题限制其对LPS诱导的ALI的保护效果。本研究拟采用CSD多肽cavtratin干扰HO-1与细胞膜Cav-1的结合, 增加HO-1活性,在此基础上观察cavtratin对LPS诱导的小鼠ALI的保护作用。
材 料 和 方 法
1 动物
清洁级雄性BALB/c小鼠(体重19~23 g, 8~10周龄),由上海斯莱克实验动物中心提供,许可证号为SCXK(沪)2012-0002。所有动物至少适应相应的饲养环境1周。所有的动物实验均按照有关法律法规的指导方针进行,并获得江南大学实验动物伦理委员会批准。
2 主要试剂
实验用cavtratin为全长CSD(Cav-1第82~101位氨基酸序列为DGIWKASFTTFTVTKYWFYR)结构,其C末端连有黑腹果蝇触足肽内化序列(Antennapedia internalization sequence,AP;RQIKIWFQNRRMKWKK;使其能进入细胞中),由强耀生物技术有限公司合成。LPS(血清型O111:B4)、血晶素(hemin)、锌原卟啉(zinc protoporphyrin IX,ZnPP)以及HO-1活性检测所用试剂均购自Sigma;Cav-1兔单克隆抗体以及HO-1鼠多克隆抗体购自Abcam;辣根过氧化物酶标记山羊抗兔及山羊抗兔IgG抗体购自博士德生物有限公司;FITC标记山羊抗鼠IgG以及TR标记山羊抗兔IgG抗体购自Santa Cruz;本实验所用引物由上海生工有限公司根据合成,具体引物序列见表1;SYBR Green荧光定量PCR试剂盒购自TaKaRa。

表1 实时荧光定量PCR引物序列
3 主要方法
3.1 动物模型及给药处理 小鼠随机分为6组,每组8~10只。正常对照(control)组,小鼠腹腔注射300 μL生理盐水;AP组,腹腔注射4 mg/kg AP;LPS组,小鼠气管滴注5 mg/kg LPS溶液;LPS+hemin组,小鼠腹腔注射50 μmol/kg hemin溶液,24 h后气管滴注5 mg/kg LPS溶液;LPS+hemin+cavtratin组,小鼠腹腔注射50 μmol/kg hemin和4 mg/kg cavtratin[9],24 h后气管滴注5 mg/kg LPS溶液;LPS+hemin+cavtratin+ZnPP组,小鼠腹腔注射50 μmol/kg hemin和4 mg/kg cavtratin多肽,24 h后气管滴注5 mg/kg LPS,气管滴注前2 h腹腔注射50 μmol/kg ZnPP。
气管滴注LPS 24 h后,麻醉动物,眼球取血分离血清,收集右肺组织做生化检测和湿/干重比的检测,左肺组织用4%的多聚甲醛固定后做组织学分析;另外,每组3只小鼠进行肺泡灌洗液分析。
3.2 肺组织病理学观察 肺组织4 %多聚甲醛固定48 h后,经过系列的脱水包埋等过程后将组织切为4 μm的切片,并且经过苏木素和伊红染色后显微镜下观察拍照。
3.3 肺湿/干重比检测 分离小鼠肺组织后,肺组织称湿重(wet weight)后置于60 ℃温箱,72 h后至恒重后再记录肺组织干重(dry weight),计算湿/干重比(W/D)。
3.4 肺泡灌洗液细胞计数及血清乳酸脱氢酶(lactate dehydrogenase,LDH)含量的测定 对小鼠进行肺泡灌洗,吸取20 μL肺泡灌洗液在血球计数板上计细胞总数;收集小鼠血清,乳酸脱氢酶试剂盒检测小鼠血清LDH的含量。
3.5 实时荧光定量PCR 称取20 mg小鼠的肺组织,采用天根组织RNA提取试剂盒分离纯化各组组织中的总RNA,分光光度法测定计算RNA纯度及浓度。参照TaKaRa逆转录说明进行逆转录。上样采用TaKaRa SYBR Green荧光定量PCR试剂盒,反应体积为20 μL,其中2× SYBR Premix Ex Taq Mix 10 μL,上、下游引物(10 μmol/L)各0.4 μL,DNA模板2 μL,ddH2O 7.2 μL。按照荧光定量反应试剂盒说明书于LightCycler 480 PCR仪(Roche)内实施PCR循环。采用GAPDH作为内参照,结果分析采用2-ΔΔCt法,将control组作为1比较各组表达的变化倍数。

3.7 组织切片免疫荧光染色 将HO-1和Cav-1分别用特异性荧光素标记使得绿色荧光标记HO-1蛋白,红色荧光标记Cav-1蛋白,若两者有结合那重叠后即显示黄色荧光。主要步骤如下:石蜡切片通过梯度脱水后,抗原修复用pH为6.0的 0.1 mol/L柠檬酸溶液95 ℃水浴20 min,PBS 洗涤3次,每次5 min;5 %牛血清白蛋白室温封闭30 min;擦去封闭液,孵育Cav-1和HO-1的抗体混合稀释液,4 ℃过夜孵育;PBS洗涤后,孵育荧光 II 抗,室温避光孵育1 h;洗涤后,封片液封片;荧光显微镜下观察拍照。
4 统计学处理
应用SPSS 16.0 软件进行统计学分析。数据以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,均数间两两比较选用SNK-q法。以P<0.05为差异有统计学意义。
结 果
1 Cavtratin对肺形态学及生化指标的影响
如图1所示,control组及AP组小鼠肺泡结构完整,肺泡腔无炎性细胞浸润;而LPS组小鼠肺部可以观察到炎性细胞浸润,肺泡壁增厚,大量红细胞渗出,肺泡断裂,肺泡腔萎缩不张;LPS+hemin+cavtratin组肺组织损伤明显减轻,LPS+hemin+cavtratin+ZnPP组出现严重的肺结构破坏情况。LPS组与control组相比,W/D、灌洗液细胞数和血清LDH活性升高(P<0.05);与LPS组相比,LPS+hemin+cavtratin组W/D和灌洗液细胞数降低(P<0.05);与LPS+hemin+cavtratin组相比,LPS+hemin+cavtratin+ ZnPP组上述检测指标显著增高(P<0.05)。
2 Cavtratin预处理对HO-1与Cav-1结合的影响
与control组比较,LPS和LPS+hemin组HO-1和肺组织Cav-1之间的结合增多;而与LPS+hemin组比较,LPS+hemin+cavtratin组HO-1和肺组织Cav-1之间的结合减少,见图2。
3 Cavtratin预处理对HO-1活性的影响
如图3所示,与LPS组和LPS+hemin组比较,LPS+hemin+cavtratin组HO-1的活性明显增加(P<0.05);而LPS+hemin+cavtratin+ZnPP组HO-1活性则降低(P<0.05)。该结果提示:cavtratin可以有效干扰HO-1与Cav-1之间的结合,从而增加HO-1活性。
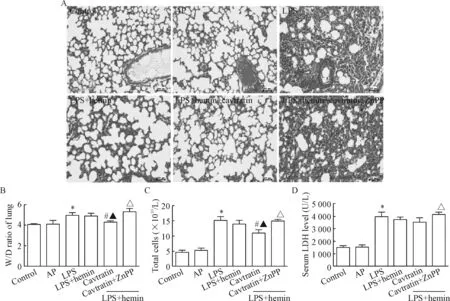
Figure 1.The pathomorphology and biochemical indexes in the lung tissues, bronchoalveolar lavage fluid (BALF) and the serum. A: hematoxylin and eosin-stained lung sections (scale bar=50 μm). B: the effect of cavtratin on LPS-induced pulmonary edema. Mean±SD.n= 5~7. C: the total cell numbers in BALF. Mean±SD.n=3. D: the levels of LDH activity in the serum. Mean±SD.n=8~10.*P<0.05vscontrol group;#P<0.05vsLPS group;▲P<0.05vsLPS+hemin group;△P<0.05vsLPS+hemin+cavtratin group.
图1 肺组织病理学以及肺损伤生化指标变化情况
4 Cavtratin对肺组织促炎因子表达的影响
如图4所示,与control组比较,LPS组肺组织中IL-1β、IL-6、TNF-α、MCP-1和iNOS等炎症因子的mRNA表达水平明显增高(P<0.05);而与LPS组相比,LPS+hemin+cavtratin组上述炎症因子的表达明显降低(P<0.05);与LPS+hemin+cavtratin组相比,LPS+hemin+cavtratin+ZnPP组肺组织中IL-1β、IL-6、TNF-α、MCP-1和iNOS等炎症因子的mRNA表达明显增高(P<0.05)。
讨 论
HO-1活性被CSD内源性抑制的问题制约了其对ALI的保护效果。本研究观察小窝蛋白-1脚手架区多肽cavtratin对HO-1的活性的影响及对LPS诱导的小鼠ALI的保护作用,获得如下主要实验结果:cavtratin能够减少HO-1与肺组织中Cav-1结合量,增加HO-1活性进而降低炎症因子的表达和肺W/D,减少肺泡灌洗液细胞数量,改善病理形态,有效保护脂多糖诱导的小鼠ALI。
Cav-1广泛存在于I型及II型肺泡上皮细胞、Clara 细胞和肺泡巨噬细胞中,其氨基酸序列的N端和C端都位于细胞质中,肽链中间是由疏水性氨基酸(102~134)形成的发夹样结构,为Cav-1跨膜区;N端第82~101位氨基酸残基被称之为CSD,其氨基酸序列为DGIWKASFTTFTVTKYWFYR。CSD可通过氢键、π-π键等非共价键形式、可逆性结合多种类型的蛋白质,如酪氨酸激酶类膜受体及其下游靶分子、非受体类酪氨酸激酶、丝/苏氨酸激酶类膜受体、G蛋白偶联受体及下游信号分子、类固醇激素受体及内皮细胞一氧化氮合酶等。CSD结合这些靶蛋白并抑制其功能。
为解决Cav-1对结合的靶蛋白活性内源性抑制的科学问题,Xia等[11]利用丙氨酸替代的F92A-CSD多肽能与竞争性结合内皮型一氧化氮合酶,有效提高内皮型一氧化氮合酶活性。静脉注射F92A Cav-1 CSD可使小鼠体内内皮型一氧化氮合酶与野生型Cav-1结合数量减少,一氧化氮合酶活性增高,一氧化氮含量增高,血压下降[12]。本研究发现首次发现未突变的野生型CSD多肽可以有效地干扰Cav-1与HO-1之间的结合,进而解除Cav-1对HO-1的活性抑制作用。主要依据是cavtratin可增加HO-1活性,抑制肺组织中多种促炎因子的表达,降低炎症因子IL-1β、IL-6、 TNF-α、MCP-1及iNOS的表达,减轻LPS诱导的小鼠ALI。

Figure 2.Cavtratin decreased the interaction between HO-1 and Cav-1. The paraffin sections of the lung tissues were immunostained with anti-HO-1 (green) and anti-caveolin-1 (red) and observed under fluorescence microscopy. The merged images were also shown (right). The scale bar=20 μm.
图2 Cavtratin对HO-1与Cav-1之间结合的影响
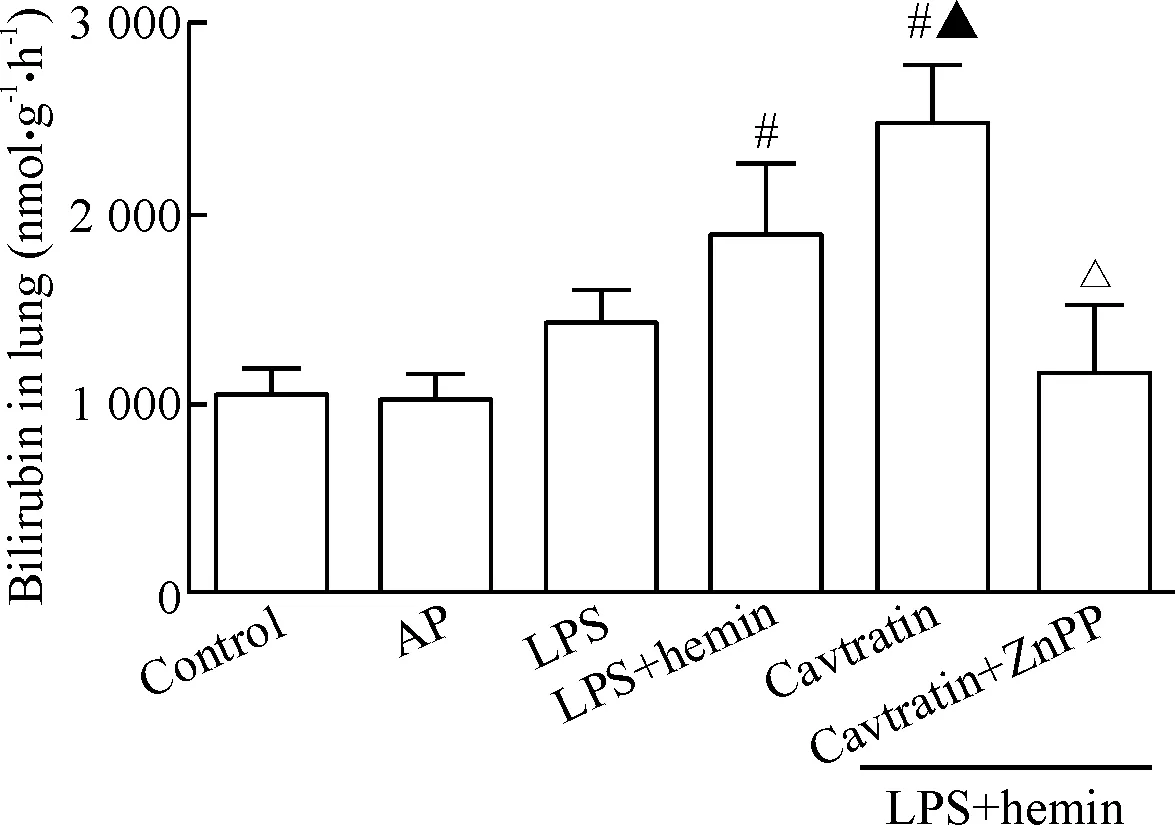
Figure 3.Cavtratin increased the HO-1 activity in the mouse lung tissues. HO-1 activity were determined in the protein extracts from the lung tissues. Mean±SD.n=5.#P<0.05vsLPS group;▲P<0.05vsLPS+hemin group;△P<0.05vsLPS+hemin+cavtratin group.
图3 Cavtratin增加小鼠肺组织HO-1活性
促炎因子大量表达是各种感染性疾病导致的ALI的关键发病机制[13]。有效抑制炎症反应可以明显降低肺损伤的程度。研究表明HO-1及其代谢产物尤其是胆绿素具有较强的抗炎作用[14]。本研究发现cavtratin可以抑制肺组织中多种促炎因子的表达,这个研究结果提示cavtratin的肺保护作用与HO-1的抗炎作用有关,同时,本研究使用HO-1活性阻断剂ZnPP能够消除cavtratin对ALI的保护效果,也进一步提示cavtratin的保护作用是HO-1依赖的。
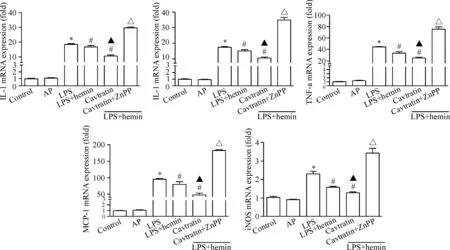
Figure 4.The anti-inflammatory effect of cavtratin on LPS-induced ALI in the mice. Total RNA was extracted from mice lung tissues and reverse transcription was performed to generate cDNA for real-time PCR. The expression level in control group was normalized to 1. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsLPS group;▲P<0.05vsLPS+hemin group;△P<0.05vsLPS+hemin+cavtratin group.
图4 Cavtratin对LPS诱导的急性肺损伤小鼠肺组织促炎因子表达的影响
总之,本研究发现cavtratin可以通过影响HO-1与Cav-1的结合使得HO-1活性增加,进而对LPS诱导的小鼠ALI产生保护作用。Cavtratin和血晶素联合用药有可能成为临床治疗LPS诱导的ALI的新方法。
[1] Patel HH, Insel PA. Lipid rafts and caveolae and their role in compartmentation of redox signaling[J]. Antioxid Redox Signal, 2009, 11(6):1357-1372.
[2] 蒋 萍, 甫拉提·吐尔逊, 李俊红, 等. Caveolin-1在17β-雌二醇对抗脂多糖诱导的血管平滑肌细胞MCP-1表达中的作用[J]. 中国病理生理杂志, 2010, 26(12):2321-2326.
[3] Razani B, Woodman SE, Lisanti MP. Caveolae: from cell biology to animal physiology [J]. Pharmacol Rev, 2002, 54(3):431-467.
[4] Jin Y, Lee SJ, Minshall RD, et al. Caveolin-1: a critical regulator of lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 300(2):L151-L160.
[5] Taira J, Sugishima M, Kida Y, et al. Caveolin-1 is a competitive inhibitor of heme oxygenase-1 (HO-1) with heme: identification of a minimum sequence in caveolin-1 for binding to HO-1[J]. Biochemistry, 2011, 50(32):6824-6831.
[6] Jin Y, Kim HP, Chi M, et al. Deletion of caveolin-1 protects against oxidative lung injury via up-regulation of heme oxygenase-1[J]. Am J Respir Cell Mol Biol, 2008, 39(2):171-179.
[7] 黄 聿, 刘 建. 未结合胆红素介导了糖尿病小鼠中血红素加氧酶-1对血管的保护作用[J]. 中国病理生理杂志, 2015, 31(10):1869.
[8] Hualin C, Wenli X, Dapeng L, et al. The anti-inflammatory mechanism of the heme oxygenase-1 induced by hemin in primary rat alveolar mechanism[J]. Inflammation, 2012, 35(3):1087-1093.
[9] Tourkina E, Richard M, Gööz P, et al. Antifibrotic properties of caveolin-1 scaffolding domaininvitroandinvivo[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(5):L843-L861.
[10]Kuribayashi K, Iida S, Nakajima Y, et al. Suppression of heme oxygenase-1 activity reduces airway hyperresponsiveness and inflammation in a mouse model of asthma[J]. J Asthma, 2015, 52(7):1-7.
[11]Xia P, Chen HY, Chen SF, et al. The stimulatory effects of eNOS/F92A-Cav1 on NO production and angiogenesis in BMSCs[J]. Biomed Pharmacother, 2016, 77:7-13.
[12]Bernatchez P, Sharma A, Bauer PM, et al. A noninhibitory mutant of the caveolin-1 scaffolding domain enhances eNOS-derived NO synthesis and vasodilation in mice[J]. J Clin Invest, 2011, 121(9):3747-3755.
[13]Newton AH, Cardani A, Braciale TJ. The host immune response in respiratory virus infection: balancing virus clea-rance and immunopathology[J]. Semin Immunopathol, 2016, 38(4):1-12.
[14]Raval CM, Lee PJ. Heme oxygenase-1 in lung disease[J]. Curr Drug Targets, 2010, 11(12):1532-1540.
(责任编辑: 林白霜, 罗 森)
Effects of caveolin-1 scaffolding domain peptide on LPS-induced acute lung injury in mice
WENG Ping1, ZHANG Xiao-tong1, CHEN Wei2, TIAN Wen-fang1, CHEN Jun-liang1, YUAN Jia-jia1, CHEN Xin-jie1, PANG Qing-feng1
(1WuxiMedicalSchool,JiangnanUniversity,Wuxi214122,China;2DepartmentofEmergency,TheThirdPeople’sHospitalofWuxiCity,Wuxi214041,China.E-mail:qfpang@jiangnan.edu.cn)
AIM: To investigate the effects of caveolin-1 (Cav-1) scaffolding domain peptide, cavtratin, on lipopolysaccharide (LPS)-induced mouse acute lung injury and heme oxygenase-1 (HO-1) activity. METHODS: Adult male BALB/c mice were randomly divided into 6 groups (n=8 to 10): control, Antennapedia internalization sequence (AP), LPS, LPS+hemin, LPS+ hemin+cavtratin and LPS+hemin+cavtratin+zinc protoporphyrin IX (ZnPP) groups. After LPS administration for 24 h, the lung pathological changes, the wet/dry weight (W/D) ratio of lung tissues, total cell number in bronchoalveolar lavage fluid and serum lactate dehydrogenase activity were measured. The co-localization of HO-1 and Cav-1 was displayed by immunofluorescence, and the HO-1 activity were detected. The mRNA expression of pro-inflammatory cytokines IL-1β, IL-6, TNF-α, MCP-1 and iNOS was detected by real-time PCR. RESULTS: The mice in LPS+hemin+cavtratin group had the decreased interaction between HO-1 and Cav-1, and the increased HO-1 activity compare with LPS group (P<0.05). Compared with LPS group, the pulmonary damage was attenuated in LPS+hemin+cavtratin group, and the injury indexes, including W/D ratio, total cell number in bronchoalveolar lavage fluid and lactate dehydrogenase activity in the serum, and the mRNA expression of inflammatory cytokines all decreased (P<0.05). HO-1 activity inhibitor ZnPP abolished the above protective effect of cavtratin on the lung tissues with LPS-induced acute lung injury. CONCLUSION: Cavtratin has beneficial effects on the lung with LPS-induced acute injury by restoring the HO-1 activity.
Caveolin-1; Heme oxygenase-1; Acute lung injury; Lipopolysaccharide
1000- 4718(2017)08- 1475- 06
2016- 10- 25
2017- 03- 24
国家自然科学基金资助项目(No. 81270126);中央高校基本科研业务费专项资金资助(No. JUSRP51412B);江苏省研究生培养创新工程项目(No. KYZZ16_0312; No. KYLX15_1196);国家级大学生创新创业训练计划项目(No. 201610295074);江苏省医学会/康缘药业临床医学科研专项基金(No. 2015JZKY07)
R563; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.08.021
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0510-85328363; E-mail: qfpang@jiangnan.edu.cn
