静脉表型分子COUP-TFⅡ表达降低对血管内皮细胞衰老的影响*
2017-09-03赖亚宇顾文竹武晓静
赖亚宇, 周 骐, 郑 微, 靳 鹏, 顾文竹, 武晓静△
(1第三军医大学附属新桥医院全军心血管内科中心,重庆 400037; 2重庆医科大学第二附属医院心内科,重庆 400010)
·论 著·
静脉表型分子COUP-TFⅡ表达降低对血管内皮细胞衰老的影响*
赖亚宇1, 周 骐2, 郑 微1, 靳 鹏1, 顾文竹1, 武晓静1△
(1第三军医大学附属新桥医院全军心血管内科中心,重庆 400037;2重庆医科大学第二附属医院心内科,重庆 400010)
目的: 观察静脉表型分子鸡卵清蛋白上游启动子转录因子Ⅱ(COUP-TFⅡ)表达对血管内皮细胞衰老的影响和分子机制。方法: 通过RT-qPCR检测比较人冠状动脉内皮细胞(HCAEC)和人脐静脉内皮细胞(HUVEC)中COUP-TFⅡ的表达情况。使用10-5mol/L血管紧张素Ⅱ(AngⅡ)诱导HUVEC衰老,通过COUP-TFⅡ特异性小干扰RNA(siCOUP-TFⅡ)转染HUVEC使其COUP-TFⅡ的表达降低,利用β-半乳糖苷酶染色、Western blot、CCK-8、细胞计数等方法分别观察siCOUP-TFⅡ对AngⅡ诱导的血管内皮细胞衰老及增殖的影响,通过Western blot检测Akt信号分子的表达变化。结果: 与HCAEC相比,HUVEC中COUP-TFⅡ呈显著高表达;用siCOUP-TFⅡ抑制HUVEC的COUP-TFⅡ表达时,能显著促进AngⅡ诱导的内皮细胞衰老并抑制内皮细胞增殖和p-Akt蛋白水平;加入Akt激动剂SC79 (4 mg/L)能够部分逆转siCOUP-TFⅡ对AngⅡ诱导的HUVEC衰老和增殖的影响。结论: COUP-TFⅡ表达降低可促进血管内皮细胞衰老并抑制内皮细胞增殖,其机制可能与调节Akt信号有关。
动脉粥样硬化; 血管内皮细胞; 细胞衰老; 细胞增殖; 鸡卵清蛋白上游启动子转录因子Ⅱ
动脉粥样硬化是造成冠心病和外周血管病的重要原因,是现代社会致死、致残、严重影响人类健康和生活质量的主要因素之一。动脉粥样硬化好发于动脉,虽然静脉与动脉同处于一个血管系统中,却未见静脉粥样硬化,这其中有部分血流动力学等因素的影响。目前尚不清楚动、静脉对粥样硬化易感性的差异除受血流动力学等环境因素影响外,是否还与二者不同的分子表型有关。
鸡卵清蛋白上游启动子转录因子Ⅱ(chicken ovalbumin upstream promoter-transcription factor Ⅱ,COUP-TFⅡ)是一种孤儿受体超家族成员,在胚胎时期对血管和淋巴管的生成起着重要调节作用[1]。研究发现COUP-TFⅡ只在静脉内皮表达,在胚胎血管形成时,其可通过抑制神经纤毛蛋白(neuropilin, NP)-1和Notch信号分子的表达来维持血管的静脉特征,而抑制静脉内皮COUP-TFⅡ表达后,静脉就会逐渐呈现动脉的特征[2-3]。COUP-TFⅡ特异表达于静脉内皮,然而目前尚不清楚其是否参与调节了血管粥样硬化的发生过程。血管内皮细胞衰老是引起动脉粥样硬化的重要发病机制之一[4],为进一步研究动、静脉本身分子表型差异与粥样硬化发生的关系,本研究观察了离体培养的人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAEC)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)中COUP-TFⅡ表达的差异,并利用特异性COUP-TFⅡ小干扰RNA(si-COUP-TFⅡ)抑制脐静脉内皮细胞COUP-TFⅡ表达,观察其对血管内皮细胞衰老及增殖的影响,试图从血管表型差异的角度揭示动脉粥样硬化的发病机制。
材 料 和 方 法
1 材料及试剂
HUVEC和HCAEC购自Promocell;胎牛血清和DMEM培养基购于Gibco;胰酶购于Hyclone;siRNA序列由上海吉玛公司合成:COUP-TFⅡ siRNA正义链序列为5’-GGC CGU AUA UGG CAA UUC ATT-3’,反义链序列为5’-UGA AUU GCC AUA UAC GGC CTT-3’;对照 siRNA(control siRNA)正义链序列为5’-UUC UCC GAA CGU GUC ACG UTT-3’, 反义链序列为5’-ACG UGA CAC GUU CGG AGA ATT-3’。RNA抽提试剂盒(RNAiso Kit)、逆转录试剂盒(PrimeScript® RT reagent Kit)和荧光定量PCR试剂盒(SYBR® Premix Ex TaqTM)均购于TaKaRa;所用引物由TaKaRa公司设计;Lipofectamine 2000转染试剂、Opti-MEI转染稀释液购于Invitrogen;血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)购于Sigma;β-半乳糖苷酶(β-galactosidase,β-Gal)染色试剂盒购于碧云天生物试剂公司;CCK-8试剂盒购于Dojindo;抗COUP-TFⅡ抗体购于Abcam;抗Akt和抗p-Akt抗体购于CST;抗P53抗体购于Bioworld;ECL化学显影液购于Millipore。
2 主要方法
2.1 细胞培养 在37 ℃、5% CO2、饱和湿度条件下,用含10%胎牛血清的DMEM培养基传代培养HUVEC和HCAEC。定期换液,细胞融合度达到80%~90%时,用胰酶进行消化后传代。
2.2 细胞转染 转染试剂采用Lipofectamine 2000,按试剂规定操作,大致步骤如下(以6孔板为例):用250 μL体积Opti-MEI培养基稀释5 μL siRNA母液(最终干扰浓度为50 nmol/L),轻轻混匀。使用前轻轻摇匀Lipofectamine 2000,然后取 5 μL Lipofectamine 2000在250 μL Opti-MEI培养基中稀释,室温放置5 min。将上述用Opti-MEI培养基稀释的siRNA和Lipofectamine 2000混合,轻轻混匀,室温放置20 min。将此混合物加入无血清DMEM中(终体积2 mL),在37 ℃、5% CO2环境中培养4~6 h后换用新鲜含10%胎牛血清的DMEM培养基继续培养。
2.3 RT-qPCR检测细胞COUP-TFⅡ的mRNA表达 用RNAiso Kit提取细胞中总RNA,将1 μg总RNA逆转录成cDNA。用COUP-TFⅡ实时荧光定量PCR引物进行荧光定量PCR检测。COUP-TFⅡ上游引物为5’-AAC ACA TCG AGT GCG TGG TGT-3’,下游引物为5’-TAC TGG CAC TGG TTG CGA TG-3’。采用GAPDH作为内参照,其上游引物为5’-AAC ACA TCG AGT GCG TGG TGT-3’,下游引物为5’-GTA GAG GCA GGG ATG ATG TTC T-3’。采用实时荧光定量PCR仪(StepOne Plus)扩增上述基因,其反应混合物为cDNA 2.0 μL, 2×SYBR® Premix Ex Taq Ⅱ混合物10 μL,上、下游引物各0.8 μL,ROX Reference Dye (50×) 0.4 μL,dH2O 6.0 μL。按95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s的条件进行40个循环反应。采用2-ΔΔCt原理进行mRNA表达量计算。
2.4 CCK-8实验检测细胞活力 HUVEC培养于96孔板,每孔1×103个细胞,实验组和对照组每种处理方式接种3~6个复孔,待细胞处于指数生长阶段分别转染COUP-TFⅡ siRNA或control siRNA,4~6 h后换液。转染24 h后,无血清培养基培养12 h使细胞处于同步化状态,AngⅡ(10-5mol/L)刺激48 h,加入CCK-8 试剂10 μL,37 ℃孵育4 h,酶标仪(Molecular)检测450 nm处的吸光度。
2.5 细胞计数 将HUVEC接种于6孔板,每孔1×105个细胞,待细胞处于指数生长阶段转染COUP-TFⅡ siRNA或control siRNA,4~6 h后换液。转染24 h后,无血清培养基培养12 h使细胞处于同步化状态,AngⅡ(10-5mol/L)刺激48 h后,在倒置显微镜下观察细胞生长情况,利用胰酶消化的方法收集细胞,用1 mL细胞培养基重悬细胞,取100 μL细胞悬液加入9.9 mL培养基进行稀释,利用细胞计数器进行细胞计数,观察细胞增殖情况。
2.6 Western blot分析 抽提各组细胞的蛋白,定量,SDS-聚丙烯酰胺凝胶电泳分离。蛋白在电泳分离结束后,切下目的蛋白所处的条带区域,置于电转装置的海绵上,用PVDF膜覆盖,放入电转液中,转膜80 min。转膜结束后,将PVDF膜置于培养皿,用TBST洗膜10 min×3次,之后用5%脱脂奶粉室温封闭2 h。封闭结束后,将稀释后的 I 抗孵育在PVDF膜上,置于4 ℃过夜。用TBST洗膜10 min×3次, 加入稀释后的 Ⅱ 抗37 ℃ 孵育1 h。用TBST洗膜10 min×3次,最后将显影液覆盖在膜上,在成像系统下进行显影。
2.7 β-Gal细胞染色 依据β-Gal染色试剂盒说明,吸除培养板里的液体,用PBS洗涤接种在培养板上的细胞1次,每孔用1 mL β-Gal 染色固定液,室温固定15 min。将染色固定液弃去,加入PBS,进行洗涤(3 min×3次)。清洗后,每个孔加入1 mL按说明配置好的工作液,放入37 ℃孵箱中,在无CO2条件下过夜,并用保鲜膜将6孔板进行密封以防止蒸发。倒置显微镜下每组样本任意挑选3个视野,观察胞浆被染为蓝色的情况,并计算蓝色细胞在总细胞数中所占的百分比。
3 统计学处理
采用SPSS 19.0软件进行统计学分析。计量资料以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析或独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 HCAEC和HUVEC COUP-TFⅡ表达的差异
为了评估COUP-TFⅡ在离体动、静脉内皮细胞的表达情况,我们将HUVEC和HCAEC置于37 ℃、5% CO2、饱和湿度条件下进行培养,待密度达到70%~80%时,提取其总RNA,逆转录,利用实时荧光定量PCR检测,发现在HCAEC中几乎测不到COUP-TFⅡ的mRNA表达,但在HUVEC中COUP-TFⅡ mRNA呈显著高表达,2组之间差异有统计学显著性(P<0.01),见图1。

Figure 1.The mRNA expression of COUP-TFⅡ in HCAEC and HUVEC. Mean±SD.n=6.**P<0.01vsHCAEC.
图1 RT-qPCR检测HCAEC和HUVEC中 COUP-TFⅡ mRNA的表达
2 COUP-TFⅡ siRNA 对HUVEC中COUP-TFⅡ mRNA和蛋白水平的影响
将siCOUP-TFⅡ及control siRNA分别转染至 HUVEC,24 h后抽提其RNA,逆转录,经荧光定量PCR检测,发现转染24 h后siCOUP-TFⅡ组细胞的COUP-TFⅡ表达量明显下降,mRNA表达量是对照组的45.63%,与对照组相比较,差异具有统计学显著性(P<0.05);转染48 h后抽提蛋白,经 Western blot检测发现,siCOUP-TFⅡ组细胞的COUP-TFⅡ蛋白表达水平较对照组明显下降,蛋白表达量是对照组的43.32%,与对照组相比较,具有显著差异(P<0.05),见图2。
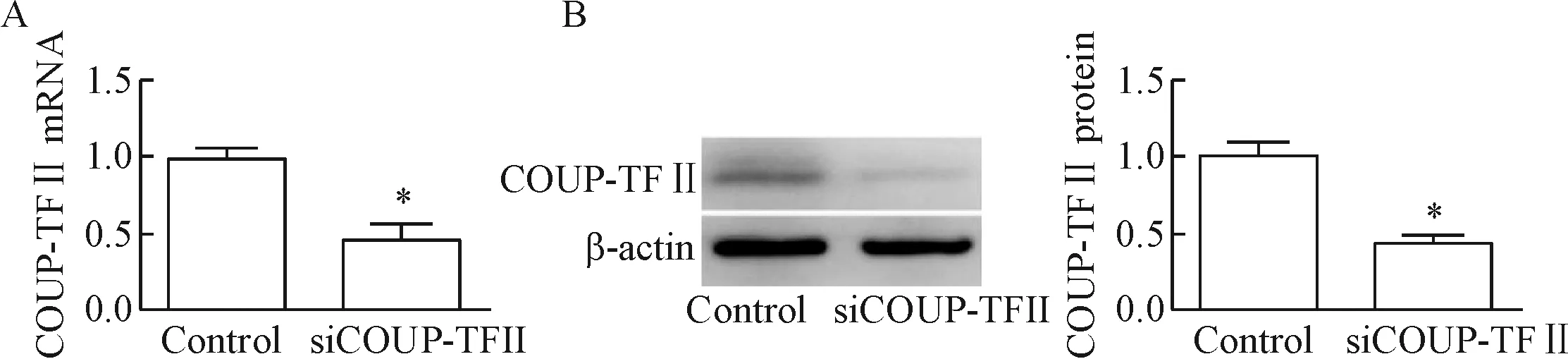
Figure 2.Knockdown of COUP-TFⅡ expression in HUVEC by siRNA transfection. A: the relative mRNA expression of COUP-TFⅡ detected by RT-qPCR; B: the protein expression of COUP-TFⅡ determined by Western blot. Mean±SD.n=4.*P<0.05vscontrol group.
图2 RT-qPCR及Western blot检测COUP-TFⅡ的表达
3 抑制HUVEC COUP-TFⅡ表达对AngⅡ诱导的血管内皮细胞衰老的影响
将siCOUP-TFⅡ及control siRNA分别转染至HUVEC,采用AngⅡ(0 mol/L、10-5mol/L)刺激作用48 h后,利用β-Gal化学染色,染色结果显示,AngⅡ浓度0 mol/L时,衰老相关β-Gal染色阳性率siCOUP-TFⅡ组为6.65%±1.32%,对照组为6.22%±1.92%,两者之间的差异无统计学显著性;AngⅡ浓度为10-5mol/L时,衰老相关β-Gal染色阳性率siCOUP-TFⅡ组为81.07%±4.52%,对照组β-Gal染色阳性率(43.90%±6.73%)明显低于siCOUP-TFⅡ组(P<0.05),见图3。利用Western blot 检测衰老分子标志物P53蛋白的表达情况,结果显示,AngⅡ浓度为0 mol/L时,siCOUP-TFⅡ组与对照组相比较,P53蛋白表达水平的差异无统计学显著性;AngⅡ浓度为10-5mol/L时,与对照组相比较,siCOUP-TFⅡ组P53蛋白的表达水平明显上调(P<0.05),见图3。结果表明抑制COUP-TFⅡ对基础状态HUVEC衰老无显著影响,但抑制其表达后能进一步促进AngⅡ诱导的血管内皮细胞衰老。

Figure 3.The senescence of AngⅡ induced-HUVEC after COUP-TFⅡ siRNA transfeetion. A: the β-Gal staining of HUVEC (×200); B: the protein expression of P53 determined by Western blot. Mean±SD.n=4.*P<0.05vscontrol group.
图3 抑制HUVEC的COUP-TFⅡ表达对AngⅡ诱导的内皮细胞衰老的影响
4 抑制HUVEC COUP-TFⅡ表达对AngⅡ诱导的血管内皮细胞增殖的影响
将siCOUP-TFⅡ及control siRNA分别转染至HUVEC,AngⅡ (0 mol/L、10-5mol/L)刺激作用48 h后,利用CCK-8实验检测发现,AngⅡ浓度为0 mol/L时,在450 nm处的相对吸光度siCOUP-TFⅡ组为98.39%±3.15%,对照组为100.00%±2.72%,两者之间相对吸光度的差异无统计学显著性;而AngⅡ浓度为10-5mol/L时,在450 nm处的相对吸光度siCOUP-TFⅡ组为57.43%±5.67%,对照组为100.00%±8.08%,siCOUP-TFⅡ组的相对吸光度较对照组明显降低,两者之间的差异有统计学显著性(P<0.05),见图4。细胞计数结果显示,AngⅡ浓度为0 mol/L时,对照组的细胞计数较siCOUP-TFⅡ组比较,两者之间的差异无统计学显著性;而AngⅡ浓度为10-5mol/L时,对照组的细胞计数为显著高于siCOUP-TFⅡ组,两者之间的差异有统计学显著性(P<0.05),见图4。结果表明抑制COUP-TFⅡ对基础状态的HUVEC增殖无明显影响,但抑制COUP-TFⅡ表达后能抑制AngⅡ诱导的血管内皮细胞增殖。
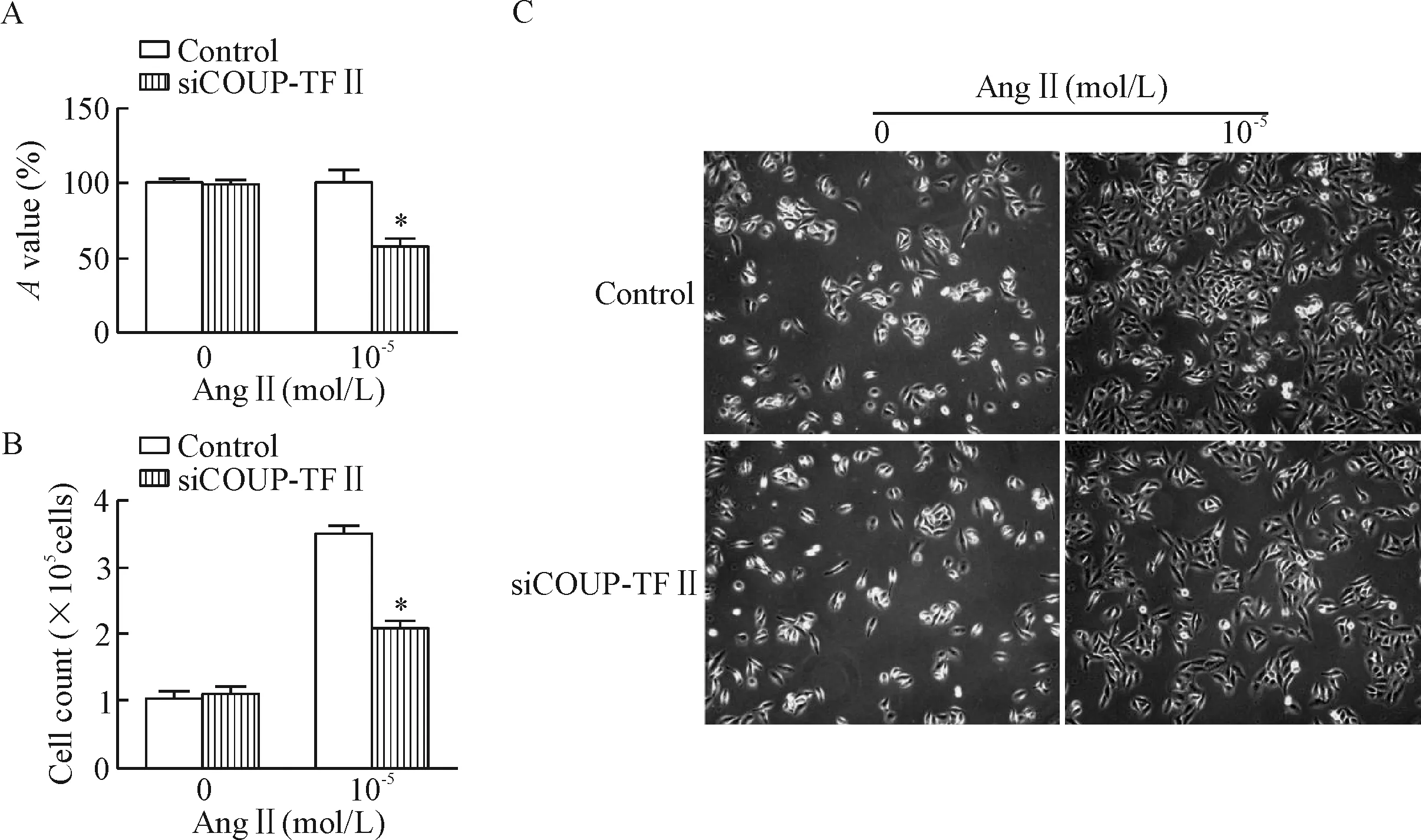
Figure 4.The proliferation of AngⅡ-induced HUVEC after COUP-TFⅡ siRNA transfection. A: comparison of theAvalues by CCK-8 assay; B: the results of the cell number counting; C: the images of HUVEC under microscope (×100). Mean±SD.n=4.*P<0.05vscontrol group.
图4 抑制HUVEC COUP-TFⅡ表达对AngⅡ诱导内皮细胞增殖的影响
5 COUP-TFⅡ表达对HUVEC细胞衰老增殖的影响与Akt信号的关系
Akt信号是影响细胞衰老和增殖的关键信号通路,为了探讨COUP-TFⅡ调节AngⅡ诱导的内皮细胞衰老增殖的机制,我们进一步观察了其与Akt信号的关系。结果发现将siCOUP-TFⅡ及control siRNA分别转染至HUVEC,在AngⅡ浓度为0 mol/L时,siCOUP-TFⅡ组与对照组相比较, Akt及p-Akt的蛋白水平并无差异。与对照组相比,在AngⅡ浓度为10-5mol/L时siCOUP-TFⅡ组的Akt蛋白水平无显著差异,但p-Akt的蛋白水平明显下调(P<0.05),见图5。

Figure 5.The protein levels of p-Akt/Akt in the AngⅡ induced-HUVEC after COUP-TFⅡ siRNA transfection determined by Western blot. Mean±SD.n=4.*P<0.05vscontrol group.
图5 Western blot检测抑制COUP-TFⅡ表达对AngⅡ诱导的HUVEC中p-Akt蛋白水平的影响
为进一步阐明COUP-TFⅡ调节AngⅡ刺激血管内皮衰老和增殖与Akt信号的关系,我们加入Akt激动剂SC79(4 mg/L),利用β-Gal染色、Western blot实验检测P53蛋白及用CCK-8、细胞计数的方法分别观察HUVEC衰老及增殖情况,结果显示加入Akt激动剂SC79后,β-Gal染色阳性率明显较siCOUP-TFⅡ组降低(P<0.05);Western blot检测衰老分子标志物P53蛋白表达水平也明显降低(P<0.05);此外,与siCOUP-TFⅡ组比较,SC79与siCOUP-TFⅡ合用组在450 nm的相对吸光度及细胞计数值均明显升高(P<0.05),见图6。这提示Akt激动剂SC79能够部分逆转siCOUP-TFⅡ对血管内皮细胞衰老和增殖的影响。
讨 论
本研究中,我们观察了静脉表型分子COUP-TF Ⅱ 对血管内皮细胞衰老增殖的影响及其分子机制。我们发现COUP-TF Ⅱ 在离体HUVEC呈现显著高表达;在无Ang Ⅱ 诱导的基础状态下,抑制COUP-TF Ⅱ 表达后HUVEC的衰老增殖并无显著变化;而在Ang Ⅱ (10-5mol/L)诱导状态下,抑制COUP-TF Ⅱ 表达可促进HUVEC衰老并抑制其增殖,其分子机制可能与其调节Akt信号有关。
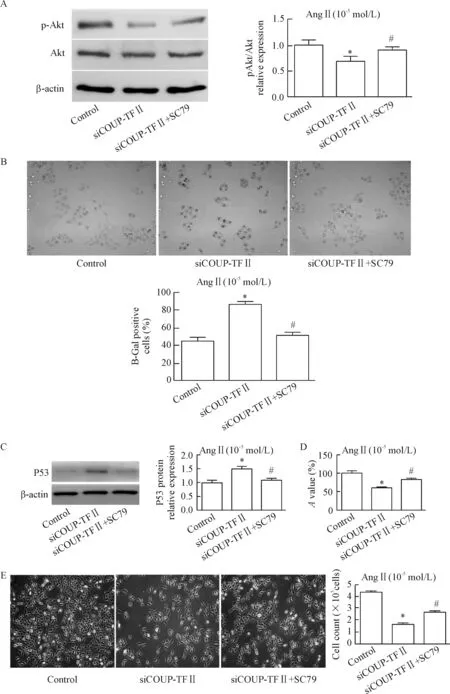
Figure 6.The effects of Akt activator SC79 on senescence and proliferation of AngⅡ-indued HUVEC after transfection with siCOUP-TFⅡ. A: the protein levels of p-Akt/Akt; B: the β-Gal staining of HUVEC (×200); C: the protein expression of P53 by Western blot; D: theAvalue of CCK-8 assay; E: the cell number counting (×100). Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vssiCOUP-TFⅡ.
图6 Akt激动剂SC79对AngⅡ诱导的低表达COUP-TFⅡ的HUVEC衰老增殖的影响
研究已经发现,在体情况下,COUP-TFⅡ只在静脉血管内皮中表达,而在动脉血管内皮中不表达[2-3]。然而,COUP-TFⅡ不仅在胚胎发育时决定动静脉表型,还具有调节代谢功能。已有研究表明,线粒体进行β氧化和糖代谢过程相关的几种酶都是COUP-TFⅡ的下游靶基因,COUP-TFⅡ可通过抑制或增强它们的转录活性从而参与代谢的调节[5]; Weatherford等[6]研究发现,COUP-TFⅡ可以抑制肾素的表达,而肾素在破坏内皮细胞之间的连接、内皮细胞与单核细胞间的相互黏附以及在一些与血小板源性相关生长因子的生成过程中均起着重要作用,而这些都是导致动脉粥样硬化发生的重要途径;Okamura等[7]发现COUP-TFⅡ能通过Wnt途径抑制过氧化物酶体增殖物激活受体γ的基因表达,从而通过影响氧化应激过程,在粥样硬化启动、血管壁细胞功能和斑块的稳定性等过程中发挥重要作用。最近更有研究发现,COUP-TFⅡ表达降低后,可以上调炎症基因的表达和下调抗血栓形成基因的表达,从而使血管内皮细胞表型表现出促动脉粥样硬化发生的趋势[8]。因此,上述研究提示,COUP-TFⅡ不仅对动静脉表型的分化过程起着关键作用,而且还可能对动脉粥样硬化的发生有着重要的影响。
为进一步研究COUP-TFⅡ与动脉粥样硬化易感性差异的关系,我们先在离体情况下分别培养了HCAEC和HUVEC,检测了COUP-TFⅡ在两者中mRNA的水平,结果发现,COUP-TFⅡ在HUVEC中呈现出明显的高表达,结果与在体情况下是一致的。血管内皮细胞衰老是内皮功能失调的病理生理机制之一,在许多血管性疾病的启始过程中起着重要作用。Qin等[9]在前列腺癌研究中发现,COUP-TFⅡ的过表达能够减弱致癌基因诱导的癌组织衰老,而在PTEN敲除小鼠模型中,COUP-TFⅡ表达的降低可以通过激活TGF-β信号诱导衰老。但是COUP-TFⅡ表达降低后血管内皮细胞的衰老情况还不清楚。以往研究已经发现,衰老相关β-Gal活性和P53蛋白表达变化是细胞衰老的标志之一[10-11]。因此,我们通过检测细胞衰老相关β-Gal阳性率和P53蛋白表达的方法来探讨了COUP-TFⅡ表达降低后与HUVEC衰老之间的关系。结果发现,通过siRNA抑制HUVEC中COUP-TFⅡ的表达后,在无AngⅡ诱导状态下,HUVEC在siCOUP-TFⅡ组与对照组的β-Gal染色阳性率和衰老标志分子P53蛋白表达并无显著差异;而在一定浓度AngⅡ(10-5mol/L)的诱导刺激后,与对照组相比较,siCOUP-TFⅡ组衰老血管内皮细胞比例和P53蛋白表达量明显升高。从而表明,COUP-TFⅡ对无AngⅡ诱导的基础状态下的血管内皮细胞衰老并无明显影响,但对AngⅡ诱导状态下的血管内皮细胞的衰老起着一定保护作用,而抑制COUP-TFⅡ表达可以促进血管内皮细胞的衰老。
既往研究发现,AngⅡ在诱导血管内皮细胞发生衰老变化时,可下调处于S期细胞的比例,最终抑制细胞进入增殖周期而抑制其增殖[12]。Qin等[13]通过研究也发现,COUP-TFⅡ在控制血管生长时可以调控血管内皮细胞的增殖和迁移功能。Zheng等[14]也研究发现,在肾肿瘤细胞中用siRNA抑制COUP-TFⅡ的表达后,肾肿瘤细胞的增殖能力显著降低,而凋亡增加。Park等[15]发现,生长分化因子15在人动脉内皮细胞过表达促进内皮细胞衰老的同时,降低其增殖能力。因此,我们进一步探索了COUP-TFⅡ表达降低后,在衰老发生的同时,血管内皮细胞的增殖变化。在本研究中,我们利用siRNA抑制HUVEC中COUP-TFⅡ的表达,在无AngⅡ诱导状态下,HUVEC不受siCOUP-TFⅡ影响;而在一定浓度AngⅡ(10-5mol/L)的诱导刺激作用一定时间后,siCOUP-TFⅡ组细胞增殖能力明显降低。因此,说明COUP-TFⅡ对无AngⅡ诱导的基础状态下的血管内皮细胞增殖并无显著影响,但对AngⅡ诱导状态下血管内皮细胞增殖能力有明显调节作用。
近年来研究已表明,Akt信号转导通路可能是调控衰老的一条重要信号途径。在胞浆中,Akt磷酸化后可在细胞衰老、增殖的调控中表现出重要作用[16],而Ser473位点在Akt磷酸化位点中作为最直接的位点,被广泛用作Akt活化的标志。因此,我们用Western blot检测了在抑制COUP-TFⅡ表达后,Akt Ser473位点磷酸化水平。结果发现,在无AngⅡ诱导的基础状态时,抑制COUP-TFⅡ表达后,p-Akt/Akt的蛋白水平在siCOUP-TFⅡ组和对照组之间并无发生显著差异;但在AngⅡ(10-5mol/L)诱导一定时间后,虽然siCOUP-TFⅡ组Akt蛋白与对照组相比较并无明显变化,但磷酸化Akt蛋白的表达量较对照组相比明显下降,提示抑制COUP-TFⅡ表达后,HUVEC衰老增殖的变化可能与Akt信号参与有关。为了进一步验证上述结果,我们又在抑制COUP-TFⅡ表达后,加入了Akt激动剂SC79,结果表明SC79能够部分逆转由于抑制COUP-TFⅡ表达而引起的HUVEC衰老和增殖变化。
综上所述,本实验研究结果表明静脉表型分子COUP-TFⅡ在离体HUVEC呈现显著高表达, COUP-TFⅡ对基础状态下血管内皮细胞衰老和增殖无明显影响,但在AngⅡ诱导下,抑制静脉表型分子COUP-TFⅡ的表达会促进HUVEC的衰老,抑制HUVEC的增殖,其作用机制可能与其调节Akt信号有关。COUP-TFⅡ是区别动、静脉内皮细胞的重要分子标志之一,其对血管内皮细胞衰老与增殖的调节,提示其影响了动、静脉血管对粥样硬化发生的易感性。本研究从血管本身分子差异的角度揭示了动、静脉粥样硬化易感性的机制。
[1] Pereira FA, Qiu Y, Zhou G, et al. The orphan nuclear receptor COUP-TFⅡ is required for angiogenesis and heart development[J]. Genes Dev, 1999, 15(13):1037-1049.
[2] Swift MR, Weinstein BM. Arterial-venous specification during development[J]. Circ Res, 2009, 104(5):576-588.
[3] You LR, Lin FJ, Lee CT, et al. Suppression of Notch signalling by the COUP-TFⅡ transcription factor regulates vein identity[J]. Nature, 2005, 435(7038):98-104.
[4] Minamino T, Komuro I. Vascular cell senescence: contribution to atherosclerosis[J]. Circ Res, 2007, 100(1):15-26.
[5] Brunssen C, Korten S, Brux M, et al. COUP-TF2 is regulated by high glucose in endothelial cells[J]. Horm Metab Res, 2010, 42(2):81-87.
[6] Weatherford ET, Liu X, Sigmund CD. Regulation of renin expression by the orphan nuclear receptors Nr2f2 and Nr2f6[J]. Am J Physiol Renal Physiol,2012, 302 (8):F1025-F1033.
[7] Okamura M, Kudo H, Wakabayashi K, et al. COUP-TF2 acts downstream of Wnt/β-catenin signal to silence PPARγ gene expression and repress adipogenesis[J]. Proc Natl Acad Sci U S A, 2009, 106(14):5819-5824.
[8] Cui X, Lu YW, Lee V, et al. Venous endothelial marker COUP-TFⅡ regulates the distinct pathologic potentials of adult arteries and veins[J]. Sci Reports, 2015, 5:16193.
[9] Qin J, Wu SP, Creighton CJ, et al. COUP-TFⅡ inhibits TGF-β-induced growth barrier to promote prostate tumorigenesis[J]. Nature, 2013, 493(7431):236-240.
[10]宋志明, 王 敏, 刘 勇, 等. 硫化氢通过抑制氧化应激改善高糖诱导的内皮细胞衰老[J]. 中国病理生理杂志, 2014, 30(8):1345-1350.
[11]Zhou Z, Yin Y, Chang Q, et al. Downregulation of B-myb promotes senescence via the ROS-mediated p53/p21 pathway, in vascular endothelial cells[J]. Cell Prolif, 2017, 50(2):e12319.
[12]Shan HY, Bai XJ, Chen XM. Apoptosis is involved in the senescence of endothelial cells induced by angiotensin[J]. Cell Biol Int, 2008, 32(2):264-270.
[13]Qin J, Chen X, Lee Y, et al. Nuclear receptor COUP-TFⅡ controls pancreatic islet tumor angiogenesis by regulating vascular endothelial growth factor/vascular endothelial growth factor receptor-2 signaling[J].Cancer Res, 2010, 70(21):8812-8821.
[14]Zheng J, Qin WJ, Jiao D, et al. Knockdown of COUP-TFⅡ inhibits cell proliferation and induces apoptosis through upregulating BRCA1 in renal cell carcinoma cells[J]. Int J Cancer, 2016, 139(7):1574-1585.
[15]Park H, Kim CH, Jeong JH, et al. GDF15 contributes to radiation-induced senescence through the ROS-mediated p16 pathway in human endothelial cells[J]. Oncotarget, 2016, 7(9):9634-9644.
[16]Tzivion G, Hay N. PI3K-AKT-FoxO axis in cancer and aging[J]. Biochim Biophys Acta, 2011, 1813(11):1925.
(责任编辑: 林白霜, 罗 森)
Effect of venous marker COUP-TFⅡ knockdown on senescence of vascular endothelial cells
LAI Ya-yu1, ZHOU Qi2, ZHENG Wei1, JIN Peng1, GU Wen-zhu1, WU Xiao-jing1
(1CardiologyCenterofPLA,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;2CardiovascularDepartmentofTheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China.E-mail:xiaojingwu1992@163.com)
AIM: To investigate the effect of venous marker chicken ovalbumin upstream promoter-transcription factor Ⅱ (COUP-TFⅡ) expression on vascular endothelial cell senescence and its molecular mechanism. METHODS: The mRNA expression of COUP-TFⅡ in the human coronary artery endothelial cells (HCAEC) and human umbilical vein endothelial cells (HUVEC) was detected by RT-qPCR. After transfection with a COUP-TFⅡ siRNA (siCOUP-TFⅡ) to inhibit COUP-TFⅡ expression in the HUVEC, the senescence and proliferation of endothelial cells were evaluated by β-galactosidase staining, Western blot, CCK-8 assay and cell counting after treatment with 10-5mol/L angiotensin Ⅱ (AngⅡ). The protein levels of Akt and p-Akt were determined by Western blot. RESULTS: Compared with the HCAEC, COUP-TFⅡ was significantly highly expressed in the HUVEC. Knockdown of COUP-TFⅡ via siCOUP-TFⅡ significantly induced endothelial cell senescence and inhibited endothelial cell proliferation and p-Akt level after treatment with AngⅡ at 10-5mol/L. Furthermore, an Akt activator SC79 at 4 mg/L partly reversed the effect of siCOUP-TFⅡ on AngⅡ-induced endothelial cell senescence and proliferation. CONCLUSION: Knockdown of COUP-TFⅡ promotes endothelial cell senescence and inhibits endothelial cell proliferation, which might be partly regulated by Akt signaling.
Atherosclerosis; Vascular endothelial cells; Cell senescence; Cell proliferation; Chicken ovalbumin upstream promoter-transcription factor Ⅱ
1000- 4718(2017)08- 1345- 08
2016- 12- 12
2017- 03- 02
国家自然科学基金资助项目(No. 81370404; No. 91539104)
R339.3+8; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.08.001
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-68774559; E-mail: xiaojingwu1992@163.com
