阿苯达唑亚砜温敏型原位凝胶抗泡球蚴的效果
2017-09-03刘许诺
冯 祎,王 芬,刘许诺,王 昕,叶 彬
阿苯达唑亚砜温敏型原位凝胶抗泡球蚴的效果
冯 祎1,王 芬1,刘许诺1,王 昕2,叶 彬1
目的探索阿苯达唑亚砜(albendazole sulfoxide,ABZSO)与聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(PLGA-PEG-PLGA)制备的阿苯达唑亚砜温敏型原位凝胶(ABZSO/PLGA-PEG-PLGA)抗泡球蚴的效果。方法应用ABZSO/PLGA-PEG-PLGA(20 μg/mL、40 μg/mL、80 μg/mL)、ABZSO(40 μg/mL)、PLGA-PEG-PLGA处理体外培养泡球蚴并统计原头节的存活率,采用扫描电镜观察各处理组泡球蚴或原头节形态变化;以各药物组治疗泡球蚴病大鼠动物模型后检查泡球蚴体积大小。结果药物处理体外培养泡球蚴18 d时,ABZSO/PLGA-PEG-PLGA(40 μg/mL)原头节存活率显著低于ABZSO(40 μg/mL)组;扫描电镜结果显示ABZSO/PLGA-PEG-PLGA(80 μg/mL)组的原头节结构被显著破坏;动物体内实验表明ABZSO/PLGA-PEG-PLGA(4 mg/mL)组对抗泡球蚴效果比其他各药物组显著。结论ABZSO/PLGA-PEG-PLGA具有抗泡球蚴的效果。
多房棘球绦虫;泡球蚴病;阿苯达唑亚砜;温敏型原位凝胶
泡球蚴病(Alveolar echinococcosis, AE)是由多房棘球蚴绦虫幼虫泡球蚴感染引起的一种对人体有严重危害的人兽共患病。如未及时治疗,5年和10年的致死率分别高至70%[1]和93%[2]。目前,AE的治疗主要是以根治性手术切除为主[3],但由于泡球蚴具有侵润性、外生性生长的特点[4],手术并不总是有效或可行的,在某些情况下甚至可能增加传播的风险[5]。因此,对于无法手术治疗的患者而言,药物治疗便成为主要的治疗途径。在过去的20多年里,苯并咪唑类衍生物在临床上已经广泛用于化学治疗肝泡球蚴病[6],其中,阿苯达唑是目前国内外公认的最有效的治疗药物。然而,据相关文献报道,阿苯达唑在体内仅作为“前体性药物”,它的代谢产物阿苯达唑亚砜是阿苯达唑发挥作用的主要活性物质[5],而全身给药时,药物在靶器官的浓度通常会很低[7],为提高临床治疗效果,本课题组在前期成功制备了缓释制剂-阿苯达唑亚砜温敏型原位凝胶(ABZSO/PLGA-PEG-PLGA)并对其药效进行了初步的研究。本文旨在进一步考察ABZSO/PLGA-PEG-PLGA体外及动物体内抗泡球蚴的效果。
1 材料与方法
1.1 材料与仪器
1.1.1 阿苯达唑亚砜(武汉远成共创有限公司,纯度≥98%);PLGA-PEG-PLGA(济南岱罡生物科技有限公司);RPMI-1640(Sigma)。
1.1.2 采用溶剂挥发法[8]分别制备阿苯达唑亚砜温敏型原位凝胶(ABZSO/PLGA-PEG-PLGA)1、2、4 mg/mL及PLGA-PEG-PLGA(20%),具体操作如下:将不同量的ABZSO及一定量的PLGA-PEG-PLGA共聚物同时溶于乙醇中,并用旋转蒸发仪60 ℃真空干燥除去溶剂直至完全除去后再加一定量的水,最后用磁力搅拌器搅拌溶解从而配制成ABZSO/PLGA-PEG-PLGA(1、2、4 mg/mL)[9]。
1.2 体外实验
1.2.1 原头节 泡球蚴大鼠模型,由成都医学院基础医学院王昕老师赠送。在无菌条件下,从泡球蚴大鼠模型的腹腔中取出泡球蚴组织,剪碎,用含抗生素的生理盐水冲洗3次,得到原头节混悬液,然后用台盼蓝染液鉴别原头节的活力,活力在95%以上即可用于体外培养。
1.2.2 药物配制及分组 用含20%小牛血清的1640培养基分别将ABZSO/PLGA-PEG-PLGA(1、2、4 mg/mL)调整浓度为20、40、80 μg/mL;将ABZSO用DMSO配制成40 μg/mL 溶液。实验分为低剂量组(20 μg/mL)、中剂量组(40 μg/mL)、高剂量组(80 μg/mL)、ABZSO组(40 μg/mL)、PLGA-PEG-PLGA组(20%)和空白对照组(加入等量培养基)6个组。
1.2.3 方法 将收集好的原头节混悬液振荡均匀后,分别吸取2 mL移入12个培养瓶中,随后给每个培养瓶加入1640培养基至20 mL,置37 ℃、5% CO2孵箱中培养。24 h后吸取200 μL原头节混悬液用台盼蓝染色并在光镜下计数,最后给12个培养瓶中分别加入0.2 mL上述6个组的成分(每组两个平行培养瓶)并置于孵箱培养。实验过程中隔天换液并计数,培养至18 d。
1.3 扫描电镜 取上述6组药物体外培养后的混悬液为样本,置4%戊二醛前固定,四氧化锇后固定,丙酮梯度脱水,切片后处理,用扫描电镜进行观察。
1.4 动物体内实验
1.4.1 实验动物及模型建立 雌性SD大鼠40只,体重(150±20)g(购自重庆医科大学实验动物中心)。将泡球蚴大鼠模型处死后,在无菌条件下解剖,取出泡球蚴组织并剪碎,用含抗生素的生理盐水反复冲洗得到所需浓度的混悬液用于接种。用特制接种针于实验大鼠右下腹穿刺腹腔接种泡球蚴组织混悬液2 mL,共接种40只,将接种好的大鼠随机分为5组:ABZSO/PLGA-PEG-PLGA低剂量组(1 mg/mL)、ABZSO/PLGA-PEG-PLGA中剂量组(2mg/mL)、ABZSO/PLGA-PEG-PLGA高剂量组(4 mg/mL)、ABZSO组和空白对照组。
1.4.2 药物治疗方案 动物模型于感染1个月后开始使用药物治疗。根据已设定好的4个药物组分别给模型大鼠腹腔注射药物2 mL,每4 d给药一次,连续治疗1个月,末次给药30 d后剖检。
2 结 果
2.1 体外抗泡球蚴效果 各药物组体外培养的原头节存活率(图1),体外培养2 d时,空白对照组中原头节的存活率是94%,PLGA-PEG-PLGA组的存活率是93%。体外培养18 d时,ABZSO/PLGA-PEG-PLGA (20、40、80 μg/mL) 组的原头节存活率分别是10%,3%,1%,明显低于对照组的原头节存活率。
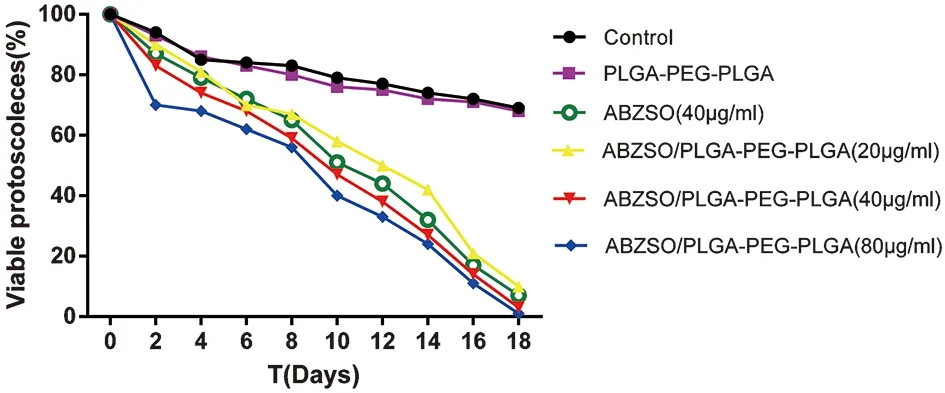
图1 不同药物组体外培养原头节的存活率Fig.1 Percentage of viable protoscoleces incubated with different drug groups in vitro
2.2 扫描电镜 通过扫描电镜观察实验组和对照组中泡球蚴的形态和结构的变化如图2。对照组中原头节的形态正常(图2a),PLGA-PEG-PLGA组中原头节的结构完整,基本无改变(图2b), ABZSO/PLGA-PEG-PLGA (20 μg/mL)组原头节形态有轻微的变形(图2c),而ABZSO/PLGA-PEG-PLGA(40 μg/mL)和ABZSO/PLGA-PEG-PLGA(80 μg/mL)组原头节分别有严重的变形和破坏(图2e、2f)。2.3 动物体内实验 各治疗组模型大鼠剖检后泡球蚴的形态大小(图3)。ABZSO组的泡球蚴体积比ABZSO/PLGA-PEG-PLGA(2 mg/mL)组的大,ABZSO/PLGA-PEG-PLGA(2 mg/mL)组的泡球蚴体积明显比ABZSO/PLGA-PEG-PLGA(4 mg/mL)组的大。
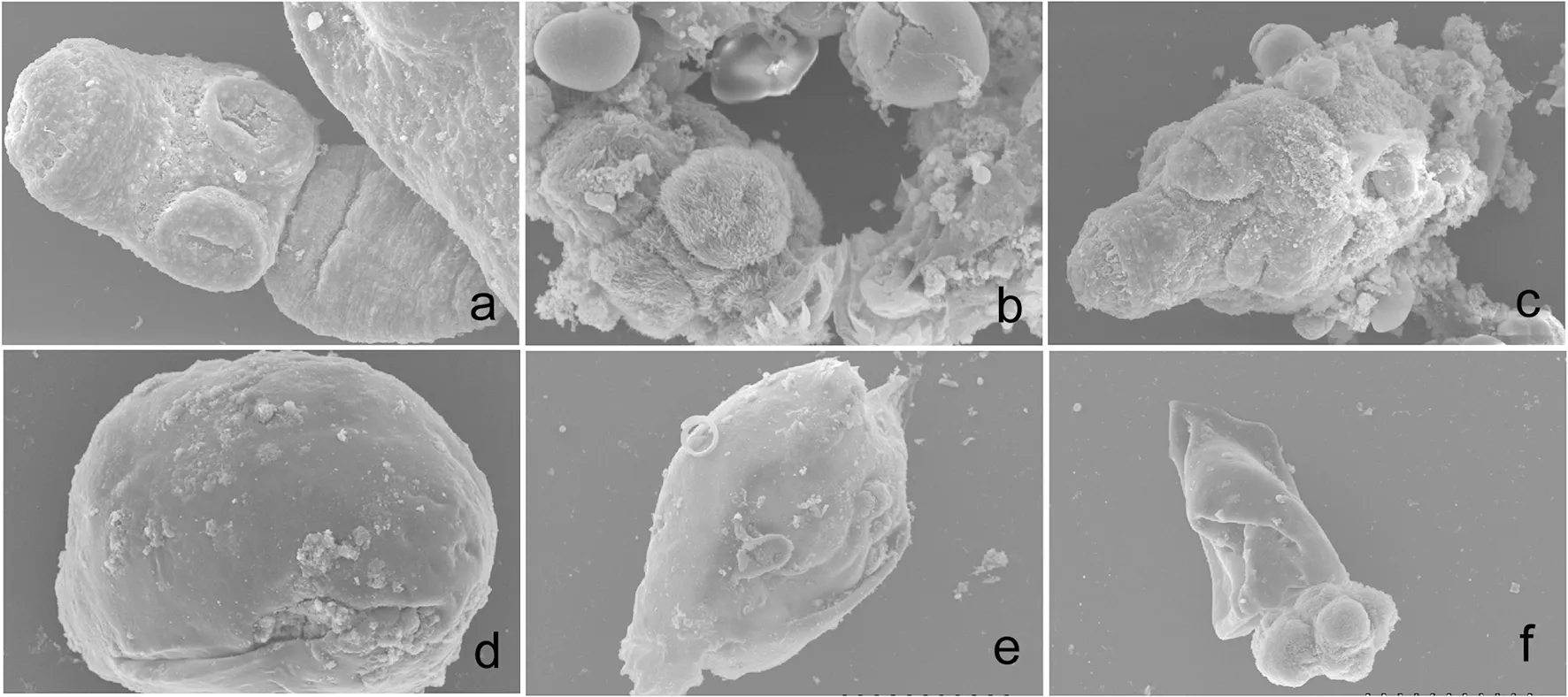
(a)空白对照组,(b)PLGA-PEG-PLGA组,(c)ABZSO/PLGA-PEG-PLGA(20 μg/mL)组,(d)ABZSO(40 μg/mL)组,(e)ABZSO/PLGA-PEG-PLGA(40 μg/mL)组,(f)ABZSO/PLGA-PEG-PLGA(80 μg/mL)组图2 经阿苯达唑亚砜温敏型原位凝胶处理后的泡球蚴原头节及小囊泡的扫描电镜观察图Fig.2 The ultrastructures of protoscoleces or small cysts treated with sulfoxide-loaded thermo-sensitive hydrogel under scanning electronical microscope
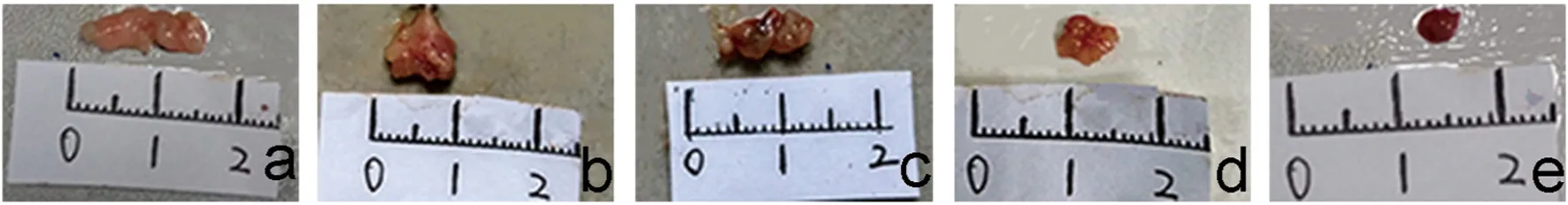
(a)空白对照组,(b)ABZSO/PLGA-PEG-PLGA(1 mg/mL)组,(c)ABZSO(20 μg/mL)组,(d)ABZSO/PLGA-PEG-PLGA(2 mg/mL)组,(e)ABZSO/PLGA-PEG-PLGA(4 mg/mL)组图3 各药物组治疗后大鼠体内泡球蚴大小图Fig.3 Sizes of alveolar hydatid cysts in the model rats after being treated
3 讨 论
泡球蚴病(AE)是一种对人体有严重危害的寄生虫病,其主要侵犯肝脏,呈浸润性生长[10],可扩散转移至其他器官,有恶性包虫病[11](malignant echinococcosis)或“虫癌”之称,且AE患者由于早期无明显临床症状和体征而失去最佳治疗机会,因而致死率极高[12]。目前,AE的治疗手段有手术切除、药物化疗、手术联合化疗。由于手术切除率低,易复发,故药物化疗成为术后主要的辅助治疗方式。
阿苯达唑(ABZ)作为WHO推荐的主要的抗泡球蚴病药物[13],主要抑制寄生虫对葡萄糖的吸收,导致虫体糖原耗竭,或抑制延胡索酸还原酶系统,阻碍ATP的产生,使寄生虫无法存活和繁殖。目前,在临床上已广泛应用,但由于阿苯达唑为难溶性药物,肠道吸收差,从而大大影响疗效,且长期服用该药会产生严重的不良反应,如头晕、恶心、白细胞减少等[14],为了克服上述问题,Xiao SH等[15]制得了ABZ 乳剂;Barrera MG等[16]制备ABZ微球;Palomares-Alonso F等[17]制备 了ABZ 固体分散体;Panwar P等[18]成功制备了ABZ脂质体,以上剂型虽提高了溶出度及生物利用度,但仍存在胃肠道内吸收差,体内血药浓度低难以达到有效治疗浓度、体内分布广泛、缺乏靶向性、制备工艺复杂等缺点[19]。因此,将阿苯达唑的主要活性物质-阿苯达唑亚砜制成缓释靶向制剂,从而能够大大提高疗效,降低毒副作用。
聚丙交酯乙交酯一聚乙二醇一聚丙交酯乙交酯(PLGA—PEG—PLGA)温敏型水凝胶是近年来研究较多的一种缓释制剂的药物载体,它是以液体状态局部注射于人体内部,在注射部位胶凝形成固态药物储库的一种给药系统,因其无毒、与亲水性及疏水性药物兼容和生物可降解等优点受到越来越多的人们的重视[20],故以PLGA-PEG-PLGA聚合物为药物载体,可将阿苯达唑亚砜制备成缓释靶向制剂-阿苯达唑亚砜温敏型原位凝胶。
本课题组在前期研究中已成功制备了阿苯达唑亚砜温敏型原位凝胶,并用傅里叶红外、核磁共振表征,体内药动学表明阿苯达唑亚砜温敏型原位凝胶比阿苯达唑亚砜普通制剂释放时间更长,且阿苯达唑亚砜温敏型原位凝胶对秀丽隐杆线虫的致死率显著高于阿苯达唑亚砜普通制剂[21],在此基础上,本文进一步研究阿苯达唑亚砜温敏型原位凝胶抗泡球蚴的效果。该研究中体外、动物体内实验的方法参考张睿等[10],其中,各药物组体外抗泡球蚴结果显示,PLGA-PEG-PLGA组中原头节的存活率相比空白对照组无差异,ABZSO/PLGA-PEG-PLGA(40 μg/mL)组原头节存活率低于ABZSO(40 μg/mL)组,且ABZSO/PLGA-PEG-PLGA(80 μg/mL)组原头节存活率最低。与此同时,扫描电镜观察原头节的结果显示,PLGA-PEG-PLGA组中和空白对照组原头节的结构均没有明显改变,ABZSO/PLGA-PEG-PLGA(80 μg/mL)组原头节的结构已严重破坏。
动物体内实验中,为了避免模型动物意外死亡,泡球蚴模型大鼠在建模30 d后便开始给予各组药物进行治疗,而此时泡球蚴尚未生长至足够大,再加上各组药物对其生长的抑制,待90 d剖检时各组模型大鼠体内泡球蚴均较少,故体内实验结果只能根据所剖检的所有泡球蚴的体积大小来初步地评价各治疗组对抗泡球蚴的效果。该结果显示,相比空白对照组,其余各治疗组的泡球蚴的生长均被抑制,且ABZSO/PLGA-PEG-PLGA(2 mg/mL)组的抑制作用强于ABZSO(2 mg/mL)组,而ABZSO/PLGA-PEG-PLGA(4 mg/mL)组的抑制作用最强。
综合体内外实验结果,可以初步判断阿苯达唑亚砜温敏型原位凝胶抗泡球蚴效果优于阿苯达唑亚砜普通制剂,且其浓度越高,效果越好,为使阿苯达唑亚砜温敏型原位凝胶能提供治疗泡球蚴病的新途径,并为临床应用提供科学依据,仍需进一步研究。
[1] Ammann RW, Hirsbrunner R, Cotting J, et al. Recurrence rate after discontinuation of long-term mebendazole therapy in alveolar echinococcosis (preliminary results)[J]. Am J Trop Med Hyg, 1990, 43(5): 506-515. DOI: 10.4269/ajtmh.1990.43.506
[2] Jiang, CP. Liver alveolar echinococcosis in the northwest: report of 15 patients and a collective analysis of 90 cases[J]. Chin Med J (Engl), 1981, 94(11): 771-778.
[3] Shahnazi M, Azadmehr A, Latifi R, et al.Invitroprotoscolicidal effects of various concentrati-ons of Ziziphora tenuior L. extract at different exposure times[J]. Avicenna J Phytomed, 2016,6(4):376-382.
[4] Wang S, An GS, Cheng DX. The experimental therapy against alveococcus in mice with immunoliposomecarried albendazole[J]. Acta Parasitol Med Entomol Sin, 1997,04:21-23. (in Chinese)
王述,安国顺,程道新. 免疫脂质体作为阿苯达唑载体治疗小鼠泡球蚴病实验研究[J]. 寄生虫与医学昆虫学报,1997,04:21-23.
[5] Saimot AG, Meulemans A, Cremieux AC, et al. Albendazole as a potential treatment for human hydatidosis[J]. Lancet,1983, 2(8351):652-656. DOI: 10.1016/S0140-6736(83)92533-3
[6] Adas G, Arikan S, Kemik O, et al. Use of albendazole sulfoxide, albendazole sulfone, and combined solutions as scolicidal agents on hydatid cysts (in vitro study)[J]. World J Gastroenterol, 2009, 15(1): 112-116. DOI: 10.3748/WJG.15.112
[7] Marriner SE, Morris DL, Dickson B, et al. Pharmacokinetics of albendazole in man[J]. Eur J Clin Pharmacol, 1986, 30(6): 705-708. DOI: 10.1007/BF00608219
[8] Lavasanifar A, Samuel J, Kwon GS. Micelles self-assembled frompoly(ethyleneoxide)-block-poly(N-hexyl stearate L-aspartamide) by a solvent evaporation method: effect on the solubilization and haemolytic activity of amphotericin B[J]. J Control Release, 2001, 77(1/2): 155-160.DOI: 10.1016/S0168-3659(01)00477-1
[9] Qiao M, Chen D, Ma X, et al. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels[J]. Int J Pharm, 2005, 294(1/2): 103-112. DOI: 10.1016/j. ijpharm.2005.01.017
[10] Zhang R, Jing T, Fu XY, et al. Effect of matrine and albendazole onEchinococcusmultilocularisinfection in mice[J]. Chin J Zoonoses, 2006,22(4): 342-346. (in Chinese)
张睿,景涛,傅宣英,等. 苦参碱和阿苯达唑治疗小鼠继发性泡球蚴病的疗效观察[J]. 中国人兽共患病学报, 2006, 22(4): 342-346.
[11] Zhao JF, Xia HY, Yu XF, et al. Effects of different culture media onEchinococcusmultilocularisprotoscoleces at different temperaturesinvitro[J]. Chin J Zoonoses, 2015, 31(3): 244-246. DOI: 10.3969/cjz.j.issn.1002-2694.2015.03.012(in Chinese)
赵阶峰,夏海洋,郁晓峰,等. 不同培养基及不同温度对体外培养泡球蚴原头节的影响[J]. 中国人兽共患病学报, 2015, 31(3): 244-246.
[12] Zhou HX, Chai SX, Craig PS, et al., Epidemiology of alveolar echinococcosis in Xinjiang Uygur autonomous region, China: a preliminary analysis[J]. Ann Trop Med Parasitol, 2000, 94(7): 715-729. DOI: 10.1017/S0031182003004153
[13] Xin Y, Zhang R. Research progress in drug treatment of hydatid disease[J]. Health Vocational Education, 2005, 23(18):127-130. DOI: 10. 3969/jissn.1671-1246.2005.18.088(in Chinese)
辛颖,张睿. 包虫病的药物治疗研究进展[J]. 卫生职业教育,2005, 23(18):127-130.
[14] Yin YL, Nie L, Jing T. Research progress in the treatment of hydatid disease[J]. Chin J Zoonoses, 2009, 25(5): 477-482.DOI:10.3969/j.issn.1002-2694.2009.05.020 (in Chinese)
殷祎隆,聂蕾,景涛. 包虫病治疗的药物研究进展[J]. 中国人兽共患病学报, 2009, 25(5):477-482.
[15] Xiao SH, You JQ, Wang MJ, et al. Augmented bioavailability and cysticidal activity of albendazole reformulatedin soybean emulsion in mice infected withEchinococcusgranulosusorEchinococcusmultilocularis[J]. Acta Trop, 2002, 82(1): 77-84. DOI:10.1016/S0001-706X(02)00027-X
[16] Barrera MG, Leonardi D, Bolmaro RE, et al.Invivoevaluation of albendazole microspheres for the treatment ofToxocaracanislarva migrans[J]. Eur J Pharm Biopharm, 2010. 75(3): 451-454. DOI: 10.1016/j.ejpb.2010.03.017
[17] Palomares-Alonso F, González CR, Bernad-Bernad MJ, et al. Two novel ternary albendazole-cyclodextrin-polymer systems: dissolution, bioavailability and efficacy againstTaeniacrassicepscysts[J]. Acta Trop, 2010, 113(1): 56-60. DOI: 10.1016/j.actatropica.2009.09.006
[18] Panwar P, Pandey B, Lakhera PC, et al. Preparation, characterization, andinvitrorelease study of albendazole-encapsulated nanosize liposomes[J]. Int J Nanomedicine, 2010, 5: 101-108. DOI: 10.2147/IJN.S8030
[19] Liang L, Zhang HY, Wang FQ, et al. Research progress of albendazole in the treatment of systemic helminth infection[J]. China Pharma, 2013, 17: 1618-1620. DOI:10.6039/j.issn.1001-0408.2013.17.31 (in Chinese)
梁莉,张鸿燕,王法琴,等. 阿苯达唑抗全身性蠕虫感染剂型的研究进展[J]. 中国药房, 2013, 17: 1618-1620.
[20] Wang J, Zhou QS, Yuan Y, et al. Synthesis and characterization of biodegradable polymer PLGA-PEG-PLGA[J]. J Shenyang Pharmaceutical Univ, 2005,22(5):348-351. (in Chinese)
王晶,周庆颂,袁悦,等. 生物降解聚合物PLGA-PEG-PLGA的合成及表征[J]. 沈阳药科大学学报,2005,22(5):348-351.
[21] Feng Y, Wang F, Zhang XW,et al. Characterizations and bioactivities of abendazole sulfoxide-loaded thermo-sensitive hydrogel[J]. Parasitol Res, 2016, 116(3): 921-928. DOI 10.1007/s00436-016-5365-y
Ye Bin, Email:yebina@sohu.com;Wang xin,Email:joneke55@163.com
Effectofabendazolesulfoxide-loadedthermo-sensitivehydrogelonalveolarhydatidcysts
FENG Yi1, WANG Fen1, LIU Xu-Nuo1, WANG Xin2, YE Bin1
(1.DepartmentofPathogenicBiology,ChongqingMedicalUniversity,Chongqing400016,China; (2.DepartmentofPathogenicBiology,ChengduMedicalCollege,Chengdu610083,China)
In order to explore the effect of abendazole sulfoxide-loaded thermo-sensitive hydrogel (ABZSO/PLGA-PEG-PLGA) on alveolar hydatid cysts, the viable protoscoleces incubatedinvitrowith ABZSO/PLGA-PEG-PLGA (20,40,80 μg/mL), ABZSO (40 μg/mL), PLGA-PEG-PLGA and the blank control, respectively, and the viable protoscoleces were counted. The morphological of the alveolar hydatid cysts or protoscoleces in each group were observed by scanning electron microscop(SEM). After the rats infected with alveolar hydatid cysts having been treated, the sizes of the alveolar hydatid cysts were observed. When the alveolar hydatid cysts incubated in different drug group in 18 days, the percentage of viable protoscoleces in ABZSO/PLGA-PEG-PLGA (40 μg/mL) group was lower than that of ABZSO (40 μg/mL) group. Results of SEM showed that the protoscoleces in the ABZSO/PLGA-PEG-PLGA (80 μg/mL) group were seriously damaged. Theinvivostudy demonstrated the anti-alveolar hydatid cysts efficacy of ABZSO/PLGA-PEG-PLGA (4 mg/mL) group was better than the other groups. The anti-alveolar hydatid cysts efficacy of ABZSO/PLGA-PEG-PLGA is evident.
Echinococcusmultilocularis; alveolar echinococcosis; abendazole sulfoxide; thermo-sensitive hydrogel
10.3969/j.issn.1002-2694.2017.08.005
国家自然科学基金(No. 30972567, 81672045)资助
叶 彬,Email:yebina@sohu.com 王 昕,Email:joneke55@163.com
1.重庆医科大学病原生物学教研室,重庆医科大学分子生物学与肿瘤研究中心,重庆 400016; 2.成都医学院病原生物学教研室,成都 610083
Supported by the National Natural Science Foundation of China (Nos.30972567, 81672045)
R383.3
:A
:1002-2694(2017)08-0690-04
2017-02-28编辑:梁小洁
