猪链球菌2型转录调控因子Rex原核表达及体外结合活性分析
2017-09-03祝昊丹何孔旺范红结
王 勇,祝昊丹,何孔旺,范红结
猪链球菌2型转录调控因子Rex原核表达及体外结合活性分析
王 勇1,2,3,祝昊丹1,3,何孔旺1,3,范红结2
目的克隆猪链球菌2型转录调控因子Rex的编码基因进行原核表达和纯化,对其进行生物信息学分析和体外结合活性测定。方法PCR扩增猪链球菌2型强毒株SS2-1的Rex基因编码区,将其克隆入pET28a质粒中,再将pET28a-Rex重组质粒转入大肠杆菌表达菌BL21(DE3)中,重组菌株经IPTG诱导后能表达出猪链球菌Rex蛋白;通过体外凝胶迁移实验( EMSA)对Rex蛋白与DNA的结合活性进行分析。结果成功地原核表达并纯化了Rex重组蛋白。Rex蛋白与自身启动子Prex特异性结合,高浓度的NADH抑制两者的结合活性,而NAD+对结合没有影响。结论通过体外结合试验发现Rex 是通过响应NADH/NAD+平衡来调控自身基因的表达。
猪链球菌;Rex;调控因子
猪链球菌(Streptococcussuis)是一种重要的人兽共患病原菌,可导致脑膜炎,关节炎,败血症等疾病。该病原菌造成仔猪大量死亡,给全球养猪业造成巨大的经济损失[1]。通过荚膜分型,有35个血清型,其中2型在患病猪和患病人群中分离率是最高的[2-3]。在亚洲地区,猪链球菌病是一种重要的公共卫生疾病,主要引起成人脑膜炎[4]。1998年和2005年在我国江苏和四川暴发了由猪链球菌2型引起的猪链球菌感染疫情,给公共卫生安全造成了极大的危害,受到国内外广泛关注[2,5]。
细菌在感染过程中,需要感知复杂多变的宿主体内环境,调节各种相关基因的表达,以达到在宿主体内生存、繁殖和致病的目的。转录调节因子是有机体应对动态环境的一个重要机制。Rex是一种广谱转录调节因子,在细菌的生存过程中起重要作用。首先在天蓝色链霉菌中发现转录调节因子Rex响应胞内NADH/NAD+平衡[6]。之后在粪肠球菌(Enterococcusfaecalis)、金黄色葡球菌(Staphylococcusaureus)、变形链球菌(Streptococcusmutans)、枯草芽孢杆菌(Bacillussubtilis)等的转录调控均有大量报道。猪链球菌中Rex的功能尚不清楚。
本研究对SS2强毒株SS2-1的转录调控因子Rex进行生物信息学分析,利用大肠杆菌原核表达系统对Rex蛋白进行体外表达和纯化,研究Rex蛋白与体外靶基因的结合活性,为后续深入研究Rex的功能奠定基础。
1 材料与方法
1.1 菌株、质粒和引物 所用的菌株、质粒及引物分别见表1和表2,引物由上海英潍捷基公司合成。

表1 菌株及质粒Tab.1 Bacterial strains and plasmids used in this study

表2 PCR扩增引物Tab.2 Primers used in this study
1. 2 主要试剂 PCR Mix和DNA Marker购于Vazyme公司,pMD19-T载体和DNA限制性内切酶购于TaKaRa公司;质粒提取试剂盒和胶回收试剂盒购于Axygen;THB和LB培养基购于美国BD公司;NAD+和NADH购于 Sigma公司;EMSA/Gel-shift结合缓冲液和上样缓冲液购于碧云天生物公司。
1.3Rex基因克隆和生物信息学分析 以SS2-1基因为模板,设计引物Rex-F/Rex-R,利用Prime STAR HS DNA聚合酶进行PCR扩增。PCR扩增程序为:94 ℃ 2 min,98 ℃ 15 s,55 ℃ 30s,72 ℃ 1 min,30 个循环,72 ℃ 5 min。电泳检测。回收目的片段。将目的片段回收产物与pMD19-T载体进行连接,转化到感受态细胞DH5α,挑取阳性克隆测序。使用EditSeq翻译成氨基酸序列,用Blastp和ClustalW等生物信息学工具对Rex氨基酸序列进行分析,并用ESPript 3.0 对ClustalW对比结果进行二级结构分析。
1.4 表达质粒的构建与鉴定 将含有 pET28a质粒的宿主菌DH5α单菌落接种至LB液体(含卡那霉素50 μg/mL)中,37 ℃过夜培养。按质粒提取试剂盒说明书抽提质粒DNA,以BamH I、XhoI进行双酶切,电泳回收线性化的质粒DNA。将质粒双酶切回收产物与双酶切的PCR产物进行连接,转化到感受态细胞DH5α,经PCR和双酶切鉴定后,将重组表达质粒pET28a-Rex转化进表达宿主BL21(DE3),挑取阳性克隆测序。
1.5 重组蛋白质的诱导表达与纯化 将含重组质粒pET28a-REX的大肠杆菌BL21 (DE3) 接种LB液体,37 ℃摇振培养3~4 h,至 OD600值为0.4~0.6时,加入IPTG至终浓度1 mmol/L,继续剧烈摇振培养3~4 h。离心去上清,于沉淀中加 SDS-PAGE上样缓冲液混匀后煮沸10 min,进行SDS-PAGE。将重组菌扩大培养并经 IPTG 诱导表达,离心收集菌体,PBS 重悬后冰浴超声破碎菌体,离心后的上清过滤,用GE Healthcare公司的His-Tag亲和层析柱纯化重组蛋白质。
1.6 凝胶阻滞分析(Electrophoresis mobility shift assay,EMSA) Rex与启动子DNA体外结合活性。
1.6.1 Rex与启动子DNA体外结合 EMSA实验:PCR扩增Rex基因启动子区并对产物纯化回收。反应体系(10 μL):蛋白 1 μL,DNA 1 μL,5×Binding buffer 2 μL,H2O26 μL;30 ℃水浴20 min。在反应样品中1 μL 10×Loading buffer,将样品加至6%变性聚丙烯酰胺凝胶中进行电泳。将电泳完毕取下的凝胶放入0.5 μg/mL EB溶液中染色15 min后置于凝胶成像系统中观察。
1.6.2 NADH和NAD+对Rex与特异性DNA片段结合活性的影响 按方法1.6.1研究NADH和NAD+对Rex与特异性DNA片段结合活性的影响,结合反应进行20 min后,在结合反应样品中分别添加不同浓度(0、5、10和50 mmol/L)的NADH和NAD+继续反应15 min,染色观察。
2 结 果
2.1Rex生物信息学分析 SS2-1的Rex蛋白的开放阅读框ORF由639个核苷酸组成,编码213个氨基酸,预测分子量为24 kDa。通过blastp 比对后,结果发现SS2-1 Rex蛋白与金黄色葡球菌、粪肠球菌、马链球菌兽疫亚种、无乳链球菌、化脓链球菌、变形链球菌和肺炎链球菌中的Rex家族蛋白的氨基酸序列分别具有44.7%、51.0%、71.9%、72.4%、73.8%、76.7%和78.7%的一致性。 以无乳链球菌的Rex蛋白晶体结构Protein data bank(PDB)为模型,使用ClustalW软件和ESPript 3.0对其同源蛋白进行多重序列比对和二级结构分析。N-端是特异的DNA结合位点,以及1个可结合DNA靶序列的螺旋-转角-螺旋(Helix-turn-helix)基序,而该部分序列在Rex蛋白家族成员中非常保守(图1)。结合NAD(H)的C-端有一个Rossmann折叠,这个折叠由典型的2个β-α-β-α-β结构单元系列组成,通过α-螺旋,它们一同形成了一个平行的β-折叠,这是在依赖NAD(H)脱氢酶(如乳酸脱氢酶)中的典型结构特征。
2.2 重组表达质粒鉴定Rex基因PCR扩增后,经双酶切、纯化,定向克隆到表达载体 pET28a中,转化到大肠杆菌 DH5α。挑取阳性克隆提取质粒,图2为重组表达质粒经BamH I和XhoⅠ双酶切鉴定结果,这表明目的片段已成功插入到表达质粒中。
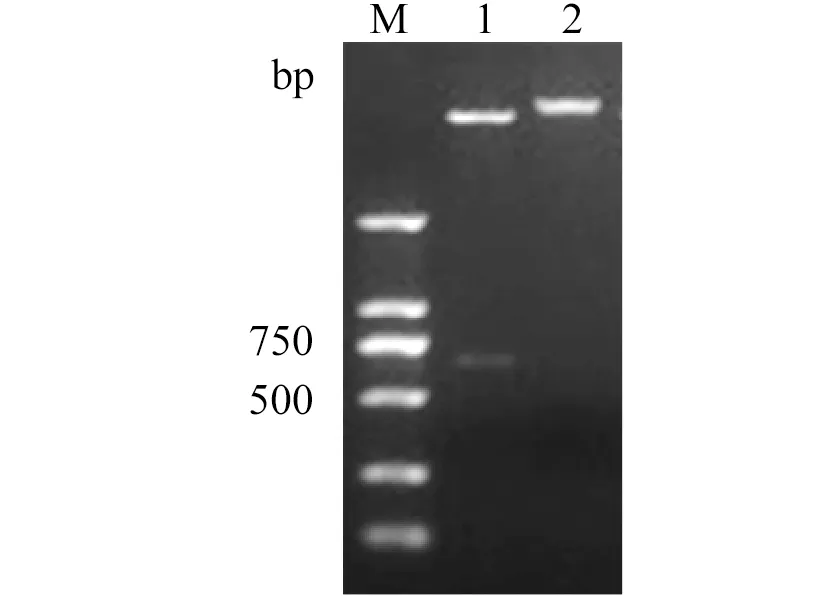
1: BamH I/Xho I double restriction enzymes
2.3 SDS-PAGE分析和Western blotting鉴定 SDS-PAGE分析结果表明,含重组表达质粒pET28a-Rex的E.coliBL21经IPTG诱导后在27 kDa左右处有1条明显的蛋白条带,分子量大小与预期一致(图3-A)。利用His亲和层析柱对表达产物进行纯化,将纯化蛋白用12% SDS-PAGE方法进行蛋白电泳,转印后,以His-Tag单克隆抗体为一抗进行Western blotting鉴定分析(图3-B)。

A: SDS-PAGE analysis of the purification.1:Non-induced pET28a/BL21, 2:Induced pET28a/BL21,3:Non-induced pET28a-Rex/BL21,4:Induced pET28a-Rex/BL21,5:Induced pET28a-Rex/BL21 Insoluble fraction, 6:Induced pET28a-Rex/BL21 Soluble fraction. B:Western blot with monoclonal antibody against His-tag. 1: rSsRex图3 SDS-PAGE 分析和Western blotting鉴定Fig.3 Recombinant protein by SDS-PAGE and Western blotting

图1 Rex同源蛋白的多重序列比对和结构分析Fig.1 Structure-based multiple sequence alignment of Rex ortholog protein
2.4 凝胶阻滞分析(Electrophoresis mobility shift assay,EMSA) Rex与启动子DNA体外结合活性
2.4.1 Rex与启动子DNA体外结合 EMSA实验结果证实Rex蛋白能与其自身启动子序列(Prex)特异性的结合,而非特异性DNA与Rex蛋白不发生作用(图4 )。 随着Rex蛋白浓度的增加 (从0 ng递增到500ng),结合的DNA越多,游离的DNA片段越少(图5 ),初步说明Rex蛋白能调控自身的转录,且随着Rex蛋白增多,结合的Prex也越多。
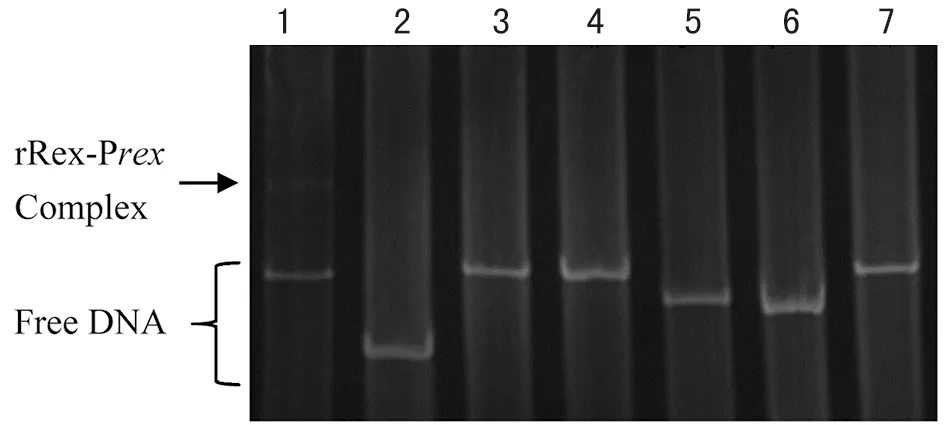
1:Prex; 2,3,4,5,6,7:ive pieces of unspecific DNA; and Rex protein,respectively图4 胞外Rex蛋白与特异性DNA的结合Fig.4 In vitro binding of protein Rex with specific DNA oligo

图5 胞外Rex蛋白与Prex的结合活性Fig.5 In vitro binding activity between protein Rex and Prex
2.4.2 NADH和NAD+对Rex与特异性DNA片段结合活性的影响 竞争试验结果表明NADH抑制Rex蛋白与自身启动子序列Prex的结合,且随着浓度的增加抑制效果越强(图6-A);NAD+则不影响两者的结合(图6-B),与在变形链球菌中报道的研究结果相一致[8]。

图6 NADH和NAD+对Rex与特异性DNA片段结合活性的影响Fig.6 The effect of NADH and NAD+ on specific DNA oligo binding activity of Rex
3 讨 论
细菌通过监测代谢产物或特定化合物在细胞内氧化还原状态产生相应的信号,通过诱导调节蛋白或酶的构象变化等方式最终作出生物反应[11]。在天蓝色链霉菌和枯草芽孢杆菌的研究中,发现了一种称为Rex的新型转录调节因子,能直接响应胞内NADH/NAD+平衡变化。在枯草芽孢杆菌中,当有氧呼吸过程中缺氧时,NADH浓度增加,Rex抑制的基因转录被激活,这使具有更高氧气亲和力细胞色素bd和乳酸脱氢酶的形成增加,以保证氧的有效利用和多余的NADH的循环利用。在金黄色葡萄球菌,Rex调节厌氧发酵和NAD+再生途径。在变形链球菌中Rex对生物被膜形成和氧化应激起重要作用。
通过对强毒株SS2-1基因组中编码Rex蛋白的氨基酸序列进行序列比对分析,发现猪链球菌Rex蛋白与金黄色葡萄球菌、粪肠球菌、马链球菌兽疫亚种、无乳链球菌、化脓链球菌、变形链球菌和肺炎链球菌中的Rex家族蛋白的氨基酸序列高度一致;结构域分析发现Rex家族蛋白的N端都具有DNA结合蛋白中常见的螺旋-转角-螺旋(Helix-turn-helix)基序,且非常保守(图1),保证了Rex蛋白能够结合特异性DNA序列从而调控靶基因的表达,提示猪链球菌Rex作为Rex调控蛋白家族成员的一员,具有其共同的结构特征和类似的调控机制。
利用大肠杆菌原核表达系统成功表达并纯化了强毒株SS2-1的Rex蛋白。体外EMSA实验证实了Rex蛋白对自身启动子序列Prex具有直接的结合活性,说明在猪链球菌中Rex蛋白可直接作用于自身基因启动子区从而直接调控自身的转录。此外,EMSA实验还表明NADH和NAD+都能结合Rex蛋白,但只有NADH能使Rex失去对Prex的亲和力,而 NAD+对结合没有影响,即NADH和NAD+竞争结合Rex,提示在猪链球菌中Rex发挥着氧化还原调控作用。该结果为我们进一步研究Rex的功能奠定了基础。
[1] Goyette DG, Auger JP, Xu J, et al.Streptococcussuis, an important pig pathogen and emerging zoonotic agent-an update on the worldwide distribution based on serotyping and sequence typing [J]. Emerg Microbes Infect, 2014, 3(6): e45. DOI: 10.1038/emi.2014.45
[2] Feng Y, Zhang H, Wu Z, et al.Streptococcussuisinfection: an emerging/reemerging challenge of bacterial infectious diseases [J]. Virulence, 2014,5(4):477-497. DOI: 10.4161/viru.28595
[3] Liu HZ, Yuan XM. Research advances in clinical laboratory diagnosis ofStreptococcussuisinfection[J]. Chin J Zoonoses,2016,32(5):490-493. DOI: 10.3969/j.issn.1002-2694.2016.05.001
刘海珠,袁晓明.人猪链球菌感染的临床实验室诊断研究进展[J].中国人兽共患病学报, 2016,32(5):490-493.
[4] Gong G, Yi XCM, Luo RB,et al. Isolation and identification of strain SS and antibiotic resistance in Tibet pig[J]. Chin J Zoonoses, 2016,32(11):987-990. DOI: 10.3969/j.issn.1002-2694.2016.011.008(in Chinese)
贡嘎,以西措姆,罗润波.藏猪链球菌的分离鉴定及耐药性研究[J].中国人兽共患病学报, 2016,32(11):987-990.
[5] Tang J, Wang C, Feng Y, et al. Streptococcal toxic shock syndrome caused byStreptococcussuisserotype 2 [J]. PLoS Med, 2006, 3: e151. DOI: 10. 1371/journal. pemed. 0030151
[6] Brekasis D, Paget M S. A novel sensor of NADH/NAD+redox poise inStreptomycescoelicolorA3(2) [J]. EMBO J, 2003,22(18):4856-4865. DOI: 10.1093/emboj/cdg453
[7] Wang E, Bauer MC, Rogstam A, et al. Structure and functional properties of theBacillussubtilistranscriptional repressor Rex[J]. Mol Microbiol,2008, 69:466-478. DOI:10.1111/j.1365-2958.2008.06295.x
ProkaryoticexpressionofRextranscriptionregulatorinStreptococcussuis2andinvitrobindingassay
WANG yong1,2,3,ZHU Hao-dan1,3,HE Kong-wang1,3,FAN Hong-jie2
(1.InstituteofVeterinaryResearch,JiangsuAcademyofAgriculturalSciences,KeyLaboratoryofEngineeringResearchofVeterinaryBio-products,MinistryofAgriculture,Nanjing210014,China; 2.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China; 3.KeyLabofFoodQualityandSafetyofJiangsuProvince-StateKeyLaboratoryBreedingBase,Nanjing210014,China)
We cloned and prokaryoticly expressed the gene encoding Redox regulator(Rex)ofStreptococcussuisserotype 2 and analyzed biological information andinvitrobinding activity. The encodingRexgene of SS2-1 strain was amplified by PCR with the designed primers, and then cloned into prokaryotic expression plasmid pET28a. The recombinant plasmid pET28a-Rex was transformed intoE.coliBL21. After induced expression by IPTG, the Rex protein was obtained. The binding activity of Rex protein and DNA was analyzed by gel mobility shift assay (EMSA)invitro. Purification of recombinant protein Rex was successfully expressed. The presence of NAD+did not have major effect on mobility shift, but addition of NADH almost abolished such a binding activity. Byinvitrobinding assay, Rex was found to regulate the expression of Prex in response to NADH/NAD+equilibrium.
Streptococcussuis; Rex; transcriptional regulator
10.3969/j.issn.1002-2694.2017.08.003
国家转基因生物新品种培育重大专项子课题(No.2014ZX0800946B-002);国家公益性行业科研专项(No.201303041)
何孔旺,Email:kwh2003@263.net
1.江苏省农业科学院兽医研究所·农业部兽用生物制品工程技术重点实验室,南京 210014; 2.南京农业大学动物医学院,南京 210095; 3.江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,南京 210014
Supported by the National Genetically Modified Organisms Breeding Major Projects of China(No.2014ZX0800946B-002)and the Special Fund for Agro-scientific Research in the Public Interest(No.201303041) Corresponding author: He Kong-wang, Email: kwh2003@263.net
R373.1
:A
:1002-2694(2017)08-0680-05
2016-11-25编辑:张智芳
