miR⁃608在成釉细胞瘤中的表达及意义
2017-09-03陈井阳钟鸣沈文静刘洁
陈井阳,钟鸣,沈文静,刘洁
(中国医科大学1.基础医学院生物化学与分子生物学教研室,沈阳 110122;2.口腔医学院口腔组织病理学教研室,沈阳 110002;3.附属第一医院妇科,沈阳 110001;4.科学实验中心,沈阳 110122)
miR⁃608在成釉细胞瘤中的表达及意义
陈井阳1,钟鸣2,沈文静3,刘洁4
(中国医科大学1.基础医学院生物化学与分子生物学教研室,沈阳 110122;2.口腔医学院口腔组织病理学教研室,沈阳 110002;3.附属第一医院妇科,沈阳 110001;4.科学实验中心,沈阳 110122)
目的研究miR-608在成釉细胞瘤(AB)中的表达及意义。方法利用实时茎环定量PCR方法检测miR-608在26例人成釉细胞瘤(AB组)及17例瘤旁组织(对照组)中的表达水平,比较miR-608在AB组与对照组,原发AB组与复发AB组,以及AB不同临床病理特征的组间差异。结果AB中miR-608表达水平显著下降,差异有统计学意义(P<0.05);复发组miR-608的相对表达水平显著降低,差异有统计学意义(P<0.05)。miR-608表达水平在不同年龄、性别和病理分型患者中均无统计学差异(P>0.05)。结论人AB组织中miR-608表达水平显著下降,可能与该肿瘤的发生和复发相关。
成釉细胞瘤;微小核糖核酸608;实时茎环定量PCR;肿瘤复发
成釉细胞瘤(ameloblastom,AB)为口腔颌面部最常见的牙源性肿瘤,是一种具有局部侵袭和易复发特征的临界瘤[1]。由于其病因尚不明确,缺乏有效的治疗措施,目前多采用手术切除,严重影响患者的生存质量,给患者身心带来极大伤害。因此,阐明该肿瘤发生演进的关键机制,寻找新的预防措施和治疗途径具有重要意义。
微小RNA(microRNA,miRNA)是一类大小约22个核苷酸进化上高度保守的内源性非编码RNA,随着对其研究的深入,它和肿瘤发生发展的关系,及在肿瘤诊断和治疗方面潜在的应用价值引起了广泛的关注[2]。微小RNA 608(microRNA 608,miR-608)是近年来发现的在多种肿瘤中发挥抑癌作用的miRNA。经TargetScan生物信息软件预测其下游靶基因有表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞周期蛋白D1(cyclin D1)、肿瘤蛋白p53(tumor protein p53,TP53)、人β-连环素蛋白互作蛋白1(catenin beta interacting protein 1,CTNNBIP1)、多种整合素分子等。研究[3-6]表明,miR-608可显著抑制结肠癌细胞增殖、阻碍细胞周期进程和下调迁移能力,过表达miR-608可抑制肝癌细胞的增殖,miR-608可通过影响含半胱氨酸的天冬氨酸蛋白水解酶凋亡通路促进肺癌细胞调亡,并抑制细胞增殖,miR-608还可抑制胶质瘤细胞侵袭和迁移能力,但其在AB中的作用及机制尚未有明确报道。本研究通过茎环法定量PCR检测AB及癌旁对照组织中miR-608的表达,并探讨其意义。
1 材料与方法
1.1 标本来源
收集2014年1月至2016年12月中国医科大学附属口腔医院颌面外科手术切除的26例AB标本,作为AB组,按照复发情况又将其分为原发组(18例),复发组(8例)。AB组中男12例,女14例,年龄19~73岁,平均年龄43.44岁。按照病理分型分为实性/多囊型20例,其他型6例(包括外周型AB1例,单囊型5例)。17例瘤旁黏膜标本为对照组,其中男性8例,女性9例,年龄19~73岁,平均年龄46.17岁。患者术前未接受放化疗等辅助治疗,术后经病理证实诊断。标本采集均已告知患者及家属,并签署知情同意书,且经过医院伦理委员会审核通过。标本在液氮下速冻,然后置于-80℃冰箱保存。
1.2 主要试剂
Trizol购自美国Thermo Fisher公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)购自美国Amersco公司;逆转录试剂盒FastQuant RT Kit(with gDNA-ase)购自中国天根生化科技有限公司;定量PCR扩增试剂盒Real Star Green Fast Mixture购自中国康润生物有限公司;miR-608茎环及定量PCR引物、U6内参引物均由苏州泓迅生物科技有限公司合成。
1.3 茎环实时定量PCR
1.3.1 引物序列:利用DNAMAN软件设计茎环反转录引物和qPCR上下游引物,miR-608茎环反转录引物为5’-CTCAGCGGCTGTCGTGGACTGCGCGCTGCCGCTGAGACGGAGC-3’;上游引物为5’-GGTGGTGTTGGGATAGCTTCGT-3’,下游引物为5’-GGCTGTCGTGGACTGCG-3’;U6茎环反转录引物为5’-GGGCCATGCTAATCTTCTCTG-3’;上游引物为5’-TCGCTTCGGCAGCACATA-3’,下游引物为5’-GGGCCATGCTAATCTTCTCTG-3’。目的片段长度约60 bp,退火温度60°C。
1.3.2 逆转录合成cDNA:组织匀浆后按照Trizol说明书操作,提取总RNA,分光光度计测定浓度和纯度,-80℃保存。逆转录反应前将提取好的RNA从-80℃冰箱中取出,放在冰上溶解,待用。配置100 μmol/L各茎环原液,分别吸取1 μL至RNase-free水,使终体积为100 μL,则每个茎环的终浓度为1 μmol/L,混合茎环。首先在去除基因组DNA反应体系中加入Total RNA 1~2 μg、5×gDNA Buffer 2 μL、RNasefree水补充体积到10 μL,彻底混匀,简短离心,并置于42℃孵育3 min,迅速放在冰上放置。加入10× Fast RT Buffer 2 μL、RT Enzyme Mix 1 μL、茎环混合RT引物2 μL、RNase-free水补充总体积到10 μL配制成反转录体系混合物。将反转录反应中的混合物,加入基因组DNA去除步骤的反应液中,充分混匀。PCR反应条件为42°C 15 min,95°C 3 min,-20°C保存备用。
1.3.3 实时荧光定量PCR:使用2×Real Star Green Mixture配制反应混合物,将上述逆转录生成的cDNA 1 μL、Real Star Green Mixture(2×)10 μL、Primers 0.6 μL用PCR-grade水补充至20 μL,使用Roche LightCycler®96荧光定量PCR仪进行定量PCR。反应条件为95°C 5 min预变性,95°C 15 s、60°C 20 s、72°C 15 s,40个循环后采集荧光信号,溶解曲线由仪器自动设置。
1.3.4 结果分析:计算miR-608和内参U6经过3次重复实验、每例标本3个平行孔的平均循环阈值(Cycle threshold,Ct)值,应用U6对各实验组样品进行均一化校正(ΔCt),实验组和对照组的∆Ct=CtmiR-608-CtU6,miR-608相对内参基因的相对表达量用2-ΔCt计算;∆∆Ct=∆CtAB组-∆Ct对照组,实验组与对照组miR-608相对表达量差异倍数以2-ΔΔCt法计算。
1.4 统计学分析
2 结果
2.1 U6表达情况
U6溶解曲线为锐利的单峰,出峰位置正确,表明反应特异性好,结果可靠(图1B)。扩增曲线光滑,有明确的基线期、指数期和平台期,AB组U6的Ct值为15.82±0.75,对照组U6的Ct值为17.15±0.84,二者无统计学差异(图1A)(P>0.05)。
2.2 miR-608表达情况

图1 U6茎环实时定量PCR扩增曲线图及产物溶解曲线图Fig.1 The amplification curve and melting curve of U6 by stem⁃loop real⁃time PCR
miR-608溶解曲线没有杂峰,产物单一(图2B)。AB组miR-608表达水平显著下降,平均Ct值为25.98±1.03,对照组miR-608的Ct值为20.24± 0.76,二者比较有统计学差异(P<0.05)(图2A)。

图2 miR⁃608茎环实时定量PCR扩增曲线图及产物溶解曲线图Fig.2 Amplification and melting curves of miR⁃608 by stem⁃loop RT⁃PCR
2.3AB组和对照组miR-608表达水平比较
以对照组miR-608的平均Ct值为1,对照组miR-608表达相对值为1.13±0.12,AB组miR-608表达相对值为0.38±0.03,AB组miR-608表达水平明显降低,为对照组的33.73%,差异有统计学意义(P<0.05)。见图3。
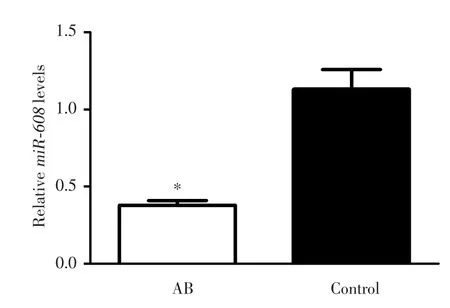
图3 AB组和对照组miR⁃608茎环实时定量PCR相对定量分析Fig.3 Relative quantitative analysis of miR⁃608 in the amelo⁃blastoma and control groups by stem⁃loop RT⁃PCR
2.4 原发组和复发组miR-608表达水平比较
以复发组miR-608的平均Ct值为1,复发组miR-608表达相对值为1.03±0.05,原发组miR-608表达相对值为2.07±0.14,复发组miR-608表达水平显著降低,为原发组的48.89%,差异有统计学意义(P<0.05)。见图4。

图4 原发组和复发组miR⁃608茎环实时PCR定量结果分析Fig.4 Analysis of miR⁃608 in the primary and recurrent amelo⁃blastoma groups by stem⁃loop RT⁃PCR
2.5 miR-608表达与AB临床病理特征
不同年龄、性别和病理分型患者miR-608表达水平均无统计学差异(P>0.05),见表1。
3 讨论
Sonic Hedgehog(SHH)信号通路是调控胚胎发育和胚胎形成后细胞生长和分化的关键信号通路,它受靶细胞膜上2种受体 Patched(PTCH)和Smoothened(SMO)控制[7]。近年来研究[8-9]发现,该信号通路在牙齿早期发育和牙源性肿瘤形成中发挥重要作用。自分泌刺激增殖和SHH信号通路抗凋亡作用在AB发生中起关键作用[10]。SHH通路上的多种信号分子,如PTCH1、SMO、Gli 1、Gli 2、Gli 3均在AB中高表达,并和肿瘤上皮增殖相关[11]。miR-608位于10号染色体长臂的第2区3号带第3号亚带,在软骨细胞中,SHH表达水平和miR-608呈负相关,过表达miR-608或miR-602可抑制SHHmRNA和蛋白表达水平[12]。在AB中,SMO基因与AB等牙源性肿瘤的发生密切相关,但具体突变位点和意义需要更多的研究证实。由此可见,miR-608可调控SHH,SMO等基因参与成牙组织异常和牙源性肿瘤[13]。

表1 不同临床病理特征AB中miR⁃608的表达Tab.1 miR⁃608 expression levels and clinicopathological fea⁃tures of ameloblastoma
miR-608自身作为抑癌性miRNA,通过抑制其下游靶基因参与肿瘤诊断和治疗,在肝癌、肺癌、胶质瘤等多种肿瘤中发挥作用[3-5]。位于成熟miR-608序列上的单核苷酸多态性(single nucleotide polymorphism,SNP)rs4919510 C>G可降低miR-608与上述癌基因的结合能力,可能是一个功能性SNP[14-16],研究[17-21]表明其和乳腺癌、膀胱癌、结直肠癌、肝癌、肾癌、脊索瘤等发生发展密切相关。本研究通过茎环定量PCR的方法检测了AB组和对照组中miR-608的表达,并比较miR-608在AB组与对照组,原发AB组与复发AB组,以及AB不同临床病理特征的组间差异,结果发现miR-608在AB中表达明显降低,原发AB组高于复发AB组,差异有统计学意义(P<0.05)。miR-608可以抑制细胞周期调控相关蛋白的表达,在AB中其表达下降,从而促进细胞增殖和AB发生。本研究结果可能为成釉细胞瘤早期诊断、治疗和预防提供生物标志物和作用靶点。由于本研究的临床样本数量有限,从现有标本的数据分析中得出的结果,尚不能支持miR-608表达水平的高低与AB的病理学分型存在显著的相关性,有待扩大样本,进行更深入的探讨。下一步还将针对miR-608SNP位点和AB发生发展的关系及下游的靶基因功能进行研究。
[1]BILODEAU EA,COLLINS BM.Odontogenic cysts and neoplasms[J].Surg Pathol Clin,2017,10(1):177-222.DOI:10.1016/j. path.2016.10.006.
[2]VAN BEIJNUM JR,GIOVANNETTI E,POEL D,et al.miRNAs:micro-managers of anticancer combination therapies[J].Angiogenesis,2017,20(2):269-285.DOI:10.1007/s10456-017-9545-x.
[3]YANG H,LI Q,NIU J,et al.microRNA-342-5p and miR-608 inhibit colon cancer tumorigenesis by targeting NAA10[J].Oncotarget,2016,7(3):2709-2720.DOI:10.18632/oncotarget.6458.
[4]WANG K,LIANG Q,WEI L,et al.microRNA-608 acts as a prog-nostic marker and inhibits the cell proliferation in hepatocellular carcinoma by macrophage migration inhibitory factor[J].Tumour Biol,2016,37(3):3823-3830.DOI:10.1007/s13277-015-4213-5.[5]OTHMAN N,IN LL,HARIKRISHNA JA,et al.Bcl-xL silencing induces alterations in hsa-miR-608 expression and subsequent cell death in A549 and SK-LU1 human lung adenocarcinoma cells[J]. PLoS One,2013,8(12):e81735.DOI:10.1371/journal. pone.0081735.
[6]WANG Z,XUE Y,WANG P,et al.miR-608 inhibits the migration and invasion of glioma stem cells by targeting macrophage migration inhibitory factor[J].Oncol Rep,2016,35(5):2733-2742.DOI:10.3892/or.2016.4652.
[7]D’AMICO D,CANETTIERI G.Translating hedgehog in cancer:controlling protein synthesis[J].Trends Mol Med,2016,22(10):851-862.DOI:10.1016/j.molmed.2016.08.003
[8]GURGEL CA,BUIM ME,CARVALHO KC,et al.Transcriptional profiles SHH pathway genes in keratocystic odontogenic tumor andameloblastoma[J].J Oral Pathol Med,2014,43(8):619-626. DOI:10.1111/jop.12180.
[9]KANDA S,MITSUYASU T,NAKAO Y,et al.Anti-apoptotic role of the sonic hedgehog signaling pathway in the proliferation of ameloblastoma[J].Int J Oncol,2013,43(3):695-702.DOI:10.3892/ ijo.2013.2010.
[10]MISHRA P,PANDA A,BANDYOPADHYAY A,et al.Sonic hedgehog signalling pathway and ameloblastoma-a review[J].J Clin Diagn Res,2015,9(11):ZE10-3.DOI:10.7860/JCDR/2015/ 15443.6750.
[11]张旭东,王洁.成釉细胞瘤分子病理机制的研究进展[J].现代口腔医学杂志,2017,2(31):97-100.
[12]AKHTAR N,MAKKI MS,HAQQI TM.microRNA-602 and microRNA-608 regulate sonic hedgehog expression via target sites inthe coding region in human chondrocytes[J].Arthritis Rheumatol,2015,67(2):423-434.DOI:10.1002/art.38952.
[13]DAVANIAN H,BALASIDDAIAH A,HEYMANN R,et al.Ameloblastoma RNA profiling uncovers a distinct non-coding RNA signature[J].Oncotarget,2017,8(3):4530-4542.DOI:10.18632/ oncotarget.13889.
[14]WEI WJ,WANG YL,LI DS,et al.Association study of single nucleotide polymorphisms in mature microRNAs and the risk ofthyroid tumor in a Chinese population.[J].Endocrine,2015,49(2):436-444.DOI:10.1007/s12020-014-0467-8.
[15]ZHANG Y,SCHIFF D,PARK D,et al.microRNA-608 and microRNA-34a regulate chordoma malignancy by targeting EGFR,Bcl-xL and MET[J].PLoS One,2014,9(3):e91546.DOI:10.1371/journal.pone.0091546.
[16]YING HQ,PENG HX,HE BS,et al.MiR-608,pre-miR-124-1 and pre-miR26a-1 polymorphisms modify susceptibility and recurrencefree survival in surgically resected CRC individuals[J].Oncotarget,2016,7(46):75865-75873.DOI:10.18632/oncotarget.12422.
[17]MORALES S,GULPPI F,GONZALEZ-HORMAZABAL P,et al. Association of single nucleotide polymorphisms in Pre-miR-27a,Pre-miR-196a2,Pre-miR-423,miR-608 and Pre-miR-618 with breast cancer susceptibility in a South American population[J]. BMC Genet,2016,17(1):109.DOI:10.1186/s12863-016-0415-0.
[18]SCLAFANI F,CHAU I,CUNNINGHAM D,et al.Sequence variation in mature microRNA-608 and benefit from neo-adjuvant treatment in locally advanced rectal cancer patients[J].Carcinogenesis,2016,37(9):852-857.DOI:10.1093/carcin/bgw073.
[19]LI D,ZHU G,DI H,et al.Associations between genetic variants located in mature microRNAs and risk of lung cancer[J].Oncotarget,2016,7(27):41715-41724.DOI:10.18632/oncotarget.9566.
[20]HASHEMI M,SANAEI S,REZAEI M,et al.miR-608 rs4919510 C>G polymorphism decreased the risk of breast cancer in an Iranian subpopulation[J].Exp Oncol,2016,38(1):57-59.
[21]MA XP,YU G,CHEN X,et al.MiR-608 rs4919510 is associated with prognosis of hepatocellular carcinoma[J].Tumour Biol,2016,37(7):9931-9942.DOI:10.1007/s13277-016-4897-1.
(编辑 北 辰)
The Expression and Significance of miR⁃608 in Ameloblastoma
CHEN Jingyang1,ZHONG Ming2,SHEN Wenjing3,LIU Jie4
(1.Department of Biochemistry and Molecular Biology,College of Basic Medical Science,China Medical University,Shenyang 110122,China;2.Department of Oral Pathology,College of Stomatology,China Medical University,Shenyang 110002,China;3.Department of Gynecologic,The First Hospital,China Medical University,Shenyang 110001,China;4.The Science Experiment Center,China Medical University,Shenyang 110122,China)
ObjectiveTo study the expression and significance ofmiR-608in ameloblastoma(AB).MethodsQuantitative stem-loop RTPCR was used to detect the expression ofmiR-608in 26 cases of human AB(AB group)and 17 cases of peritumoural tissues(control group).The differences inmiR-608levels between the control group and the AB groups,namely,primary AB and recurrent AB,were evaluated.In addition,miR-608levels in AB cases with different clinical and pathological characteristics were compared.ResultsThe expression level ofmiR-608in the AB group was significantly lower than that in the control group(P<0.05).Additionally,the relative expression level ofmiR-608in the primary AB group was significantly lower than that in the recurrent AB group(P<0.05).There were no significant differences between themiR-608expression levels with respet to age,gender,or pathological type(P>0.05).ConclusionsThe expression ofmiR-608in human AB tissue is significantly decreased,which may be related to the recurrence of the tumor.
ameloblastoma;miR-608;quantitative stem-loop RT-PCR;tumor recurrence
R780.2
A
0258-4646(2017)08-0724-05
10.12007/j.issn.0258-4646.2017.08.012
国家自然科学基金(81470758);辽宁省教育厅科学技术研究项目(LK201626);辽宁省大学生创新创业训练计划项目(201610159025)
陈井阳(1980-),男,技师,本科.
刘洁,E-mail:lj6152003@163.com
2017-05-24
网络出版时间:
