硫与汞反应条件的讨论
2017-09-01戴晓龙
戴晓龙
高一化学教学中,学生掌握了氧化还原反应的规律后,在继续认识硫的化学性质时,往往出现障碍,产生较多的困惑。比如,通过教材的学习,学生已经认识到氯气,氧气是活泼的非金属单质,与很多金属容易发生反应,且能生成高价的金属氯化物和高价氧化物。而硫是较活泼的非金属单质,也能与大多金属反应,反应方程式及反应条件如下:
2Na+S=Na2S 常温
Mg+S=MgS 加热
Zn+S=ZnS 加热
Fe+S=FeS 加热
Cu+S=Cu2S 加热
Hg+S=HgS常温
Ag+S=Ag2S 常温
问题:上面的反应中,金属单质由Na到Ag,活泼性依次减弱,它们分别与S反应时,较活泼的Mg Zn等需要加热才能反应,而Hg Ag不活泼金属却在常温下就能反应。这是什么原因?Hg和S在常温下真能反应吗?
针对这个问题,笔者查阅资料,从下面三个方面进行讨论。
一、从金属升华热和电离能的角度
不同金属与硫的反应难易程度,不但与金属原子失电子难易有关,还与金属单质的结构和状态有关。在上述金属与硫的化合中,金属失电子的能力是主要矛盾。金属活泼性愈大,失电子的倾向性也愈大,而每种金属原子在失电子时总会吸收能量的。在同一条件下,失去电子所需吸收的能量越小,反应越易进行。
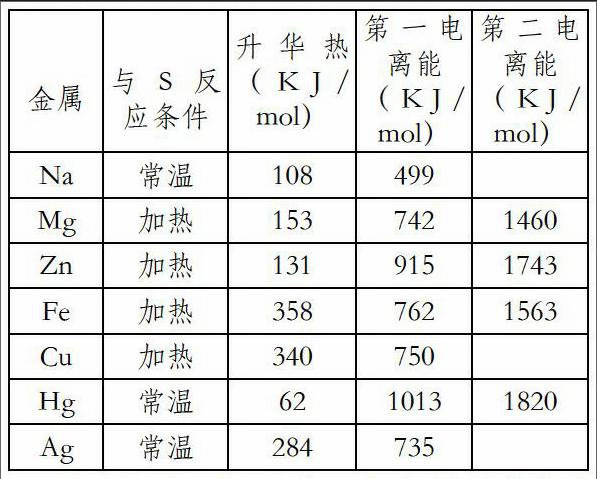
这些金属与硫反应,大多是固态下进行的,它们要化合成固态硫化物,首先要金属原子失电子。因此要考虑金属的升华热和电离能,相关金属的主要数据列表如下:
因此,Mg Zn Fe与S反应所需吸收的能量远大于Na Ag与S反应所需吸收的能量。所以 Mg Zn Fe与S在加热时才能反应,而Na常温就能反应,混合研磨时易爆炸,Ag常温下摩擦才易发生反应生成Ag2S,但是Hg虽常温下为液态,升华热很低62 KJ/mol,而其第一电离能1013 KJ/mol,第二电离能1820 KJ/mol,这比Zn Mg Fe的升华热和电离能之和还要高,由此得知,Hg和S在常温下很难发生反应。
二、从反应的热力学和动力学的角度
反应Hg(l)+S(s)=HgS(s) △H(298K)=-58.16 KJ/mol 从热力学上讲这个反应是可自发进行的。并根据该反应的吉布斯自由能 △rG(298K)=-50.6 KJ/mol 计算反应的平衡常数K=7.5×108 可知该反应进行的很彻底。但是热力学所研究的变量中,它只说明反应能不能进行,以及反应进行到什么程度为止,至于反应在什么时候发生,以怎样的速率进行,热力学无法预测。比如H2和O2化合生成H2O的反应趋势很大,热力学上该反应能发生,但实际将H2和O2室温下放到一个容器中,好几年也觉察不到水生成的痕迹。
对此我们还要考虑这个反应的动力学问题,由于Hg和S反应所需的活化能很大,可根据阿累尼乌斯公式算出该反应在室温下的反应速率非常小,两者可基本视为不反应。
三、从实际采用硫汞法制取HgS的角度
工业上所用的大量HgS,常采用硫磺和汞直接反应来制取,但二者反应的温度条件均在高温或加热。
方法1:先将硫磺加热熔化(硫的熔点113℃),再按比例加入汞进行搅拌,并加入少许水,生成黑色颗粒(HgS),然后焙烧于600℃升华,将升华物冷却,制得砖红色HgS产品。
方法2:将汞和硫磺在真空中封入耐高温的玻璃管中,用油浴加热到240℃以上,反应3小时,在冷却后加入浓硝酸(HgS在浓硝酸中不溶解也不反应),然后再加入二硫化碳,以除去未反应的汞和硫磺,这样即可得到硫化汞。
硫和汞反应,在方法1中温度为113℃以上,在方法2中温度为240℃以上,说明室温下二者很难反应。
综合以上三个方面,在金属与硫的反应中,只有很活泼的碱金属常温下可以和硫反应,而其它较活泼和不活泼的金属一般需加热才易与硫反应,尤其是Hg和S常溫下更不易反应。所以高一化学中介绍硫与汞的反应条件为常温,是不恰当的。
应用:实验室中水银洒落到地面上,为防止水银挥发使人中毒,常用硫磺去覆盖处理的方法是不可取的。而最理想的处理方法是,将大部分水银用纸板扫到一起,收集到瓶中盖紧盖子,残余的水银撒些锌粉覆盖,水银易溶解锌粉形成稳定的锌汞齐,有效避免水银蒸气对人体产生的伤害。打开窗户和门,通风3~4小时后,利用化学物理等实验手段对水银进行无害化处理。
参考文献:
[1]《无机化学》下册 第三版.无机化学教研室编.
[2]孙明芝.关于硫与金属反应所需条件的认识.教育实践与研究,1999年第10期.
[3]皇莆莹.《关于硫磺与汞的反应探讨》.湖州中学.endprint
