解淀粉芽孢杆菌LX—J1及其菌肥防治花生白绢病效果研究
2017-09-01杨娜李丽艳孙杉杉肖艳徐延平
杨娜+李丽艳+孙杉杉+肖艳+徐延平
摘要:研究了解淀粉芽孢杆菌LX-J1及其复合微生物肥料对花生白绢病的防治效果和对花生苗期生长的影响。采用平板对峙法,测定了LX-J1对强致病性花生白绢病菌的拮抗效果;在温室盆栽条件下,用LX-J1发酵原液及其复合微生物肥料处理了接种花生白绢病菌的培养基质,并测定了二者对白绢病菌的防效及苗期花生生长的影响。结果表明:LX-J1抑制白绢病菌菌丝生长,共培养第4d的抑菌率为75.6%;培养30d时,LX-J1菌肥处理菌核数量比对照减少了63.7%,恒重降低了60.2%;LX-J1及其菌肥300倍稀释处理基质对花生出苗和前期生长具有良好促生作用,出苗比对照分别提前2d和4d,出苗率分别提高6.1%和18.2%;LX-J1菌肥处理对花生白绢病防效优于LX-J1,防效高达83.36%,并可促进花生植株生长,利于增产。
关键词:解淀粉芽孢杆菌LX-J1;复合微生物肥料;花生白绢病;防效
中图分类号:S435
文献标识码:A 文章编号:16749944(2017)15007304
1 引言
花生(Arachis hypogaea)又名落花生,一年生草本植物,蝶形花科,起源于南美洲。中国是世界花生种植第一大国,2015年种植面积约462万hm2,总产量1680.5万t,均占世界总产量的40%以上。在中国,花生是四大油料经济作物之一,是我国主要出口创汇的农作物之一[1]。在花生栽培中,根腐病、青枯病、白绢病等花生病害严重制约着其产量和品质[2,3]。其中白绢病在世界范围内广泛分布[4],是一种真菌性土传病害,其无性世代病原菌为齐整小核菌(Sclerotium rolfsii Sau.),有性世代为罗氏阿太菌(Atheliarolfsii)[5,6]。该病菌寄主广,可侵染花生、白术、辣椒、油茶和桑树等多种草本作物或木本植物[7~9],对花生产量和品质的影响逐年加重,在高温高湿地区尤为严重[10]。仅美国佐治亚州,每年花生白绢病造成当地高达3680万美元的直接经济损失[11]。在中国,山东、河南、辽宁等花生主产区深受其不同程度的危害[4,12]。
通常对花生白绢病的防治以化学防控为主,但化学防治过程存在成本高、防效差、农药残留等问题,缺乏科学、成套的绿色防控技术。针对白绢病通过侧链型菌核渡过不利的环境条件等发生、传染特点,采用生防菌抑制菌核萌发、菌丝生长及菌核产生,是防治花生白绢病的重要途径[13~16]。Le等[17]分离出一株对花生白绢病具有良好拮抗作用的铜绿假单胞菌(Pseudomonas),Ganesan等[18]发现根际木霉(Trichoderma)对白绢病菌具有很好的拮抗作用,陆燕等[19]研究发现解淀粉芽孢杆菌41B-1菌株可作为防治花生白绢病的生防菌。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)在代谢过程中可产生多种抑菌的活性物质,是当前研究的热点。本研究使用的菌株LX-J1是杨娜等[20]从河南驻马店花生栽培土壤中分离得到,对多种真菌病害具有防治作用,并利用其研制出一种复合微生物肥料,实验测试了其拮抗花生白绢病菌的效果,旨在为花生白绢病的生物防治提供科学依据。
2 材料与方法
2.1 材料
2.1.1 植物材料
花生品种为冀花4号(市购)。
2.1.2 菌株
解淀粉芽孢杆菌LX-J1(保藏于中国微生物菌种保藏管理委员会普通微生物菌种保藏中心,保藏號为CGMCC NO.11263)由河北省农业生物技术工程技术研究中心分离并保存;花生白绢病菌菌株(齐整小核菌,Sclerotium rolfsii Sacc.)由河北省农业生物技术工程技术研究中心分离并保存。
2.1.3 复合微生物肥料
解淀粉芽孢杆菌LX-J1复合微生物肥料,其登记证号为微生物肥(2015)临字(2543)号,有效活菌数≥10亿/ml,N+P2O5+K2O=20.0%,剂型:液体。
2.1.4 培养基
牛肉膏蛋白胨培养基、PDA 固体培养基,配置参考方中达的方法[21]。
2.2 方法
2.2.1 平板对峙试验
从-80 ℃超低温冰箱保存的LX-J1甘油管中挑取一环,划线接种到牛肉膏蛋白胨固体培养基,30 ℃培养箱倒置培养20 h后,挑取平板上的单菌落,接种到牛肉膏蛋白胨液体培养基中,180 r/min、32 ℃摇床振荡培养18 h,备用;利用打孔器(直径=0.5 mm)在白绢病菌生长良好的平板上打孔,取菌块接种到PDA固体平板(平板直径= 9 cm,下同)培养基上,25 ℃培养3~4 d,备用。利用打孔器(直径=0.5 mm)在活化的白绢病菌平拍上打孔,取菌块接种到 PDA固体平板中央,然后在距离平板中央3.5 cm 处打孔,分别加入20 uL无菌牛肉膏蛋白胨液体培养基(对照)和活化的 LX-J1 (OD=1.5)菌液(处理:T-1),25℃培养7d内观察不同处理对白绢病菌菌丝生长的影响,每个处理3次重复,每个重复5个平板。在距离平板中央3.5 cm处分别涂抹20 uL无菌水(对照)和LX-J1 复合微生物肥料300倍稀释液(处理:T-2),然后利用打孔器(直径=0.5 mm)在活化的白绢病菌平拍上打孔,取菌块接种到 PDA固体平板中央,25 ℃培养1个月后观察不同处理对白绢病菌菌核产生的影响。设两个处理组,每个处理3次重复,每个重复5个平板。
2.2.2 拮抗效果测定
菌丝生长速率的测量:用直尺测量白绢病菌菌落中心到菌丝生长边缘的长度,即菌丝生长长度=测量值-0.25 mm;待对照白绢病菌长满平板时,按下式计算抑菌率(拮抗效果):菌落生长抑制率=(对照菌落净生长半径-处理菌落净生长半径)/对照菌落净生长半径×100%。菌核数量和干重的测定:对菌核计数,并把菌核在75 ℃烘干至恒重称重。
2.2.3 盆栽防治试验
试验在领先生物农业股份有限公司温室进行。带菌基质为本研究中心在常规栽培基质的基础上接入了高浓度的白绢病病菌,该基质在前期育苗中播种的花生全部感染了白绢病。试验时带菌基质混匀后与不同处理的制剂混匀,装入栽培盆,每盆装1000 g基质,用水量500 ml浇湿,次日播种。挑选饱满、健壮的花生种子,用75%的酒精消毒50 s,无菌水冲洗2~3次,再在1% NaClO中浸泡5 min,无菌水冲洗4~5次,播种于栽培盆,每盆播5~6粒。试验设3个处理:①50 mL清水(对照),②50 mL菌株LX-J1发酵液原液(处理a),③50 mL复合微生物肥料300倍稀释液(处理b)。每个处理设3个重复,每个重复8盆。
2.2.4 调查方法
于播种后第7 d开始观察出苗情况,主要调查出苗日期及出苗数。并于第20 d和30 d记录出苗和发病情况,发病程度全盆调查;白绢病调查是根据分级标准对发病情况进行记录,并计算病情指数及其防效。按程凯等[22]的方法调查菌液混合在基质中对花生苗期生长的影响。播种后第30 d,每个处理取25株测量株高、根长、地上部鲜重、地下部鲜重。
病情分级标准:0级:植株茎基部和主根均无病斑;1级:茎基部和主根上有1~3个病斑;3级:茎基部或主根上病斑较多,病斑面积占茎和根总面积的1/4~1/2;5級:茎基部及主根上病斑多且较大,病斑面积占茎基部和根总面积的1/2~3/4;7级:茎基部或主根上病斑连片,形成烧茎现象,但根系并未死亡;9级:根系坏死,植株地上部萎蔫或死亡。发病率%=(染病株数/调查总株数)×100%;病情指数 =[∑(各级病株数×相对级数值)](调查总叶数×9)×100;防治效果(%)= (病原菌对照病指-处理组病指)/病原菌对照病指 ×100。
2.2.5 数据分析
用SPSS18.0软件对本试验涉及的数据进行分析,用Excel 10作图。
3 结果与分析
3.1 LX-J1对白绢病菌生长的影响
平板对峙7 d培养结果表明,解淀粉芽孢杆菌LX-J1对白绢病菌菌丝生长的抑制作用显著(表1)。共培养7 d内,添加LX-J1菌液的处理组病菌菌丝生长速度比添加培养液的对照组慢。共培养第4 d,对照组的菌丝长满平板(菌落半径为4.5 cm),而对照组的菌落半径仅为1.1 cm,此时LX-J1对白绢病菌的抑菌率为75.6%。
3.2 LX-J1菌肥对白绢病菌核产生的影响
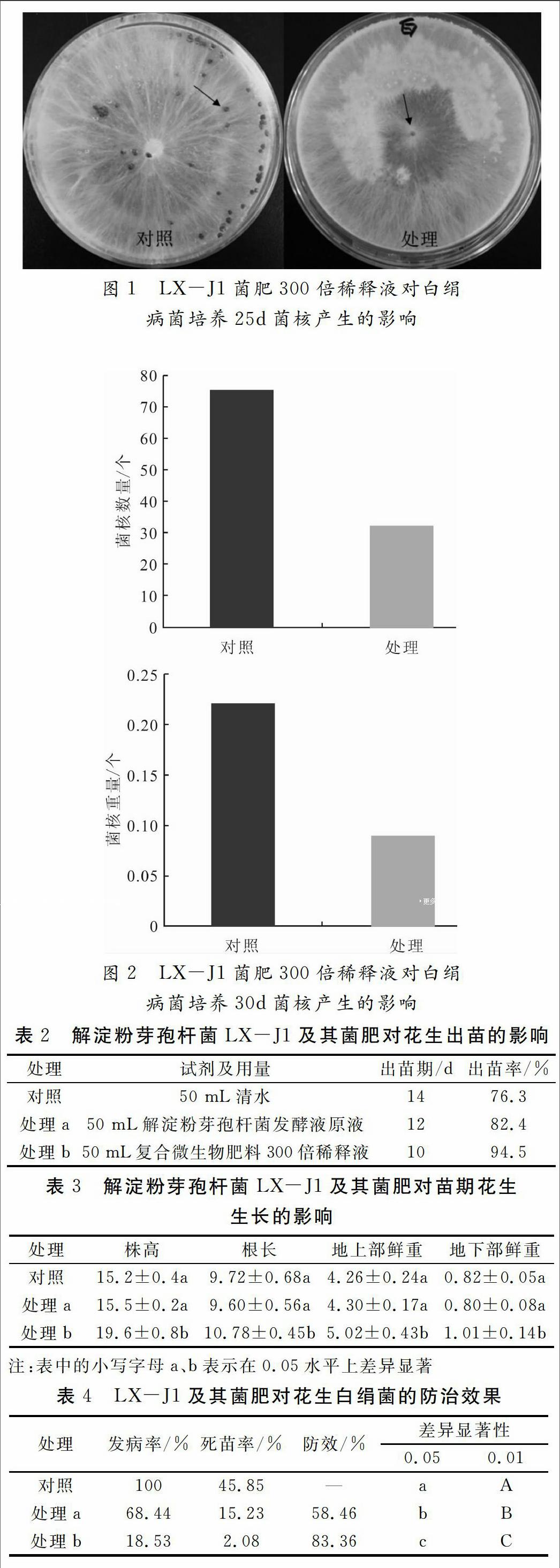
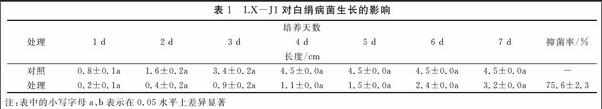
平板对峙30d培养结果表明,解淀粉芽孢杆菌LX-J1复合微生物肥料能显著抑制白绢病菌菌核的产生(图1、图2)。由图1可知,培养25d时,添加LX-J1复合微生物肥料的处理平板上菌核才产生菌核,晚于对照。由图2可知,培养30d时,添加LX-J1复合微生物肥料的处理平板上菌核数量比对照减少63.7%,恒重比对照降低了60.2%。
3.3 LX-J1及其菌肥对花生植株生长的影响
解淀粉芽孢杆菌LX-J1及其菌肥对花生出苗的影响结果见表2。由表2可知,相对于清水对照,LX-J1及其菌肥稀释300倍处理均可促使花生种子提早出苗,分别提前2 d和4 d,并提高花生出苗率,分别提高6.1%和18.2%。
LX-J1及其菌肥对苗期花生生长的影响结果见表3。由表3可知,花生植株生长30 d后,对照和处理b存在显著差异(P<0.05),而对照与处理a间差异不显著(P<0.05)。LX-J1复合微生物肥料300倍稀释液处理可提高苗期花生株高、根长、鲜重等农艺性状,利用植株健壮。处理b的株高、根长、总鲜重比对照分别提高4.4 cm、1.06 cm和0.95 g。
3.4 LX-J1及其菌肥对花生白绢病的防效
解淀粉芽孢杆菌LX-J1及其菌肥对花生白绢病的防治效果见表4。由表4可知,解淀粉芽孢杆菌LX-J1及其菌肥300倍稀释液对由花生白绢病病菌引起的病害具有良好的防控效果,差异显著(P<0.01)。效果最好的是复合微生物肥料300倍稀释液的处理,该处理对强致病性花生白绢病菌的防治效果高达83.36%,无死苗,而解淀粉芽孢杆菌LX-J1对花生白绢病菌的防治效果仅为58.46%,但其死苗率明显低于对照。表明解淀粉芽孢杆菌LX-J1及其菌肥300倍稀释液处理基质对花生白绢病菌均有防效,而复合微生物肥料防治效果更突出。
4 结果与讨论
解淀粉芽孢杆菌为革兰氏阳性菌株,与枯草芽孢杆菌(Bacillus subtilis)亲缘关系较近,多被制成芽孢类杀菌剂、生物有机肥、复合微生物肥料等生物制剂用于防治植物病害[23~25]。解淀粉芽孢杆菌复合微生物肥料是一种新一代生物制剂,具有促生、提高作物品质、安全性高、环境友好、不易诱导植物病原菌产生抗性等优点,是解决化学农药防治过程产生的诸多问题的有效途径。
基于解淀粉芽孢杆菌LX-J1,本研究开发了一种复合微生物肥料,并利用该菌肥进行基质处理防治花生白绢病试验,具有重要意义。研究结果表明,解淀粉芽孢杆菌LX-J1对平板培养的花生白绢病菌有强抑制性,抑制菌丝生长及菌核生成,进一步抑制真菌的扩散,这可能是解淀粉芽孢菌防治白绢病菌的机理之一,这与陆燕等[19]发现解淀粉芽孢杆菌41B-1发酵液抑制花生白绢病菌菌丝生长,降低菌核数量及重量的结果相一致。高效生防菌高度存活在根际土壤或定殖植物体内是显著降低病原菌数量[26],减轻病害发生的重要原因,是防治病害的前提。本研究采用的解淀粉芽孢杆菌LX-J1分离自花生连作种植田,能高效定殖在花生根系土壤及植株内部,对白绢病菌具有良好防效,这与Kennedy等和Shen等研究结果相一致[27,28]。本研究发现LX-J1复合微生物肥料对花生白绢病具有强抑制作用,防效达83.36%,优于单一利用LX-J1的防效。该现象产生的原因可能是复合微生物肥料促进花生生长,利于植株生长健壮,提高了作物综合抗病性。研究结果表明,解淀粉芽孢杆菌LX-J1是防治花生白绢病菌的优良菌株,基于其研制的菌肥防效突出,应用前景广阔。
参考文献:
[1]张智猛,胡文广,许婷婷,等.中国花生生产的发展与优势分析[J].花生学报,2005,34(3):6~10.
[2]姜永红.花生病虫害防治的重要性及优化策略探析[J].吉林农业,2014,(12):80~80.
[3]Yan H H,Zhang R Q,Du H F,et al.Rhizoctonia solani identified as the disease causing agent of peanut leaf rot in China[J].Plant Disease,2013,97(1):140.
[4]Branch W D,Brenneman T B. Field evaluation for the combination of white mould and tomato spotted wilt disease resistance among peanut genotypes[J].Crop Protection,2009,28(7):595~598.
[5]傅俊范,刘 波,周如军,等.辽宁花生白绢病病原鉴定及其生物学研究[J].中国油料作物学报,2014,36(5):635~640.
[6]Punja Z K,Adams G C.Influence of nutrition,environment,and the isolate,on basidiocarp formation,development,and structure in Athelia (sclerotium)rolfsii[J].Mycologia,1982,74(6):917~926.
[7]Punja Z K.Effects of calcium and nitrogen fertilizers,fungicides,and tillage practiceson incidence of Sclerotium rolfsii on processing carrots[J].Plant Disease,1986,70(9):819~824.
[8]Kwon J H,Cho H S,Shen S S,et al.The occurrence of sclerotium rot on white clover (Trifolium repens L.)caused by Sclerotium rolfsii in Korea[J].Australasian Plant Disease Notes,2013,8(1):89~91.
[9]Xu Z,Gleason M L,Mueller D S,et al.Overwintering of Sclerotium rolfsii and S.rolfsii var.delphinii in different latitudes of the United States[J].Plant Disease,2008,92(5):719~724.
[10]Punja Z K,Grogan R G.Hyphal interactions and antagonism among field isolates and single-basidiospore strains of Athelia(sclerotium)rolfsii[J].Phytopathology,1983,73(9):1279~1284.
[11]Franke M D,Brenneman T B,Stevenson K L,et al.Sensitivity of isolates of Sclerotium rolfsii from peanut in georgia to selected fungicides[J].Plant Disease,1998,82(5):578~583.
[12]楊广玲,刘 伟,王金信.花生白绢病的发生规律与综合防治[J].花生学报,2003,32(S1):425~426.
[13]ColeySmith J R,Cooke R C.Survival and germination of fungal sclerotia[J].Annual Review ofPhytopathology,2003,9(1):65~92.
[14]Bolton M D,Thomma B P H J,Nelson B D.Sclerotinia sclerotiorum( Lib.)de Bary:biology and molecular traits of a cosmopolitan pathogen[J].Molecular Plant Pathology,2006,7(1):1~16.
[15]Chet I,Henis Y,Mitchell R.Chemical composition of hyphal and sclerotial walls of Sclerotium rolfsii Sacc[J].Canadian Journal of Microbiology,1967,13(2):137~141.
[16]Chet I,Henis Y,Kislev N.Ultrastructure of sclerotia and hyphae of Sclerotium rolfsii Sacc[J].Journal of General Microbiology,1969,57(2):143~147.
[17]Le C N,Kruijt M,Raaijmakers J M.Involvement of phenazines and lipopeptides in interactions between Pseudomonas species and Sclerotium rolfsii,causal agent of stem rot disease on groundnut[J].Cytokine,2002,19(3):138~146.
[18]Ganesan S,KuppusamyR G,Sekar R.Integrated management of stem rot disease(Sclerotium rolfsii)of Groundnut (Arachis hypogaea L.)using Rhizobium and Trichoderma harzianum (ITCC-4572)[J].Turkish Journal of Agriculture&Forestry,2007,31(2):103~108.
[19]陸 燕,李 澄,陈志德,等.解淀粉芽孢杆菌41B-1对花生白绢病的生防效果[J].中国油料作物学报,2016,2003,32(S1):425~426.
[20]杨 娜,李丽艳,杜迎辉,等.一株解淀粉芽孢杆菌LX-J1及其用途[J].中国油料作物学报,2016.
[21]方中达.植病研究方法(第三版)[M].北京:中国农业出版社,1998.
[22]程 凯,江欢欢,沈 标,等.棉花黄萎病拮抗菌的筛选及其生物防治效果[J].植物营养与肥料学报,2011,17(1):166~174.
[23]Zhao Z Z,Wang Q S,Wang K M,et al.Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J].Bioresour Technol,2010,101(1):292~297.
[24]Yuan B,Wang Z,Qin S,et al.Study of the anti-sapstain fungus activity of Bacillus amyloliquefaciens CGMCC5569 associated with Ginkgo biloba and identification of its active components[J].Bioresour Technol,2012,114(2):536~541.
[25]王保通,陈 宏,申雪雪,等.解淀粉芽孢杆菌Ba168防治十字花科根肿病效果研究[J].陕西农业科学,2016,62(02):39~41.
[26]Chen L H,Huang X Q,Zhang F G,et al.Application of Trichoderma harzianum SQR-T037 bio-organic fertiliser significantly controls Fusarium wilt and affects the microbial communities of continuously cropped soil of cucumber[J].Journal of the Science of Food and Agriculture,2012,92(12):2465~2470.
[27]Kennedy A C.Bacterial diversity in agroecosystems[J].Agriculture Ecosystems & Environment,1999,74(99):65~76.
[28]Shen D.Microbial diversity and application of microbial products for agricultural purposes in China[J].Agriculture Ecosystems & Environment,1997,62(s2-3):237~245.
