粒细胞-巨噬细胞集落刺激因子转染对白血病细胞K562形态及增殖的影响
2017-08-30陈蓉常晋霞李雪璐彭丽娟朱红
陈蓉,常晋霞,李雪璐,彭丽娟,朱红
(川北医学院医学微生物学与免疫学教研室,四川南充 637000)
粒细胞-巨噬细胞集落刺激因子转染对白血病细胞K562形态及增殖的影响
陈蓉,常晋霞,李雪璐,彭丽娟,朱红
(川北医学院医学微生物学与免疫学教研室,四川南充 637000)
目的 观察重组PcDNA3.1-粒细胞-巨噬细胞集落刺激因子(GM-CSF)、外源性GM-CSF对髓系白血病细胞(K562)形态及增殖的影响。方法 将K562细胞分为4组,重组质粒组、外源性组、空质粒组细胞分别以重组PcDNA3.1-GM-CSF、外源性GM-CSF、PcDNA3.1空质粒转染,细胞对照组细胞未转染任何质粒,观察各组细胞形态学变化及细胞增殖情况。结果 光学显微镜下,细胞对照组、空质粒组及外源性组细胞形态相似,细胞着色呈深蓝色,细胞质和细胞核不易区分;重组质粒组细胞形态和其余3组明显不同,细胞质呈浅蓝色,细胞核呈淡粉红色,分界清楚,部分细胞内可见肾形、马蹄形细胞核。显微镜油镜下,细胞对照组、外源性组及空质粒组结果相似,细胞着色深,呈深蓝色,细胞内未见任何颗粒沉积;重组质粒组部分细胞着色呈深蓝色,部分细胞着色呈浅粉色,呈浅粉色的部分细胞内可见有斑点状甲臜颗粒沉积。与其余2组比较,重组质粒组第3、5、7、9天细胞增殖抑制率升高(P均<0.05);与空质粒组比较,外源性组第3、5、7天细胞增殖抑制率升高(P均<0.05)。结论 重组PcDNA3.1-GM-CSF及外源性GM-CSF均能使K562细胞形态发生改变、增殖受到抑制,作用强度随作用时间延长而增加,且重组PcDNA3.1-GM-CSF抑制作用强于外源性GM-CSF。
粒细胞-巨噬细胞集落刺激因子;白血病细胞;细胞形态;细胞增殖
粒细胞-巨噬细胞集落刺激因子(GM-CSF)是一种能调节造血祖细胞增殖、分化的细胞因子[1],亦可刺激巨噬系、红系、嗜酸系、粒系等多系造血细胞的前体细胞增殖和分化[2]。GM-CSF的生物学作用较为广泛,能增加巨噬细胞和单核细胞抗体依赖细胞介导细胞毒性作用,可调整机体免疫细胞对肿瘤细胞的攻击杀伤能力,具有抗肿瘤的作用[3]。研究[4~6]表明,GM-CSF在辅助治疗恶性肿瘤方面有其不可替代的作用。因GM-CSF在抗瘤治疗方面的优越性,使其受到基础研究者及临床工作者的广泛关注。本研究应用外源性GM-CSF及已构建的PcDNA3.1-GM-CSF真核表达质粒[7]转染髓系白血病细胞(K562),观察两者对细胞形态及增殖的影响,旨在为进一步探索GM-CSF治疗白血病提供理论依据。
1 材料与方法
1.1 质粒及主要试剂 重组质粒PcDNA3.1-GM-CSF(本研究团队自己构建);脂质体转染试剂(天根生化科技有限公司);K562细胞(NTCC典型培养物保藏中心-BioVector质粒载体菌种细胞基因保藏中心);人源性GM-CSF(美国派普泰克公司,用1640培养液配制,过滤除菌后-20 ℃保存);1640培养基、新生牛血清(塞默飞世尔科技公司);NBT染液(NBT 0.28 g加入生理盐水100 mL,滤器过滤,4 ℃保存);NBT培养液(正常人血清0.5 mL加入生理盐水0.3 mL和NBT染液0.6 mL)。
1.2 粒细胞-巨噬细胞集落刺激因子转染对K562细胞形态的影响观察 ① 光学显微镜下观察:常规复苏K562细胞,待细胞生长良好,用1640培养液配制K562细胞悬液,将K562细胞接种于24孔板中,每孔细胞数约5×104个。于细胞培养箱37 ℃、5%CO2环境下培养24 h,离心,去上清。将培养细胞分为4组,每组六孔。细胞对照组:只有K562细胞和细胞培养液,即只在该组细胞培养孔中加入含20%新生牛血清1640培养液500 μL,培养72 h。空质粒组:先配置脂质体-空质粒混合物(将2 μL脂质体转染试剂加入48 μL无血清无抗生素的1640培养液中),混匀,室温放置5 min,同时将2 μL的空质粒(0.5 μg/μL)和48 μL无血清无抗生素的1640培养液混匀,再将上述两种液体放在一起混匀,室温放置20 min。在每孔细胞培养孔中先加入400 μL的无血清的1640培养液,然后将脂质体-空质粒混合物逐滴加入孔中,每孔100 μL,轻轻摇动,使其均匀分布(方法来源于脂质体转染试剂盒使用说明),37 ℃、5%CO2环境下培养6 h后,离心,去上清,每孔加入500 μL含20%新生牛血清的1640培养液,在细胞培养箱中(37 ℃、5%CO2)培养72 h。重组质粒组:具体操作方法及质粒浓度同空质粒组,只是将转染的空质粒换成了重组质粒。外源性组:先在每孔细胞培养孔中加入含20%新生牛血清1640培养液400 μL,再在每孔中加入外源性GM-CSF 100 μL(800 ng/mL),轻轻摇动,混匀,在细胞培养箱中(37 ℃、5%CO2)培养72 h。分别收集各组培养细胞,离心,取沉淀细胞涂片于载玻片上,自然干燥,Wright-Giemsa染色,水洗,干后低、高倍镜镜检,观察各组细胞染色情况、形态及细胞核的变化,摄片保存。该实验重复3次。②显微镜油镜下观察:采用硝基四氮唑蓝还原试验(NBT还原试验)。常规复苏K562细胞,待细胞生长良好,用1640培养液配制K562细胞悬液,将K562细胞接种于24孔板中,每孔细胞数约5×104个。于细胞培养箱37 ℃、5%CO2培养24 h,离心,去上清。将培养细胞分为4组,每组六孔,分组及各组细胞处理方法同①。在细胞培养箱中37 ℃、5%CO2培养72 h。72 h后,分别收集各组细胞,离心,弃上清,取细胞沉淀0.1 mL和NBT培养液0.1 mL加入凹玻片孔中混匀,置湿盒37 ℃、20 min,置室温15 min,中间振动1次。取1滴混悬液于防脱载玻片一端推成薄片,空气中快速干燥。甲醇固定1 min,Wright-Giemsa染色,水洗,干后油镜镜检,观察细胞内是否有异常颗粒,摄片保存。该实验重复3次。
1.3 粒细胞-巨噬细胞集落刺激因子转染对K562细胞增殖的影响观察 按1.2方法采用脂质体转染试剂转染质粒方式,分别转染PcDNA3.1空质粒于K562细胞及重组质粒PcDNA3.1-GM-CSF于K562细胞,37 ℃、5%CO2培养72 h后,离心,去上清备用。用1640培养液分别配制K562细胞悬液(分3种细胞配制:K562细胞、转染PcDNA3.1空质粒细胞、转染重组质粒PcDNA3.1-GM-CSF细胞)。实验分组如下:①细胞对照组:单纯K562细胞;②空质粒组:细胞转染PcDNA3.1空质粒;③重组质粒组:细胞转染重组质粒PcDNA3.1-GM-CSF;④外源性组:细胞转染外源性GM-CSF。将上述细胞悬液按上述分组分别接种于96孔板中,使每孔含5×104个细胞,每组设3个平行孔。用细胞培养液将每孔终体积补足为200 μL,置37 ℃、5%CO2培养箱中培养72 h,离心,弃上清,每孔加入MTT溶液(5 mg/mL)20 μL和1640培养液180 μL,37 ℃继续孵育4 h终止培养。离心,弃去培养上清,每孔加入150 μL二甲基亚砜,低速震摇10 min,酶标仪测定570 nm吸光度OD值。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。观察第3、5、7、9天细胞增殖抑制率。实验重复3次。

2 结果
2.1 K562细胞形态学变化 光学显微镜下,细胞对照组、空质粒组及外源性组的形态相似,细胞着色呈深蓝色,细胞质和细胞核不易区分(图1A);重组质粒组细胞形态和细胞对照组、外源性组细胞明显不同,细胞质呈浅蓝色,细胞核呈淡粉红色,分界清楚,部分细胞内可见肾形、马蹄形细胞核(图1B)。显微镜油镜下可见,对照组、外源性组组及空质粒组结果相似,细胞着色深,呈深蓝色,细胞内未见任何颗粒沉积(图2A);重组质粒组镜下可见部分细胞着色呈深蓝色,部分细胞着色呈浅粉色,呈浅粉色的部分细胞内可见有斑点状甲臜颗粒沉积(图2B)。

注:A为细胞对照组,B为重组质粒组。
图1 光学显微镜下细胞形态学变化

注:A为细胞对照组,B为重组质粒组。
图2 显微镜油镜下细胞形态学变化(×1 000)
2.2 K562细胞增殖抑制率比较 结果见表1。
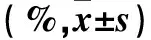
表1 各组不同时点细胞增殖抑制率比较
注:与空质粒组比较,△P<0.05;与外源性组比较,﹟P<0.05。
3 讨论
白血病是一类好发于青少年的恶性肿瘤,是造血干细胞恶性克隆性疾病,患者可出现不同程度的贫血、出血、感染及肝、脾、淋巴结肿大和骨骼疼痛。据文献报道,我国各地区白血病发病率在各种肿瘤中居第6位。目前,白血病的临床治疗以化疗、放疗、靶向治疗、免疫治疗、干细胞移植等为主。免疫疗法可特异性杀伤肿瘤细胞,对正常细胞危害较小,或有望成为治疗恶性肿瘤包括白血病的重要方法。研究[8]发现,白血病患者外周血、淋巴结、脾脏、骨髓中可检测到抑制正常造血干细胞增殖的恶性克隆B细胞。白血病患者的T细胞通过抗原提呈细胞上调免疫反应,降低免疫突触的形成[9]。因此,白血病的治疗或可从裂解白血病患者恶性克隆的细胞入手,如抗CD20单克隆抗体通过激活补体系统,形成攻膜复合物,从而裂解白血病患者恶性克隆的B细胞,或以集落刺激因子来刺激恶性克隆的细胞,以达到治疗效果[10]。K562细胞为人类髓性白血病人工培养的第一个细胞,同时也具有多向分化潜能,因此被广泛用于研究肿瘤如白血病的治疗、药物靶标等领域中。
已有研究[11,12]证实,GM-CSF不仅可作用于骨髓造血细胞分化的较早阶段,同时还可刺激多能干细胞及早期红细胞的增殖、分化和促进成熟细胞向外周血释放,从而提高机体抗肿瘤和抗感染免疫力。Stripecke等[13]发现,将B7.1基因和GM-CSF基因修饰的联合瘤苗应用于白血病的治疗,抑瘤率比单一基因更显著。将GM-CSF注射到小鼠皮下,会增加白细胞的吞噬功能,还会促进巨噬细胞的成熟及影响巨噬细胞在组织中的数量[14]。GM-CSF作为细胞因子,能够调节机体免疫细胞对肿瘤细胞的攻击杀伤能力,具有抗肿瘤的作用[15]。目前,GM-CSF主要用于恶性肿瘤放化疗后所致白细胞减少症及某些免疫缺陷性疾病的造血、再生性障碍贫血和免疫功能重建等治疗中[16]。GM-CSF对治疗癌症放化疗、骨髓移植、艾滋病等各种原因引起的白细胞减少症,提高患者抗感染能力亦有较好疗效[17]。研究[18]发现,GM-CSF可通过调节糖蛋白或其自分泌产物,而保护粒细胞与巨噬细胞的功能免受白血病细胞攻击,还可提高癌症患者化疗后白细胞水平。GM-CSF可刺激造血干细胞释放入外周血,释放入血的造血干细胞很大程度上取代了骨髓移植手术植入的造血干细胞,骨髓移植手术还易给癌症患者造成医源性骨髓移植损伤,故GM-CSF或将成为治疗恶性肿瘤的新途径。
本研究显示,与细胞对照组及空质粒组比较,重组质粒组及外源性组第3、5、7天细胞增殖抑制率均降低(P均<0.05);与外源性组比较,重组质粒组第3、5、7天细胞增殖抑制率均降低(P均<0.05)。提示重组PcDNA3.1-GM-CSF及外源性GM-CSF均能使K562细胞增殖受到抑制,作用强度随作用时间延长而增加,且重组PcDNA3.1-GM-CSF抑制作用强于外源性GM-CSF。本研究还显示,与外源性组、空质粒组、细胞对照组比较,重组质粒组第9天细胞增殖抑制率均降低(P均<0.05);而外源性组与其余3组比较均无统计学差异。说明外源性GM-CSF对K562细胞的抑制作用随着时间的延长出现衰减现象。综上,重组PcDNA3.1-GM-CSF抑制作用强于外源性GM-CSF,而且使用内源性的重组PcDNA3.1-GM-CSF作用于肿瘤细胞,可以在一定程度上避免在使用外源性GM-CSF时可能出现的污染,也在一定程度上弥补了外源性GM-CSF作用时间短暂的缺陷,具有一定的优越性。本研究还发现,转染重组质粒PcDNA3.1-GM-CSF后,部分K562细胞转变成NBT阳性细胞,NBT阳性细胞具有一定吞噬功能。转染PcDNA3.1-GM-CSF的K562细胞形态发生了明显改变,部分细胞内出现肾形马蹄形核,这与吞噬细胞的形态学特点有相似之处。如果将重组质粒PcDNA3.1-GM-CSF转染到K562细胞内,能使K562细胞转为具备吞噬白血病细胞功能的细胞,有望用其治愈白血病。
[1] Croxford AL, Spath S, Becher B. GM-CSF in neuroinflammation: licensing myeloid cells for tissue damage[J]. Trends Immunol, 2015,36(10):651-662.
[2] Waller EK. The roles of sargramostim (rhGM-CSF) as immunotherapy[J]. Oncologist, 2007,12(2):22-26.
[3] Weiskopf K, Weissman IL. Macrophages are critical effectors of antibody therapies for cancer[J]. Mabs, 2015,7(2):303-310.
[4] 杨旭伟,陈元仲,林振兴,等.B7.1 GM-CSF基团修饰的EL-4细胞激发小鼠抗淋巴瘤免疫反应[J].细胞与分子免疫学杂志,2002,18(2):359-362.
[5] 王艳,李岩.大肠癌细胞因子基因治疗的研究现状[J].世界华人消化杂志,2004,12(6):1445-1450.
[6] Francisco-Cruz A, Mata-Espinosa D, Estrada-Parra S, et al. Immunotherapeutic effects of recombinant adenovirus encoding granulocyte-macrophage colony-stimulating factor in experimental pulmonary tuberculosis[J]. Clin Exp Immunol, 2013,171(3):283-297.
[7] 朱红,唐恩洁,杨晓红.PcDNA3.1-GM-CSF重组质粒的构建及鉴定[J].川北医学院学报,2010,25(2):106-108.
[8] Hallek M. Chronic lymphocytic leukemia: 2015 Update on diagnosis, risk stratification, and treatment[J]. Am J Hematol, 2015,90(5):446-460.
[9] Krackhardt AM, Harig S, Witzens M, et al. T-cell responses against chronic lymphocytic leukemia cells: implications for immunotherapy[J]. Blood, 2002,100(1):167-173.
[10] Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013,368(16):1509-1518.
[11] Jalili A. Dendritic cells and their role in cancer immunotherapy[J]. Iran J Immunol, 2007,4(3):127-144.
[12] Nanjappa SG, Hernández-Santos N, Galles K, et al. Intrinsic MyD88-Akt1-mTOR signaling coordinates disparate Tc17 and Tc1 responses during vaccine immunity against fungal pneumonia [J]. PLoS Pathogen, 2015,11(9):e1005161.
[13] Stripecke R, Cardoso AA, Pepper KA, et al. Lentiviral vectors for efficient delivery of CD80 and granulocyte-macrophage-colony-stimulating factor in human acute lymphoblastic leukemia and acute myeloid leukemia cells to induce antileukemic immune responses[J]. Blood, 2000,96(4):1317-1326.
[14] Metcalf D. The colony-stimulating factors and cancer[J]. Nat Rev Cancer, 2010,10(6):425-434.
[15] Basturk A, Akinci S, Hacibekiroglu T, et al. Prognostic significance of flow cytometry findings in Turkish adult acute leukemia patients[J]. Eur Rev Med Pharmacol Sci, 2015,19(18):3360-3366.
[16] Cohen JB, Bucur S, Winton EF, et al. Combination of GM-CSF with fludarabine-containing regimens in chronic lymphocytic leukemia and indolent non-hodgkin lymphoma[J]. Clin Lymphoma Myeloma Leuk, 2015,15(9):514-518.
[17] Messmann JJ, Reisser T, Leithäuser F, et al. In vitro-generated MDSCs prevent murine GVHD by inducing type 2 T cells without disabling antitumor cytotoxicity[J]. Blood, 2015,126(9):1138-1148.
[18] Peralta OA, Bucher D, Angulo C, et al. Tissue localization of GM-CSF receptor in bovine ovarian follicles and its role on glucose uptake by mural granulosa cells [J]. Anim Reprod Sci, 2016,170(7):157-169.
Effects of granulocyte-macrophage colony-stimulating factor transfection on morphology and proliferation of leukemia cells K562
CHENRong,CHANGJinxia,LIXuelu,PENGLijuan,ZHUHong
(DepartmentofMicrobiologyandImmunologyofNorthernSichuanMedicalCollege,Nanchong637000,China)
Objective To observe the effects of exogenous granulocyte-macrophage colony-stimulating factor (GM-CSF) and recombinant PcDNA3.1-GM-CSF on the morphology and proliferation of myeloid leukemia cells K562. Methods K562 cells were randomly divided into four groups. Recombinant PcDNA3.1- GM-CSF, exogenous GM-CSF, and PcDNA3.1 null plasmids were transfected into K562 cells as the recombinant plasmid group, the exogenous group and the empty plasmid group, respectively, and the non-transfected plasmid was set as the control group. The morphological changes of cells were observed under the optical microscope by using high power lens and oil lens, respectively, and the cell proliferation was measured by MTT. Results Morphological changes seen under high power lens: the control group, the empty plasmid group and exogenous group were similar in morphology, cells were stained dark blue, whereas no clear boundary was seen between the cytoplasm and nucleus; compared with these three groups, the cells of the recombinant plasmid group showed a significant difference, the cytoplasm was stained light blue, and the nuclei were pale pink along with a clear bounds between them. Kidney or horseshoe shaped nuclei could be seen in some of the cells. Morphological changes seen under oil lens: the control group, the exogenous group, and empty plasmid group were similar, the cells were stained dark blue, and granules deposition wasn't seen in the cells; as to the recombinant plasmid group, some cells were stained dark blue, while some were pale pink in which dotted formazan particles were seen. Results of cell proliferation assay: Compared with the other two groups, the inhibition rate of cell proliferation in the recombinant plasmid group showed an increase on the 3th , 5th, 7th and 9th days (P<0.05). Compared with the empty plasmid group, the inhibition rate in the exogeneous group displayed an increase on the 3th, 5th and 7th days (P<0.05). Conclusion Both recombinant PcDNA3.1-GM-CSF and exogenous GM-CSF could induce morphological change and lead to proliferation inhibition in K562 cells, the effects increase along with time, and the inhibitory effect of recombinant PcDNA3.1-GM-CSF is stronger than that of the exogenous GM-CSF.
granulocyte-macrophage colony-stimulating factor; leukemic cells; cell morphology; cell proliferation
四川省教育厅自然科学基金资助项目(12ZB214)。
陈蓉(1982-),女,硕士,讲师,主要研究方向为医学免疫学和微生物学。E-mail: chenr1232@163.com
朱红(1975-),女,硕士,副教授,主要研究方向为医学免疫学和微生物学。E-mail: zhuhongyuxia@163.com
10.3969/j.issn.1002-266X.2017.31.002
R730.5
A
1002-266X(2017)31-0005-04
2017-03-06)
