脱氢表雄酮(DHEA)治疗对卵巢低储备患者体外受精-胚胎移植周期的影响*
2017-08-30刘朵朵黄艳红
滑 玮,刘朵朵,陈 琳,樊 丽,黄艳红
第四军医大学西京医院妇产科(西安 710032)
脱氢表雄酮(DHEA)治疗对卵巢低储备患者体外受精-胚胎移植周期的影响*
滑 玮,刘朵朵,陈 琳,樊 丽,黄艳红△
第四军医大学西京医院妇产科(西安 710032)
目的:初步探讨脱氢表雄酮(DHEA)对卵巢储备功能低下妇女的体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)周期的影响。方法:筛选105例卵巢储备功能低下拟进行IVF/ICSI-ET治疗的女性患者105例,根据其意愿分成两组。试验组口服DHEA(75mg/d)和坤泰胶囊,对照组单独口服坤泰胶囊,疗程均为3个月。结果:服用DHEA后卵巢储备功能显著改善,FSH及E2显著低于对照组(P<0.05);服药结束后进行IVF-ET治疗,对比两组患者药物治疗前后卵巢储备的变化,并比较两组妊娠结局,结果发现总促性腺激素使用剂量(Gn量)及周期取消率显著低于对照组(P<0.05),获卵数、优质胚胎数及临床妊娠率均高于对照组(P<0.05)。但两组胚胎种植率比较差异无统计学意义(P>0.05)。结论:DHEA可以改善卵巢储备功能低下患者IVF-ET周期的妊娠结局。
近年来,我国计划生育政策发生重大变化,单独二胎政策、以及随后的二胎政策全面放开,使得更多高龄女性面临生育难题。36岁之后女性卵巢功能逐渐下降,40岁之后处于低储备状态,接近育龄期的尾声,此外,环境污染、食品安全、精神压力等多种因素导致越来越多的年轻女性卵巢功能提前减退。所有这些患者都需要借助辅助生殖技术达成妊娠的愿望[1],使得接受体外受精-胚胎移植(Invitro fertilization and embryo transfer,IVF-ET )治疗的患者中卵巢低储备的比例显著增加。此类患者在接受IVF-ET治疗中会发生获得优质卵子的数量减少,周期取消率升高,妊娠率下降等情况,所以,如何在IVF-ET周期前或周期内进行恰当的辅助治疗,尽可能的降低治疗失败率,提高妊娠率,已成为辅助生殖领域的研究热点和难点。研究表明,脱氢表雄酮(Dehydroepi -androsterone,DHEA) 能改善卵巢储备功能,提高卵巢对促排卵药物的反应,且能通过减少非整倍体的发生,降低流产率,提高妊娠率[2-5]。但是是否应对卵巢低储备患者常规进行DHEA治疗,目前学术界仍有争议[6-7]。本研究通过对卵巢储备功能低下的患者在IVF-ET前进行DHEA预治疗,观察服用DHEA前、后卵巢储备的变化,对比试验组和对照组在治疗后的妊娠结局,初步评估DHEA治疗对卵巢储备功能低下患者卵巢储备功能和IVF-ET周期妊娠结局的改善作用。
资料与方法
1 一般资料 从2010年6月至2012年6月间在本中心拟行IVF-ET的不孕患者中筛选卵巢储备功能低下者作为研究对象,为了筛选患者,本研究选择2010年ESHRE修订标准[8]中的三条作为入组标准:①高龄(≥40岁)或者有其他已知的遗传性或获得性导致卵泡减少的风险因素;②基础血清促卵泡刺激素(bFSH)>9 IU/L;③卵巢储备功能检测异常:包括窦卵泡(AFC<5~7个)或AMH<0.5~1.1ng/ml),三条中具备两条即可入组。根据患者意愿,愿意服用DHEA(美国Schiff公司)的患者入试验组,自愿服用坤泰胶囊(批号国药准字Z20000083)的患者入对照组。共筛选患者105例,试验组72例,年龄29~43岁,平均年龄(36.4 ± 4.8)岁,对照组33例,年龄28~44岁,平均年龄(35.24± 4.1)岁。排除标准:患有子宫内膜异位症、生殖器官畸形、高泌乳素血症和多囊卵巢综合征(PCOS)及其他内分泌疾病,近3个月内使用内分泌药物或其他药物治疗的患者不可入组。本研究经西京医院伦理委员会批准,所有入组患者均签订了知情同意书。两组患者一般资料、服药前卵巢储备功能比较及周期参数比较无统计学差异(P>0.05),具有可比性,见表1。

表1 两组一般资料比较
2 研究方法
2.1 卵巢储备功能指标检测及治疗分组:月经来潮第2或3天进行性激素、肝肾功的检测,经阴道超声检测窦卵泡数目并记录。根据患者意愿分为试验组及对照组,试验组口服DHEA 25 mg,3次/d,同时加服坤泰胶囊;对照组患者单独口服坤泰胶囊4粒,3次/d,连服3个月。服药期间观察记录治疗效果和不良反应,服药结束后开始IVF-ET治疗。
2.2 IVF-ET治疗:月经第21天行阴道B超及血清性激素水平,开始给予戊酸雌二醇(4 mg/d)口服,直至月经来潮第2天,复查阴道B超及血清性激素水平,如可见窦卵泡(2~8 mm),FSH<12 mIU/ml,则开始启动Gn,采用拮抗剂方案或微刺激方案:窦卵泡大于2个采用拮抗剂方案,窦卵泡1~2个采用微刺激方案。拮抗剂方案:给予丽申宝(批号:H20052130,75 IU/支)225~300 IU/d,作为启动剂量,通过阴道超声和性激素测定监测卵泡的生长情况,据此调整药物剂量。当主导卵泡直径达到12 mm或E2水平>800 pg/ml时添加拮抗剂,给予注射用醋酸西曲瑞克(批号:H20050128,0.25 mg/d),当双侧卵巢内至少有1个卵泡直径大于17mm时,肌肉注射人绒毛膜促性腺激素10,000 IU (HCG,2000 IU/支,批号:H44020673),注射HCG 34~36 h 取卵;微刺激方案:克罗米芬50 mg/d(d3~7),随后改为25 mg/d,同时给予注射用尿促性素(批号:H10940097,75IU/支)150~225 IU/d,通过阴道超声和性激素测定监测卵泡的生长情况,据此调整药物剂量。当双侧卵巢内至少有1个卵泡直径大于17 mm时,给予醋酸曲普瑞林注射液 (批号:H20160237,0.1 mg/支) 0.2 mg皮下注射,注射后32~34 h 取卵。根据男方精液情况选择IVF或卵母细胞浆内单精子注射技术(ICSI)授精。本试验针对卵巢储备功能低下患者选择了拮抗剂方案和微刺激方案,取消所有新鲜移植,全胚冷冻。3个月经周期后行冷冻胚胎移植,内膜准备方案采用人工周期,当内膜达到8 mm以上,可见明显内膜下血流,肌肉注射黄体酮及阴道放黄体酮软胶囊转化内膜,4 d后解冻胚胎进行移植,移植后给予黄体支持。移植后14 d通过血β-HCG检测诊断妊娠,移植后35 d行阴道超声检测,超声下可见宫内孕囊诊断为临床妊娠。卵裂期胚胎评级综合卵裂速度、卵裂球均等程度及碎片比例,分为4级[9]。
2.3 监测指标及结果判定:FSH、LH、E2、T等性激素水平,Gn量、获卵数、优质胚胎数、临床妊娠率(CPR)、胚胎种植率、周期取消率,比较试验组和对照组患者卵巢储备功能的变化及妊娠结局。
2.4 药物不良反应:治疗过程中及治疗后定期查肝肾功,记录患者有无不良反应,如恶心、呕吐、皮疹、痤疮、性欲改变、性格改变等。
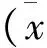
结 果
1 服药后卵巢储备功能比较 服药后试验组患者AFC略高于对照组,但无统计学差异(P>0.05);试验组FSH及E2显著低于对照组、T及P显著高于对照组,具有统计学差异(P<0.05,P<0.01),见表2。

表2 两组间卵巢储备功能比较±s)
注:与对照组相比,*P<0.05;△P<0.01
2 方案选择 主要根据早卵泡期窦卵泡数选择方案,大多数患者窦卵泡数大于2个,采用拮抗剂方案,由于拮抗剂方案费用较高,对于窦卵泡数1-2个的患者,获卵数最多2个,在保证基本相同获卵数的条件下,为了节约患者费用,采用微刺激方案,既可减轻患者经济负担,又可下一周期重复刺激。拮抗剂方案用药对新鲜移植是否有不良影响,仍存在争议,微刺激方案使用克罗米芬,对子宫内膜及宫颈粘液分泌有副作用,故本试验中均未行新鲜胚胎移植。
3 服药前后IVF-ET周期参数比较 服用DHEA组患者IVF-ET周期中,DHEA治疗组取消周期共5例,包括未见明确窦卵泡数者3例,卵巢低反应2例,周期取消率显著低于对照组,Gn量、优质胚胎数、临床妊娠率显著高于对照组,但胚胎种植率无统计学差异(P>0.05),见表3。
如35岁以下患者仅获得1枚胚胎,或35岁以上患者仅获得1-2枚胚胎,则再次IVF,方案同前次,凑够移植胚胎数目后行冻胚移植。基于以上原因,妊娠率指标选择了累计妊娠率。试验组累计妊娠率高于对照组。

表3 两组间IVF妊娠结局比较
注:与对照组相比,*P<0.05
讨 论
随着妇女生育年龄的推迟,二胎政策的全面开放,大批晚育、高龄二胎患者面临生育难题;卵巢、盆腔手术造成卵巢组织损失,残余组织中卵巢储备减少,术后的生育问题困难重重;环境污染、食品污染、生存压力大使得卵巢早衰发生率增加,且发病平均年龄大大提前,面对这些生理年龄小卵巢年龄却已衰老的患者,维持月经容易实现,解决生育就非常困难了。上述因素造成目前卵巢储备功能低下患者群逐渐增多,最大程度的为这类患者解决生育问题已成为IVF-ET技术面临的新的挑战。尽管已尝试多种方法改善治疗结局,如治疗前中西药结合进行预治疗增加窦卵泡数、试用不同方案增加获卵率等,但获卵率和妊娠率仍无显著提升,临床上亟需新的更有效的方法。
DHEA是人体血循环中含量最为丰富的甾体物质,主要在肾上腺网状带合成,具有弱雄激素作用,在外周组织主要转化成睾酮(T)和雌二醇(E2),越来越多的研究证实了DHEA在改善卵巢储备功能降低患者卵巢储备和妊娠结局方面的作用。但由于此类患者年龄偏大,妊娠要求迫切,随机对照试验难以实施,不符合伦理要求,目前仍缺乏可靠证据支持DHEA的应用,指导临床治疗。本研究设计了试验组和对照组,试验组口服DHEA+坤泰胶囊,由于本研究纳入患者均为高龄或卵巢功能减退,怀孕心切,心理多处于焦虑状态,不做治疗有违伦理,难以实现,故将单独口服中成药组设为对照组。坤泰胶囊是目前临床上较为公认的可改善围绝经期症状的中成药,尚未观察到其具有改善卵巢储备功能的功效,但由于中国患者对传统中药的迷信,对于不愿口服DHEA的患者来说比较容易接受此类药物,故设为对照组。虽然整个试验结果的可靠性和说服力很难与随机对照试验相比,但仍有一定的临床意义和参考价值。
本研究发现,服用DHEA后所有患者的卵巢储备指标均较前明显改善。首先,我们发现治疗后雄激素显著增加,DHEA为雄激素前体物质,外源性摄入后可能使循环中睾酮水平升高,此外,我们还观察到孕激素水平较用药前显著升高,根据经典的两细胞-两促性腺激素学说,可能与循环中雄激素水平升高、前体物质堆积有关。其次,我们发现治疗后窦卵泡数略有增加,可以看到有增加的趋势,但差异尚未达到显著的统计学意义,与有关报道结果不完全一致,分析本研究结果可能与治疗周期长度、样本量等有关,详细的治疗机制尚需进一步的、深入的研究阐明。最后,虽然窦卵泡数没有显著增加,但其他评估卵巢储备功能的指标均有所改善,如基础FSH、基础E2显著下降,总体来说,DHEA治疗对已经发生功能减退的卵巢产生了有益的治疗作用,与既往报道结果一致[1]。
关于DHEA改善卵巢储备功能低下患者妊娠结局的作用机制,目前研究尚不明确。有学者提出,卵泡生长需要各种甾体激素的作用,如雄烯二酮(A)、T 和E2等,而DHEA又是合成这些激素分子所必需的底物,故补充DHEA可从“补充原料”的环节改善卵泡生长的“营养”;此外,DHEA还可通过增加细胞内雄激素水平,与FSH协同促进卵泡生长,并促进颗粒细胞分泌抗苗勒氏管激素和抑制素[10-11];高龄患者胚胎非整倍体率增加,使得妊娠率降低,流产率增加,DHEA还可降低胚胎非整倍体率,改善卵巢微环境。故我们推测,DHEA可能在多个环节参与卵母细胞的生长发育和成熟,起到积极的促进作用。
本研究结果中显示,IVF-ET的妊娠结局显著优于对照组,在周期参数中,除胚胎种植率无明显改善外,其他指标与对照组相比均有显著差异。此结果提示,DHEA改善妊娠结局的主要环节可能在于卵母细胞质量及胚胎质量的改善。虽然试验组的妊娠率相对高于对照组,但总体妊娠率无大幅度提高,仍显著低于卵巢储备正常人群。造成卵巢储备功能低下的原因复杂,其中卵巢或盆腔手术造成卵巢储备的丢失无法弥补,Gn受体缺陷或遗传因素机制不清,对于这些患者治疗效果可能较差,这可能是妊娠率没有显著提高的原因之一。
本研究在一定程度上证实了DHEA的疗效,但是由于试验分组设计的缺陷,如试验组与对照组患者例数相差悬殊、分组未遵循随机对照原则、未设阳性及阴性对照组等,可能造成统计结果不可避免的偏倚。为了避免偏倚,需要设计严谨的大样本随机对照试验,为我们临床实践提供确实可靠的理论依据。
综上所述,DHEA可使卵巢储备功能降低患者的卵巢储备功能得到一定程度的提高,进而改善IVF-ET周期的妊娠结局。故在临床上,可根据患者情况和临床实际,对初次进行IVF-ET治疗的卵巢储备功能降低的患者进行DHEA治疗,希望能在一定程度上改善该类患者的首次IVF-ET结局,避免不必要的失败。
[1] Gleicher N,Barad DH. Dehydroepiandrosterone( DHEA) supplementation in diminished ovarian reserve ( DOR)[J]. Reprod Biol Endocrinol,2011,9: 67-79.
[2] Weghofer A,Kim A,Barad D H,etal. The impact of androgen metabolism and FMR1 genotypes on pregnancy potential in women with dehydroepiandrosterone ( DHEA) supplementation[J]. Hum Reprod,2012,27( 11) : 3287-3293.
[3] Gleicher N,Kim A,Weghofer A,etal.Starting and resulting testosterone levels after androgen supplementation determine at all ages in vitro fertilization ( IVF) pregnancy rates in women with diminished ovarian reserve( DOR) [J].Assist Reprod Genet,2013,30:49-62.
[4] Gleicher N,Weghofer A,Barad DH. Improvement in diminished ovarian reserve after dehydroepiandrosterone supplementation[J]. Reprod Biomed Online,2010,21( 3) : 360-365.
[5] Gleicher N,Weghofer A,Barad DH. Dehydroepiandrosterone( DHEA) reduces embryo aneuploidy: direct evidence from preimplantation genetic screening ( PGS) [J].Reprod Biol Endocrinol,2010,8: 140-145.
[6] Wiser A,Gonen O,Ghetler Y,etal. Addition of dehydroepiandrosterone( DHEA ) for poor-responder patients before and during IVF treatment improves the pregnancy rate: a randomized prospective study[J]. Hum Reprod,2010,25( 10) : 2496-2500.
[7] Bosdou JK,Venetis CA,Kolibianakis EM,etal. The use of androgens or androgen -modulating agents in poor responders undergoing in vitro fertilization: a systematic review and meta-analysis [J].Hum Reprod Update,2012,18( 2) : 127-145.
[8] Ferraretti AP,La Marca A,Fauser BC,etal. ESHRE consensus on the definition of‘poor response’to ovarian stimulation for in vitro fertilization: the Bologna criteria[J].Hum Reprod,2011,26( 7) : 1616-1624.
[9] 杨慧军,李 媛,吴克良,等.授精5h 补救性卵胞浆内单精子显微注射的临床应用价值[J].山东大学学报: 医学版,2011,49( 10) : 139-142.
[10] Andersen CY,Lossi K. Increased intrafollicular androgen levels affect human granulose secretion of anti-Müllerian hormone and inhibin-B[J]. Fertil Steril,2008,89(6):1760-5.
[11] 张若鹏,邵 华.常规体外受精-胚胎移植与卵细胞浆内单精子注射临床效果比较[J].陕西医学杂志,2004,34(11):977-979.
(收稿:2017-03-31)
Dehydroepiandrosterone supplementation improve in vitrofertilization outcome among women with poor ovarian reserve
Hua Wei,Liu Duoduo,Chen Lin,et al.Department of Obstetrics and Gynecology,
Xijing Hospital of Fourth Military Medical University (Xi’an 710032)
Objective: To investigate the effect of dehydroepiandrosterone (DHEA) in women with poor ovarian reserve (POR) in IVF/ICSI-ET cycles. Methods: 105 POR patients were selected to join in our study. All the patients were divided into two groups according to the patients’ own willings. Patients in treatment group would have DHEA 75mg daily and KunTai capsules simultaneously; while the control group would only have KunTai capsules. After three months of treatment,patients would receive IVF-ET treatment. General condition of the patients,ovarian reserve parameters and IVF-ET outcomes were compared between the two groups. Results: The ovarian reserve parameters of treatment group were significantly improved,and the level of FSH and E2 were significantly lower than those in the control group(P<0.05). Dosage of gonadotropin administration and cycle cancellation rate in the DHEA group were significantly lower than those in the control group; while the number of oocytes retrieved,the number of good-quality embryo and clinical pregnancy rate of the DHEA group were significantly higher than those in control group (P<0.05). However,the embryo implantation rate of two groups had no statistical difference(P>0.05). Conclusion: DHEA supplementation can improve outcome of IVF in patients with POR.
Dehydroepiandrosterone sulfate/therapeutic use Ovarian reserve Fertilization in vitro Embryo transfer Pregnancy Rate
*陕西省社会发展科技攻关项目(2015SF122)
硫酸脱氢表雄酮/治疗应用 卵巢储备 体外受精 胚胎移植 妊娠率
R321.2
A
10.3969/j.issn.1000-7377.2017.08.010
△通讯作者
