水产养殖中亚硝酸盐毒性影响及处理的研究进展
2017-08-30薛静怡宗雅丽杨俊艺杨俊丽李希磊崔龙波
薛静怡,宗雅丽,侯 玉,杨俊艺,杨俊丽,李希磊,崔龙波
(烟台大学生命科学学院,山东 烟台 264005)
水产养殖中亚硝酸盐毒性影响及处理的研究进展
薛静怡,宗雅丽,侯 玉,杨俊艺,杨俊丽,李希磊,崔龙波*
(烟台大学生命科学学院,山东 烟台 264005)
亚硝酸盐是水产养殖系统中常见的污染物,也是影响水体生态环境的重要因素。养殖水体中亚硝酸盐浓度超标会造成鱼类、软体动物、甲壳类等水生动物中毒甚至死亡。本文论述了亚硝酸盐的产生机理、毒性与危害以及治理方法等,以期为安全有效地降解亚硝酸盐、提高水产养殖产业的经济效益、修复生态环境的平衡提供科学依据。
亚硝酸盐;亚硝态氮;水产养殖;毒性;降解
亚硝酸盐天然存在于自然水体中,在正常浓度范围内不会对水生动物产生毒害影响。但如今一方面由于工业发展中高含氮物质通过污水排放、地表径流、大气沉降等方式进入水体,另一方面由于集约化养殖方式的高密度、高投饵造成高含氮排泄物和残饵在养殖水体中累积,两者造成的高含氮物质量超越了养殖水体中自然菌群所能降解的量,造成亚硝态氮大量产生并且难以转化,这是亚硝酸盐浓度在养殖水体中不断增加的主要原因。本文论述了亚硝酸盐的产生机理、在水生动物体内产生的毒性影响以及对亚硝酸盐的防控治理,以期为采取相应的措施降解亚硝酸盐、提高水产养殖产业的经济效益、修复水环境的平衡等方面提供科学依据。
1 亚硝酸盐的产生机理
亚硝酸盐是细菌硝化作用与生态系统脱氮作用的中间产物[1]。水体氮循环在自然条件下处于一定的平衡状态:
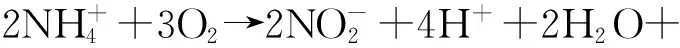

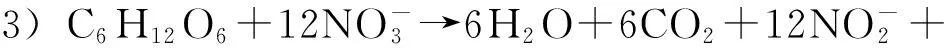
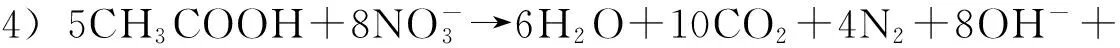
反应1)和2)分别在亚硝化细菌与硝化细菌作用下进行。Avnimelech等[2]对流通鱼塘中氮素转换的研究发现,反应1)中亚硝化细菌的生长繁殖速度为18 min一个世代,转化的时间较短;而反应2)中硝化细菌的繁殖速度为18 h一个世代,生长速度相对较慢,转化时间就长很多,因此亚硝态氮容易累积。但是由于脱氮作用[反应3)和4)]的存在,氮循环仍能保持动态平衡,使亚硝态氮含量处于稳定的低浓度水平。然而,在养殖水体中的氮平衡常常由于高含氮代谢产物量超越了养殖水体自然菌群的代谢量,引起氮循环过程某一环节的障碍,动态平衡即被打破[3],造成亚硝态氮难以转化而大量累积。
2 亚硝酸盐的毒性作用与危害
2.1 毒性作用
亚硝酸盐对水生动物的毒性机制主要有以下几个方面:1)亚硝酸盐会促使动物血液内红血球中的血红蛋白转化为高铁血红蛋白,使其不能与氧气结合,丧失运输氧的能力,比如鱼类的“褐血病”便是亚硝酸盐使鱼血液内的血红蛋白转化为高铁血红蛋白,从而使血红蛋白运输氧的能力大大下降,引发鱼鳃肿胀、摄食减少、生长缓慢等症状,严重者还会造成鱼体中毒死亡;2)亚硝酸盐会使鱼、虾等水生动物体内溶菌酶和抗氧化酶的活性降低,同时影响脾细胞呼吸爆发力,使鱼、虾等动物体内的自由基过氧化物增多,免疫能力下降,从而导致生物体代谢混乱,生理功能失调[4];3)亚硝酸盐还会破环血浆中的铜蓝蛋白,使其失去运输氧的能力,从而导致某些需氧量高的组织缺氧,膜的通透性改变,组织自溶性提高,出现一系列组织病理变化。总之,亚硝酸盐会作用于水生动物体内的血红蛋白、溶氧酶和抗氧化酶以及铜蓝蛋白,使其出现“游塘”、“浮头”、“偷死”、“冒底”等现象[5],对水产养殖造成不可忽视的危害。
2.2 危害
水中亚硝酸盐的浓度如果过高,会造成水中鱼、软体动物、甲壳类等水生动物的中毒甚至死亡。
2.2.1 对鱼类的危害
由于在养殖鱼的过程中需向池塘里投放饵料,鱼自身也产生粪便等排泄物,这些残渣分解后就会产生大量的亚硝酸盐。亚硝酸盐对鱼类的危害主要是会降低鱼血液的载氧能力,从而使鱼缺氧而死。魏泰莉等[6]以彭泽鲫(Carassiusauratus)为试验材料研究了亚硝酸盐对血红蛋白(Hb)的影响,结果表明彭泽鲫血液中的高铁血红蛋白(MHb)的含量会随着亚硝态氮浓度的增加而呈指数递增。赵元凤等[7]研究了不同浓度的亚硝酸盐环境对尼罗罗非鱼(Tilapianilotica)血红蛋白和血浆的影响,分别测定暴露在不同亚硝酸盐浓度下24 h和96 h后鱼血液MHb的含量,发现在不同暴露时间下尼罗罗非鱼血液内MHb的含量均随亚硝态氮浓度的增大而升高,并且亚硝酸盐作用的时间越长,血液内MHb的含量越高;这表明亚硝酸盐对尼罗罗非鱼的致毒是由于亚硝酸盐不断将正常Hb中的二价铁离子氧化成三价铁离子,使其变成无法运载氧的MHb,血液中MHb含量的增加降低了血液的总载氧能力。王明学等[8]在不同浓度的亚硝态氮溶液中养殖团头鲂(Megalobramaamblycephala),利用密闭测量的方法,在24 h内连续测定有关数值,计算得到团头鲂的耗氧率,发现其呈先上升后下降的抛物线状变化,耗氧率达到最大时亚硝态氮浓度为2.5 mg/L;当亚硝酸态氮的浓度大于2.5 mg/L时,检测到鱼体血液中MHb的含量明显升高,这个现象说明在团头鲂体内存在一个亚硝态氮调节体系,使其可以在一个耐受限度内维持自身的Hb数量,使其不被氧化;但是一旦超过了这个限度,血液中的Hb就会被氧化为MHb,从而影响血液运输氧气,使团头鲂呼吸能力受阻,最终使其不能进行正常的生理机能及代谢。此外,余瑞兰等[9]也证明了亚硝酸盐是导致鱼体内溶菌酶和抗氧化酶的活性降低、免疫力下降的主要因素之一。
2.2.2 对虾、河蟹的危害
研究表明,亚硝酸盐对虾类的危害主要是会降低与抗病有关的酶活力,从而使虾的免疫力下降。曾红等[10]对日本对虾(Penaeusjaponicus)幼虾96 h急性毒性试验的结果表明,虾类的死亡率会随着亚硝态氮浓度的升高而升高,在水体中亚硝态氮的作用下,虾的免疫机能会下降。黄翔鹄等[11]通过设置对照的方法研究亚硝酸盐对凡纳滨对虾(Litopenaeusvannamei)的影响,分别测定亚硝态氮浓度保持在4.0 mg/L和8.0 mg/L的实验组与对照组(0.1 mg/L)的对虾抗病力相关因子数值,发现实验组凡纳滨对虾的超氧化物歧化酶活力、抗菌活力、酚氧化酶活力、溶菌活力、血细胞数和血清蛋白含量与对照组的相比均显著降低,实验结果表明亚硝态氮会降低凡纳滨对虾抗病的能力,并且亚硝态氮的浓度越高,对虾的抗病力越弱。艾春香等[12]将罗氏沼虾(Macrobrachiumrosenbergii)分别暴露在浓度为1 mg/L的亚硝态氮水体中1 d、4 d、7 d和10 d,并研究其各组织、器官中各种酶活性的变化,发现酚氧化酶的活性在罗氏沼虾的肝胰腺中略有增高,但是在血清和肌肉中却有所降低,磷酸酶的活性在各组织、器官中有不同程度的增高,超氧化物歧化酶的活性则在各组织中先增高再降低,这些现象表明随着暴露时间的增加,亚硝酸盐在虾体内逐渐积累,从而使各种酶的活性有不同程度的改变。
由于甲壳类动物(例如河蟹)进化程度较低,较哺乳动物来说其特异性免疫发展的还不够完善,所以在受到环境刺激后这类动物主要是依靠非特异性免疫维持机体的稳定,因此甲壳动物血液中的血细胞及抗氧化酶在机体进行免疫时起着非常重要的作用,亚硝酸盐可通过作用于甲壳类动物的血细胞和抗氧化酶来影响其正常生理代谢。洪美玲等[13]分别鉴定了在不同浓度亚硝酸盐作用下中华绒螯蟹(Eriocheirsinensis)的丙二醛含量、血细胞总数和超氧化物歧化酶活力的变化情况,结果显示:1)中华绒螯蟹血细胞总数在高浓度亚硝酸盐作用下显著下降;2)中华绒螯蟹体内超氧化物歧化酶的活性呈现先升高后降低的状态,超氧化物歧化酶的活性在低浓度亚硝酸盐作用下在短期内有了明显的提高,但在高浓度亚硝酸盐作用下却被抑制了,这说明甲壳动物可以在一定限度内对亚硝酸盐的毒性进行抵制,即具有一定的毒性抵制效应;3)在肝胰腺中检测到随着亚硝酸盐浓度的升高,丙二醛的含量也随之升高,并且亚硝酸盐作用的时间越长,丙二醛的累积量就越多,这说明亚硝酸盐在中华绒螯蟹体内可以不断累积,当亚硝酸盐的含量累积到自身无法分解时就会对机体造成危害,从而出现中毒症状。何望等[14]定期给河蟹幼体投喂一定量亚硝酸盐,结果发现亚硝酸盐会使幼体中毒,表现为身体不灵活、尾巴卷曲、浮躁不安等症状,并且随着亚硝酸盐浓度的增加,中毒症状也变得愈加明显,这些症状的出现说明亚硝酸盐会极大地危害河蟹幼体的生长及变态发育,作用机理可能是通过刺激和麻醉河蟹幼体的神经。
3 亚硝酸盐的治理
3.1 物理法
目前在水产养殖中消除亚硝酸盐的物理方法主要是使用过滤吸附法,常见的过滤吸附调节剂有沸石粉和麦饭石。物理法具有成本低廉、反应时间短、不会产生毒害等优点,因此在水产养殖业中被广泛使用。
3.1.1 沸石粉
沸石粉为失去结晶水的沸石,其表面疏松多孔,具有很强的吸附性,可以吸附大量有毒物质如氨、硫化氢等,因此沸石粉被广泛应用于净化水质。活性沸石是含碱金属和碱土金属的铝硅酸矿的总称,其特殊的骨架结构决定了它具有良好的吸附性、选择性离子交换性及催化性等有利于水产养殖的优良性能。胡文平等[15],王彦波[16]对沸石粉的研究表明,在水产育苗和养殖阶段,定期向养殖水体中泼洒沸石粉,既可以去氨增氧,同时还可以增加水中微量元素的含量,从而达到优化养殖生态环境,促进水生动物生长发育的效果。
3.1.2 麦饭石
麦饭石是一种矿物药石,呈多孔形、海绵状特殊结构,内部含有众多的空隙和通道,具有很强的选择吸附和离子交换性能,可以为养殖水体除去毒性氨,增加氧气。此外,麦饭石的化学组成以铝硅酸盐为主,使其具有一定的化学吸附性,可以吸附大肠杆菌、沙门氏菌等细菌。夏中生等[17]对麦饭石的应用研究表明,在水产养殖中使用麦饭石能提高动物的成活率和增重率,并且其价格低廉。因此麦饭石被广泛应用于改良水质和调节水环境pH值等方面。
3.2 化学法

3.2.1 氧化法
3.2.2 还原法
3.3 生物学法
近年来,使用生物学法控制水体中亚硝酸盐取得了一定的成效[21]。其作用机理是通过加入微生态制剂,对水体中的硝化、反硝化作用进行调节,使氮循环达到新的平衡。有多种菌株具有降解亚硝酸盐的功能,如光合细菌、硝化细菌、多种芽孢杆菌。此法的优点是可以对养殖水体进行长效、安全的自我修复,对养殖动物无毒副作用以及无环境污染。但是,目前多采用的单一微生态制剂存在很多的缺陷[22],如硝化细菌繁殖速度慢,不能快速处理水质急剧恶化的问题等。因此复合微生物降解亚硝酸盐成为研究的热点,施大林等[23]研究的四联活菌制剂能快速降解亚硝酸盐,且效果更显著。张峰峰等[21]将解淀粉芽孢杆菌、反硝化细菌、乳酸菌复合降解亚硝酸盐,发现亚硝酸盐降解率在24 h之内超过了99.99%,且降解速度更快速。虽然复合微生物降解法尚未投入生产,但从实验结果来看其有很广阔的前景。
3.4 间接控制法
不同于上述的直接降解法,间接控制法多用于预防亚硝酸盐的累积,采用换水、机械增氧、降低养殖密度、肥水法等方式[24]。此法不直接降解亚硝酸盐,仅起到缓解、控制等作用,因此主要应用于日常管理中预防亚硝酸盐的累积。
4 结论与展望
因规模化、集约化及精养技术在水产养殖产业中的发展,而常常造成养殖水体中亚硝酸盐的累积。养殖水体中亚硝酸盐的浓度过高,会造成大量的水生动物缺氧而死。此外,亚硝酸盐在水生动物体内还存在累积效应,对其生长发育也会产生不良影响。因此,在水产养殖过程中对于亚硝酸盐的防控治理是促进养殖业发展的关键。目前,主要通过物理、化学和生物等方法降解亚硝酸盐,其中物理法与化学法较短效、被动且可能产生药害,而复合微生物法是近年研究的热点,其具有天然、安全、长效等优越性,如何合理利用四联活菌制剂等复合微生物制剂,并将实验室技术转化为可操作的解决方案仍是科研工作者的重要任务。相信随着科研工作与实际生产的深入结合,养殖水体中的亚硝酸盐能够安全有效的降解。
[1]高明辉,马立保,葛立安,等.亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素[J].南方水产,2008,4(2):73-79.
[2]AVNIMELECH Y,WEBER B,HEPHER B.Studies in circulated fish ponds:organic matter recycling and nitrogen transformation[J].Aquac Fish Manag,2010,17(4):231-242.
[3]李嘉麒.日本沼虾亚硝酸盐抗性相关基因的筛选与鉴定[D].泰安:山东农业大学,2016.
[4]张霞霞,李世森,胡艺珂,等.亚硝酸盐对水产动物毒性的影响[J].安徽农业科学,2014,42(5):1398-1400.
[5]彭小云.亚硝酸盐在水产养殖中的危害[J].渔业致富指南,2015,(12):63-64.
[6]魏泰莉,余瑞兰,聂湘平,等.水中亚硝酸盐对彭泽鲫血红蛋白及高铁血红蛋白的影响[J].大连水产学院学报,2001,16(1):68-70.
[7]赵元凤,祝国芹,吕景才,等.亚硝酸盐对尼罗罗非鱼的毒性及其机理的研究[J].大连水产学院学报,1991,6(1):62-65.
[8]王明学,雷和江,卢光,等.亚硝酸盐对团头鲂鱼种血红蛋白和耗氧率的影响[J].淡水渔业,1997,27(1):14-16.
[9]余瑞兰,聂湘平,魏泰莉,等.分子氦和亚硝酸盐对鱼类的危害及其对策的研究[J].中国水产科学,1999,6(3):73-77.
[10]曾红,林能锋,张文焕,等.亚硝酸氮对日本对幼虾的急性毒性试验[J].福建畜牧兽医,2006,28(5):13-14.
[11]黄翔鹄,李长玲,刘楚吾,等.亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响[J].水生生物学报,2006,30(4):466-469.
[12]艾春香,李少菁,王桂忠,等.几种环境因子对虾蟹类非特异性免疫的影响[J].海洋通报,2007,26(5):103-106.
[13]洪美玲,陈立侨,孙新谨,等.亚硝酸盐急性胁迫对中华绒螯蟹幼体相关免疫指标和应激蛋白(HSP70)表达的影响[J].应用与环境生物学报,2011,17(5):688-693.
[14]何望,杨品红.亚硝酸盐对河蟹蚤状幼体及蟹苗毒性试验[J].内陆水产,1999,(7):5-7.
[15]胡文平,王恩玲.沸石粉在养殖业中的妙用[J].饲料研究,1998,15(5):15-16.
[16]王彦波,许梓荣,邓岳松.水产养殖中氨氮和亚硝酸盐氮的危害及治理[J].饲料工业,2002,23(12):46-48.
[17]夏中生,王振权,归俊.广西麦饭石在畜牧水产养殖业中的应用研究[J].广西农业生物科学,2000,19(3):182-187.
[18]吴志宏,韩宝芹,王勇强.水产养殖中亚硝酸盐的产生机理及防治措施[J].齐鲁渔业,2009,26(5):27-28.
[19]谭文平.养殖水体中亚硝酸盐的危害与防控的研究[J].知识经济,2010,(21):142.
[20]马阿妮,陈旭.科洋亚硝酸盐降解剂Ⅰ、Ⅱ型使用效果[J].渔业致富指南,2012,(17):81.
[21]张峰峰,谢凤行,周可,等.利用复合微生物降解养殖水体中亚硝酸盐的初步研究[J].水产科学,2012,31(10):594-596.
[22]何义进.微生态制剂降解养殖水体氨氮及亚硝酸盐的研究[D].南京:南京农业大学,2007.
[23]施大林,何义进,孙梅,等.四联活菌制剂对养殖水体中氨氮及亚硝酸盐的降解[J].水产科学,2009,28(11):663-666.
[24]谷序文,刘全礼,曹芬,等.亚硝酸盐在水产养殖中的危害及解决方法[J].渔业致富指南,2011,(23):79-80.
Research progress on toxicity and treatment of nitrite in aquaculture
XUE Jingyi,ZONG Yali,HOU Yu,YANG Junyi,YANG Junli,LI Xilei,CUI Longbo*
(College of Life Science,Yantai University,Yantai 264005,China)
Being a common pollutant in aquaculture system,nitrite is a significant factor that affects water ecological environment.High concentration of nitrite can be toxic and fatal in aquatic animals such as fishes,mollusc and crustaceans.Nitrite was discussed in the paper from the following four aspects,the mechanism of the production,toxicity,dangers and method of governance.We hope the paper could provide scientific basis for detoxification to nitrite,improvement of economic benefits in aquaculture industry and restoration to ecological balance.
nitrite;nitrite nitrogen;aquaculture;toxicity;degradation
2017-06-12
山东省现代农业产业技术体系建设专项资金(SDAIT-14).
薛静怡(1996-),女,陕西,本科,研究方向:海洋生态.E-mail:3116500678@qq.com
崔龙波(1962-),男,教授,博士,硕士生导师,研究方向:海洋动物细胞学.Tel:13954570581.E-mail:lbcui@163.com
S9
A
1006-5601(2017)04-0320-05
薛静怡,宗雅丽,侯 玉,等.水产养殖中亚硝酸盐毒性影响及处理的研究进展[J].渔业研究,2017,39(4):320-324.
