降香黄檀土壤微生物数量的时空动态特征
2017-08-29陈国德钟圣赟苟志辉吴海霞杜尚嘉
陈国德, 钟圣赟, 苟志辉, 吴海霞, 杜尚嘉
海南省林业科学研究所,海南 海口 571100
降香黄檀土壤微生物数量的时空动态特征
陈国德, 钟圣赟, 苟志辉*, 吴海霞, 杜尚嘉
海南省林业科学研究所,海南 海口 571100
【目的】研究降香黄檀土壤微生物数量在时间和空间上的动态特征,可为降香黄檀栽培技术的完善提供数据支持。【方法】采用稀释平板涂布法,比较分析降香黄檀根际和非根际土壤微生物三大类群(细菌、放线菌、真菌)数量的季节及垂直分布情况。【结果】(1)降香黄檀根际和非根际土壤均表现为春季细菌、真菌数量较多,冬季细菌数量较少,秋季真菌数量较少;非根际土壤放线菌冬季数量较多,秋季数量较少。(2)细菌的根际效应最为明显,其R/S为0.12~62.96;真菌次之,其R/S为0.22~2.46;放线菌的根际效应较小,其R/S为0.32~1.01。(3)降香黄檀上层土(0~20 cm)的微生物数量普遍高于其他土层;随着土层加深,微生物数量表现为逐渐下降或先下降后升高2种变化趋势。【结论】降香黄檀土壤微生物数量的分布受季节和土层的影响。
降香黄檀; 土壤微生物; 根际; 数量
降香黄檀DalbergiaodoriferaT. Chen,又称海南黄花梨,为蝶形花科黄檀属半落叶乔木,国家Ⅱ级重点保护野生植物(Wang,2003);降香黄檀是珍贵红木用材树种,心材坚硬,耐湿耐腐,是制作名贵木制品的重要原料,且具有重要的药用价值(黄星,2012; Chenetal.,2009)。目前,有关降香黄檀的研究主要集中在其多样性(杨新全等,2007; 余敏,2012)、栽培技术(伍庆均,2014)以及活性物质提取(黄星,2012; Zhaoetal.,2011)等方面。
土壤微生物是土壤中物质循环的调节者,也是有机物质和速效养分的一部分,参与多种反应过程,如矿化—同化、氧化—还原等,是植物养料转化、有机碳代谢及污染物降解的驱动力(何振立,1997; 张俊忠等,2008)。植物根际是植物和微生物交流比较活跃的土壤微区。植物根系可以分泌各种对微生物有益的维生素、酶、植物生长调节剂及氨基酸等物质,促进植株正常生长发育,同时对根际微生物的种类、数量和分布产生一定影响。植物、土壤、微生物的相互关系维持着土壤生态系统的功能(吴建峰和林先贵,2003; 朱丽霞等,2003; Rumbergeretal.,2004)。由于土壤微生物在不同季节和土层的分布可能存在差异,进而影响作物的生长。因此,本实验通过研究降香黄檀根际与非根际可培养土壤细菌、真菌、放线菌数量在时间和空间上的变化,为完善降香黄檀栽培技术提供数据支持。
1 材料与方法
1.1 研究区域概况
研究地位于海南省海口云龙基地,地处110°28′E、19°52′N,平均海拔30.4 m,属热带季风气候,年平均温度为23.7 ℃,年平均降雨量1697.8 mm,全年无霜,土壤为砖红壤。
1.2 土样采集及处理
采用五点取样法,分别在2014年1月(冬季)、4月(春季)、7月(夏季)、10月(秋季)进行取样。以抖根法(关松荫,1983)收集降香黄檀0~20、20~40、40~60 cm土层的根际土和非根际土,分别将土样贴好标签后,置于冰盒并带回实验室,过2 mm筛后存放于4 ℃冰箱备用。
1.3 土壤微生物数量的测定
采用平板涂布法(林先贵,2010)测定土壤微生物数量。称取5 g鲜土于45 mL无菌水中,振荡10 min后,取1 mL加入装有9 mL无菌水的试管中依次稀释,分别得梯度10-2、10-3、10-4、10-5、10-6的稀释液,将所需梯度的稀释菌悬液接入相应的培养基平板上涂干,于28 ℃下倒置培养,观察计数,计算每克干土中的微生物数量。细菌用牛肉膏蛋白胨琼脂培养基,真菌用PDA培养基(临用时每1000 mL培养基中加1%孟加拉红水溶液3.3 mL、1%链霉素3 mL),放线菌用高氏1号培养基(临用时每300 mL培养基中加入青霉素1 mL,以抑制细菌和霉菌生长)。
1.4 数据处理
采用Excel 2003和SPSS 16.0对所得数据进行单因素方差分析,用Duncan′s多重比较法测验各参数不同处理间的差异显著性,显著性水平设为α=0.05。
2 结果与分析
2.1 根际和非根际土壤微生物数量的季节变化
降香黄檀土壤微生物数量受季节变化影响显著。由表1可知,1月份根际土壤细菌数量显著小于其他月份,仅为5.23×107CFU·g-1,4月份、7月份和10月份根际土壤的细菌数量无显著差异;4月份的非根际土壤细菌数量与1月份存在显著差异,前者为后者的9.2倍。根际土壤放线菌数量随季节变化无显著差异;1月份的非根际土壤放线菌数量是10月份的3.6倍,差异显著,1月份和10月份的非根际土壤放线菌数量均与4月份、7月份无显著差异。4月份、7月份和1月份的根际土壤真菌数量无显著差异,7月份和10月份的根际土壤真菌数量较小,两者无显著差异,而4月份和1月份的根际土壤真菌数量均与10月份存在显著差异,分别是后者的26.6和12.1倍;4月份的非根际土壤真菌数量分别是10月份和1月份的10.7和7.0倍,4月份的非根际土壤真菌数量与7月份无显著差异,7月份、10月份、1月份的非根际土壤真菌数量无显著差异。
2.2 降香黄檀土壤微生物数量的根际效应
根际效应是植物根际微生态环境对土壤微生物的影响,可以用根际微生物数量(R)与非根际微生物数量(S)的比值(R/S)来反映(向伟,2005)。由表2可知,不同微生物类群的根际效应不同,且同一种微生物类群,随着时间的变化,根际效应也会发生变化。4月份和10月份的细菌根际效应较强,分别为53.71和62.96,两者无显著差异;7月份和1月份的细菌根际效应较弱,分别为3.17和0.12。放线菌根际效应随季节变化无显著差异。1月份与10月份的真菌根际效应存在显著差异;10月份和1月份的真菌根际效应分别与4月份、7月份无显著差异。从微生物类群来看,细菌的根际效应较为明显,其R/S为0.12~62.96;真菌次之,其R/S为0.22~2.46;放线菌的根际效应较小,其R/S仅为0.32~1.01。
2.3 根际和非根际土壤微生物数量的垂直分布特征
由表3可知,4月份降香黄檀根际和非根际土壤微生物三大类群数量的垂直分布有相同的规律,即上层(0~20 cm)土壤微生物数量均显著高于其他土层,20~40与40~60 cm土层的微生物数量无显著差异。
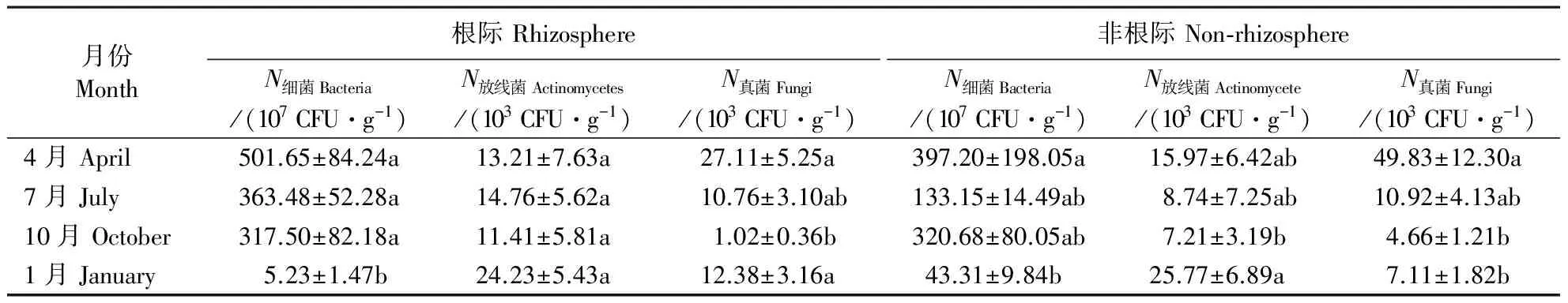
表1 降香黄檀土壤微生物数量的季节变化Table 1 The seasonal distribution in the composition of the soil microbial community associated with D. odorifera
表中数值为平均值±标准误。同列中不同字母表示差异显著(P<0.05)。
Data are mean±SE. Different letters in the same column represent significant differences (P<0.05).

表2 降香黄檀土壤微生物数量根际效应(R/S)Table 2 Rhizosphere effect (R/S) of the soil microbial community of D. odorifera
表中数值为平均值±标准误。同列中括号外不同字母表示同种微生物类群随季节变化根际效应差异显著(P<0.05);同行中括号内不同字母表示同一时间不同微生物类群根际效应差异显著(P<0.05)。
Data are mean±SE. Different letters outside brackets in the same column represent significant differences among different seasons with the same kind of microbial community (P<0.05); different letters in brackets in the same row represent significant differences among different components of the microbial communities at the same time (P<0.05).
7月份降香黄檀根际0~20 cm土层细菌数量显著高于其他2个土层,20~40与40~60 cm土层的细菌数量无显著差异;而非根际40~60 cm土层细菌数量显著高于其他2个土层。根际0~20 cm土层放线菌数量显著高于其他2个土层,分别为20~40和40~60 cm土层放线菌数量的6.9和3.5倍,20~40与40~60 cm土层放线菌数量无显著差异;非根际土壤放线菌数量垂直分布表现为40~60 cm>0~20 cm>20~40 cm,且在非根际20~40 cm土层未检测到可培养的放线菌。根际土壤真菌数量垂直分布显示,0~20 cm与40~60 cm土层间无显著差异,20~40 cm土层真菌数量显著较少;非根际0~20 cm土层真菌数量较多,分别为20~40和40~60 cm土层真菌数量的30.4和5.6倍(表3)。

表3 降香黄檀土壤微生物数量垂直分布Table 3 The vertical distribution in number of soil microbial community of D. odorifera
表中数值为平均值±标准误。同列中不同字母表示同一季节不同土层间差异显著(P<0.05)。
Data are mean±SE. Different letters in the same column represent significant differences among different soil layers at the same time (P<0.05).
10月份降香黄檀根际土壤细菌数量的垂直分布表现为逐渐下降,即0~20 cm>20~40 cm>40~60 cm;非根际土壤细菌数量的垂直分布表现为先上升后下降,即20~40 cm>40~60 cm>0~20 cm。根际0~20与20~40 cm土层放线菌数量无显著差异,在40~60 cm土层未检测到可培养的放线菌;非根际土壤0~20与40~60 cm土层放线菌数量无显著差异,在20~40 cm土层未检测到可培养的放线菌。根际3个土层真菌数量均无显著差异;非根际0~20 cm土层真菌数量显著高于其他2个土层,20~40与40~60 cm土层真菌数量无显著差异(表3)。
1月份降香黄檀根际土壤细菌数量的垂直分布表现为逐渐升高,即40~60 cm>20~40 cm>0~20 cm;非根际土壤细菌数量的垂直分布特征与10月份相似,即先上升后下降:20~40 cm>40~60 cm>0~20 cm。根际3个土层的放线菌数量均无显著差异;非根际40~60 cm土层放线菌数量显著高于其他2个土层。根际0~20 cm土层的真菌数量显著高于其他2个土层,20~40与40~60 cm土层真菌数量无显著差异;非根际20~40与40~60 cm土层的真菌数量存在显著差异,后者为前者的4.2倍,0~20 cm土层真菌数量与其他2个土层无显著差异(表3)。
3 讨论
3.1 降香黄檀土壤微生物数量的季节变化
细菌作为土壤微生物中的重要组成部分,具有含氮量高、含碳量低的特点,对土壤养分的形成与分解有促进作用,土壤细菌多样性越高,越有利于土壤的可持续利用和抗压力提升(Kaschuketal.,2011; Zhouetal.,2002)。放线菌和真菌是参与土壤中有机质分解过程的主要成员:放线菌不仅在物质转化方面起着很大的作用,而且是土壤中重要的抗生素产生菌(冯健,2005);真菌具有复杂的酶系统,分解植物保存性物质 (如木质素)的能力特别强,因此,真菌在土壤物质转化过程中占有重要地位(刘芷宇和施卫明,1997)。本研究表明,降香黄檀土壤微生物三大类群数量随季节变化差异显著,说明降香黄檀土壤微生物数量分布受季节变化的影响,这与马晓梅和尹林克(2009)的研究结果(季节变化是导致土壤微生物类群数量分布特征存在差异的原因之一)相一致。降香黄檀根际和非根际土壤细菌和真菌数量的季节变化规律相近,春季数量最多,冬季和秋季数量较少;而根际土壤放线菌数量随季节变化无显著差异,非根际土壤放线菌数量最多的是冬季,数量最少的是秋季。这一结果与陈珊等(1995)、崔炳华等(2012)和赵先丽等(2006)的研究结果不同(崔炳华等,2012);但与马晓梅和尹林克(2009)对柽柳TamarixchinensisLour.根际和非根际微生物季节变化特征的分析结果存在部分相似。降香黄檀土壤微生物数量的季节变化特征与其他树种不同,可能是由于不同树种对营养物质的利用能力存在差异。有研究指出,降香黄檀导管分子比越南香枝木导管分子长,且管径较越南香枝木小(李桂兰等,2008);同时,土壤微生物数量的季节性变化与有机物的供应和植物生长状况及温、湿等环境因素有关。具体原因有待进一步研究。
3.2 降香黄檀土壤微生物数量垂直分布特征
降香黄檀根际和非根际土壤微生物数量的垂直分布显示,0~20 cm土层微生物数量普遍高于其他土层,这一结果与大多数学者的研究结果(高婷,2006; 尉海东和董彬,2014)相一致;随着土层的加深,降香黄檀土壤微生物数量表现出逐渐下降或先下降后升高2种变化趋势。戴雅婷等(2012)的研究表明,随着土层的加深,土壤微生物数量逐渐下降。这可能是由于植被枯落物和土壤有机质主要分布在土壤表层,且土壤表层通气状况良好,温度较高,有利于土壤微生物的活动与繁殖(陈华癸,1979),随着土层加深,供给微生物营养的植物残体及其根分泌物发生变化,因此,表层微生物数量及生理活性均明显高于下层。土壤微生物数量先下降后升高的变化可能与降香黄檀落叶量大、根系发达(梁建平,2001)的生长特性有关。表层凋落物多,需要更多微生物进行降解,则上层土的微生物数量较多;而随着土层的加深,微生物生存所需的物质等材料逐渐减少,微生物数量也出现下降;但因降香黄檀具有发达的根系,深层土的微生物数量又增多。
陈华癸, 1979. 土壤微生物学. 上海: 上海科学技术出版社.
陈珊, 张常钟, 刘东波, 张镇瑗, 杨靖春, 王志霞, 1995. 东北羊草草原土壤微生物生物量的季节变化及其与土壤生境的关系. 生态学报, 15(1): 91-94.
崔炳华, 蒋勇, 陈绍武, 晋明瑞, 胡开波, 王守强, 2012. 巨桉人工林根际可培养土壤微生物数量的季节变化. 四川林业科技, 33(5): 63-66.
戴雅婷, 侯向阳, 王慧, 高丽, 2012. 鄂尔多斯沙地油蒿根际土壤微生物数量的季节动态. 干旱区资源与环境, 26(10): 103-107.
冯健, 2005. 巨桉人工林地土壤微生物多样性研究. 硕士学位论文. 雅安: 四川农业大学.
高婷, 2006. 沙蒿根际、非根际微生物数量的动态变化研究. 宁夏农林科技 (3): 16, 22.
关松荫, 1983. 土壤微生物及其研究法. 北京: 中国农业出版社.
何振立, 1997. 土壤微生物量及其在养分循环和环境质量评价中的意义. 土壤, 29(2): 61-69.
黄星, 2012. 降香黄檀籽黄酮的提取分离及生理活性研究. 硕士学位论文. 无锡: 江南大学.
李桂兰, 徐峰, 罗建举, 李英健, 蓝方敏, 2008. 海南香枝木与越南香枝木木材构造特征比较解剖研究. 基因组学与应用生物学, 27(2): 154-157.
梁建平, 2001. 广西珍稀濒危树种. 南宁: 广西科学技术出版社.
林先贵, 2010. 土壤微生物研究原理与方法. 北京: 高等教育出版社.
刘芷宇, 施卫明, 1997. 根际研究方法. 南京: 江苏科学技术出版社.
马晓梅, 尹林克, 2009. 荒漠河岸林植物根际和非根际微生物的季节性变化. 干旱区资源与环境, 23(5): 165-171.
尉海东, 董彬, 2014. 鲁东南杨树人工林根际微生物数量时空动态. 中国农学通报, 30(10): 1-8.
吴建峰, 林先贵, 2003. 土壤微生物在促进植物生长方面的作用. 土壤, 35(1): 18-21.
伍庆均, 2014. 降香黄檀培育技术. 广东林业科技, 30(1): 74-76.
向伟, 李振基, 龙寒, 朱小龙, 黄承勇, 郑凌峰, 2005. 不同群落类型的长苞铁杉林的根际微生物研究. 厦门大学学报(自然科学版), 44(6): 62-65.
杨新全, 冯锦东, 魏建和, 李榕涛, 何明军, 杨成民, 2007. 我国特有濒危药用植物降香黄檀遗传多样性研究. 世界科学技术: 中医药现代化, 9(2): 73-76.
余敏, 2012. 降香黄檀与多裂黄檀木材DNA 提取及其 rDNA-ITS 序列分析. 硕士学位论文. 合肥: 安徽农业大学.
张俊忠, 陈秀蓉, 杨成德, 胡宜刚, 王国荣, 韩玉竹, 徐长林, 2008. 东祁连山高寒草地土壤微生物三大类群的时空动态特征. 水土保持学报, 22(5): 167-171.
赵先丽, 程海涛, 吕国红, 贾庆宇, 2006. 土壤微生物生物量研究进展. 气象与环境学报, 22(4): 69-73.
朱丽霞, 章家恩, 刘文高, 2003. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 12(1): 102-105.
CHEN W Q, ZHONG L, ZHANG L, JI X P, ZHAO Y X, ZHANG C, JIANG H, WU Y L, ZHANG Y, 2009. Chinese medicine tongxinluo significantly lowers serum lipid levels and stabilizes vulnerable plaques in a rabbit model.JournalofEthnopharmacology, 124: 103-110.KASCHUK G, ALBERTON O, HUNGRIA M, 2011. Quantifying effects of different agricultural land uses on soil microbial biomass and activity in Brazilian biomes: inferences to improve soil quality.PlantandSoil, 338(1/2): 467-481.RUMBERGER A, YAO S G, MERWIN I A, NELSON E B, THIES J E, 2004. Rootstock genotype and orchard replant position rather than soil fumigation or compost amendment determine tree growth and rhizosphere bacterial community composition in an apple replant soil.PlantandSoil, 264(1/2): 247-260.
WANG W B, 2003. Study on sustainable development countermeasures for redwoods tree species in China.JournalofFujianForestryScienceandTechnology, 30(4): 108-111.
ZHAO X B, MEI W L, GONG M G, ZUO W J, BAI H G, DAI H F, 2011. Antibacterial activity of the flavonoids fromDalbergiaodoriferaonRalstoniasolanacearum.Molecules, 16(12): 9775-9782.
ZHOU J, XIA B, TREVES D S, WU L Y, MARSH T L, O′NEILL R V, PALUMBO A V, TIEDJE J M, 2002. Spatial and resource factors influencing high microbial diversity in soil.AppliedandEnvironmentalMicrobiology, 68(1): 326-334.
(责任编辑:杨郁霞)
Spatiotemporal characteristics of soil microbial communities associated with rosewood,Dalbergiaodorifera
CHEN Guode, ZHONG Shengyun, GOU Zhihui, WU Haixia, DU Shangjia
HainanProvincialForestryScienceInstitute,Haikou,Hainan571100,China
【Aim】 We studied the spatiotemporal characteristics for number of soil microorganism ofDalbergiaodoriferaso as to provide basis for improvement of cultivation technology ofD.odorifera. 【Method】 Using the dilution plate coating method, seasonal and vertical distribution of the soil microbial community (bacteria, actinomycetes and fungi) in the rhizosphere and non-rhizosphere soil aroundD.odoriferaindividuals were compared. 【Results】 (1) The number of bacteria and fungi in the soil were the highest in spring. The lowest number of bacteria was found during winter, while the number of fungi was the lowest during autumn. The number of non-rhizosphere actinomycetes was the highest in winter and the lowest in autumn. (2) Rhizosphere effect of bacteria was more obvious, theirR/Sbeing 0.12-62.96, followed by the fungi with anR/Sof 0.22-2.46, and of actinomycetes, with anR/Sof 0.32-1.01. (3) The numbers of soil microorganisms were higher in the top soil layer (0-20 cm) than in deeper soil layers. The numbers of soil microorganism gradually decreased with depth; in some cases, however, the first decrease was followed by an increase. 【Conclusion】 The number distribution of soil microbial community ofD.odoriferais influenced by season and soil layer.
Dalbergiaodorifera; soil microorganism; rhizosphere; number
2016-12-08 接受日期(Accepted): 2017-02-27
海南省科研院所技术开发专项(KYYS-2014-09)
陈国德, 男, 助理工程师。 研究方向: 珍稀濒危树种保育
*通信作者(Author for correspondence), E-mail: 465157335@qq.com
10.3969/j.issn.2095-1787.2017.03.009
