猪瘟疫苗(传代细胞源)生产工艺研究
2017-08-29王春雪
礼 颖,王春雪
(哈药集团生物疫苗有限公司,哈尔滨 150069)
猪瘟疫苗(传代细胞源)生产工艺研究
礼 颖,王春雪
(哈药集团生物疫苗有限公司,哈尔滨 150069)
猪瘟是一种传染性疾病,是目前危害我国养猪业发展的主要疫病之一。由猪瘟病毒引起,因其流行广、发病率及死亡率高,猪瘟的防控工作也变得越来越艰巨。接种疫苗是控制猪瘟的主要途径,试验通过对猪瘟传代细胞源的工艺优化研究,以获得较好的生产工艺技术参数,从而确保提高产品效价和稳定性。
ST细胞;消化;接毒,效价
猪瘟由猪瘟病毒(CSFV)引起,流行广,发病率及死亡率较高,是目前危害我国养猪业发展的主要疫病之一[1-4]。随着我国猪瘟的流行越来越复杂,猪瘟的防控工作也变得越来越艰巨。接种疫苗是控制猪瘟的主要途径[5-12]。
猪瘟活疫苗的生产中越来越多的采用传代细胞源生产工艺方法,此方法简化生产过程,减少了动物源的原材料的使用,但在培养过程中效价的稳定性与高低成为工艺研究重点,本文主要采用一些试验方法,使抗原效价有所提高,并确定其关键工艺参数。
1 试验材料
1.1 细胞及毒株
使用细胞为ST细胞,保存液氮罐中,生产用为10代以内;种毒为猪瘟兔化弱毒株(脾毒),保存温度-80℃冰柜,生产用毒种(3代)。
1.2 主要试剂及试验动物
5倍MEM溶液、7.5%碳酸氢钠溶液、犊牛血清、青链霉素溶液、EDTA-胰酶分散液;检测用培养基普通琼脂、普通肉汤、40%葡萄糖溶液、酪胨琼脂斜面(G.A)、硫乙醇酸盐酪胨汤(T.G)葡萄糖蛋白胨(G.P);试验过程中所使用动物为大耳白家兔。
2 试验方法
2.1 细胞制备
ST细胞消化5~10 min后培养48 h的形态观察见图1,细胞消化45~50 min后培养48 h的形态观察见图2,细胞消化65~70 min后培养48 h的形态观察见图3,ST细胞传代过程中细胞生长情况记录见表1。
从工作细胞库中取出1支冻存ST细胞置37℃水浴中融化,待冻存细胞液完全溶解,放置离心机中,1 000 r·min-1离心7 min。弃上清,移入装有含营养液的细胞培养瓶中,置37℃含5%CO2培养箱中培养,24 h换液继续培养,待形成良好细胞单层后扩大培养至转瓶培养。
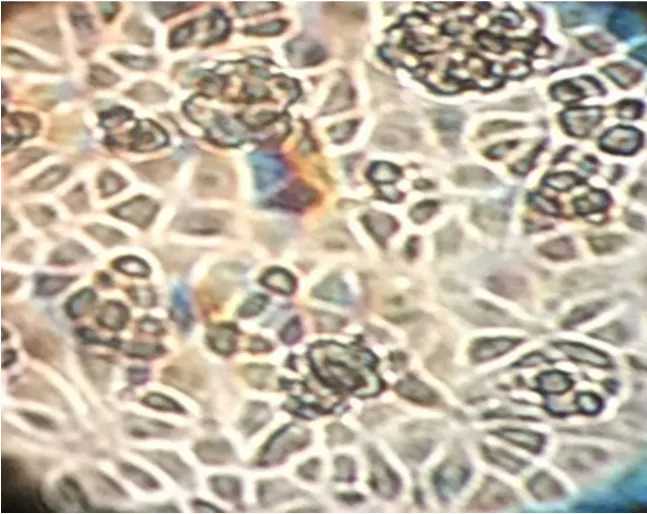
图1 ST细胞消化5~10 min后培养48 h的形态

图2 细胞消化45~50 min后培养48 h的形态
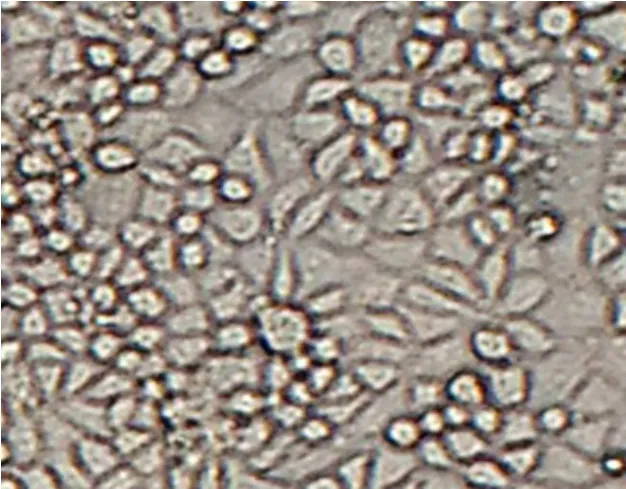
图3 细胞消化65~70 min后培养48 h的形态
取生长良好单层的ST细胞,用PBS溶液中和细胞表面残留物质后弃掉,再加入E-EDTA溶液,37℃温室中进行消化,待消化至肉眼可见瓶壁表面出现针尖样划痕或间隙,显微镜下观察可见细胞出现圆缩、脱落时,弃掉部分消化液(剩余10~30 mL消化液),于37℃温室中继续消化。
201501批:待消化5~10 min后,加入少量营养液对单层细胞进行吹打,制成细胞悬液,采取按1∶3分装比例传代增殖。

表1 ST细胞传代过程中细胞生长情况
201502批:待消化45~50 min后,加入少量营养液对单层细胞进行吹打,制成细胞悬液,采取按1∶3分装比例传代增殖。
201503批:待消化65~70 min后,加入少量营养液对单层细胞进行吹打,制成细胞悬液,采取按1∶3分装比例传代增殖。
3组细胞均置于37℃温室增殖培养,对ST细胞的形态及增殖情况进行观察,并记录。
2.2 接 毒
不同接毒量的试验效果对比见表2,3%接毒24 h ST细胞的形态观察见图4,5%接毒24 h ST细胞的形态观察见图5。

表2 不同接毒量的试验效果对比
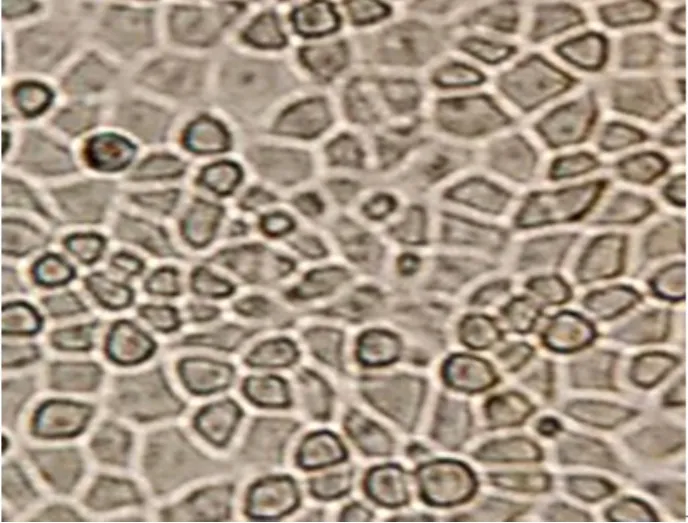
图4 3%接毒24 h ST细胞的形态
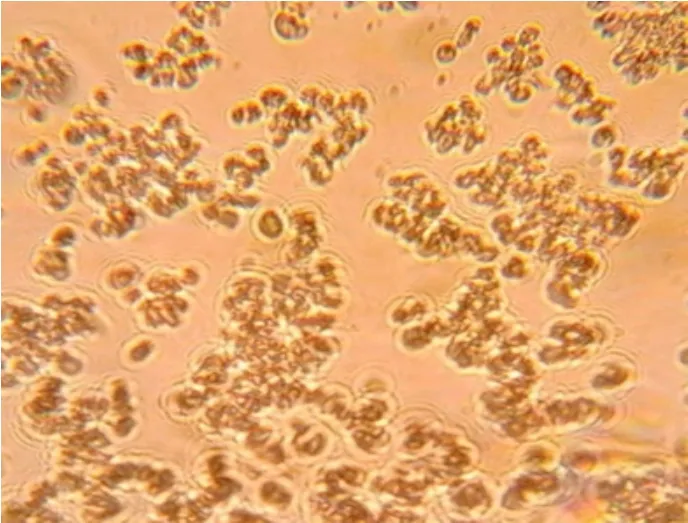
图5 5%接毒24 h ST细胞的形态
细胞数达到90%~100%刚形成单层的ST细胞,随机选取1转瓶继续传代作为对照组,剩余随机分成3组(201504、201505、201506),用同步接毒的方法分别接入含3%、4%和5%的猪瘟兔化弱毒株(脾毒)病毒维持液,37℃温室中转瓶培养。接种后每日观察1~2次,对ST细胞病变情况进行观察并记录,选择有80%单层细胞出现典型CPE时即可收获。采用倍比稀释法对病毒含量测定。
每只兔耳静脉注射1 mL(平行注射两只兔子)。测量体温,按兔体产生体温反应确定病毒量是否合格。符合定型热反应(++)为合格可进行第2次传代。
接种家兔的体温反应分为4类:定型热反应(++)潜伏期24~48 h,体温上升呈明显曲线,>常温1℃以上至少有3个温次,并稽留18~36 h;轻热反应(+)潜伏期24~72 h,体温上升有一定曲线,>常温0.5℃以上至少有两个温次,并稽留12~36 h;可疑反应(±)潜伏期不到24 h或>72 h,体温曲线起伏不定,或稽留<12 h,或稽留>36 h而不降;无反应(-)体温正常。
2.3 无菌检验
不同温度对待测样品的影响见表3。
将待测样品接种TG小瓶(50 mL·瓶-1),接种量为1.0 mL·瓶-1,置37℃培养,3 d后吸取培养物,分别接种GA斜面、TG小管各2支和GP小管1支,接种量为0.2 mL·支-1,一支GA斜面和TG小管置37℃培养,一支GA斜面、TG小管和GP小管置25℃培养,均培养5 d,每日观察结果并记录。
3 试验结果
试验结果表明,ST细胞消化45~50 min后补液传代,培养48 h后观察细胞生长情况,发现细胞状态良后,形态完整且分布均匀,细胞团较少。ST细胞消化5~10 min后补液传代与ST细胞消化65~70 min后补液传代,培养48 h后,细胞分布不均、细胞团较多。因此,ST细胞消化时间选择45~50 min,消化效果显著提高。
结果表明,按3%、4%和5%3种不同接毒剂量感染ST细胞,收获的3种病毒液TCID50值间有差别,其中5%接毒量收获的病毒液RID值略偏高,4%和5%接毒量收获的病毒液RID值与3%接种量收获的病毒液RID值差异显著。5%接毒量的细胞在接毒后24 h已出现细胞病变(CPE),48 h后细胞病变>80%,可以收获;3%接毒量的细胞在接毒后24 h未见细胞病变出现,48 h出现细胞病变,72 h后细胞病变较高,>80%,因此根据生产需要在接毒时选择5%接毒量进行生产。
表3 不同温度对待测样品的影响
4 结 论
根据试验结果,ST细胞消化时间选择45~50 min,消化效果显著提高,根据生产需要在接毒时选择5%接毒量进行生产。试验通过对猪瘟传代细胞源的工艺优化研究,获得较好的生产工艺技术参数,提高了产品的效价和稳定性。
[1]贾洪林,仇华吉,李娜,等.新型猪瘟疫苗研究现状[J].中国预防兽医学报,2005,27(4):312-316.
[2]陈田梅,王荣祥,王强,等.猪瘟防制中存在的问题和对策[J].畜牧与饲料科学,2009,30(1):111-113.
[3]胡鸿惠,娄高明.猪瘟疫苗研究进展[J].中国畜牧兽医,2012, 39(4):196-200.
[4]李群,顾秀萍,钱钟,等.猪瘟基因工程疫苗研究进展[J].国外畜牧学(猪与禽),2014,34(11):72-73.
[5]衣翠玲.猪瘟病毒及疫苗应用研究概况[J].青海畜牧兽医杂志, 2010,40(4):50-51.
[6]谢沄,白华.新型猪瘟疫苗研究进展[J].动物医学进展,2008, 29(2):79-81.
[7]王海光.猪瘟兔化弱毒ST传代细胞源疫苗效检替代方法和猪瘟病毒鉴别检测方法的建立[D].北京:中国兽医药品监察所,2013.
[8]杜勐侃.规模猪场猪瘟免疫效果分析及防治技术研究[D].杭州:浙江大学,2013.
[9]蒋卉,戴志红,王在时,等.猪瘟兔化弱毒疫苗效力检验替代方法研究Ⅰ家兔效力检验ELISA方法初探[J].中国兽医杂志, 2013,49(5):9-12.
[10]陈锴,姚华伟,王长江,等.荧光定量PCR作为猪瘟兔化弱毒疫苗效价检验替代方法的研究与应用[J].中国农业科学,2013, 46(1):162-169.
[11]张兴娟,韩秋影,孙元,等.猪瘟兔化弱毒疫苗RT-LAMP检测方法的建立[J].中国兽医科学,2010(7):701-707.
[12]刘大伟,张小飞,胡来根,等.猪瘟兔化弱毒疫苗株TaqMan荧光定量RT-PCR检测方法的建立及初步应用[J].中国预防兽医学报,2010,32(6):446-450.
The Study on Optimization of Production Processes to the Classical Swine Fever Vaccine(Cell Line Origin)
LI Ying,WANG Chunxue
(Harbin Pharmaceutical Group Biological Vaccine Co.,Ltd.,Harbin 150069,China)
Swine fever is an infectious disease,which is one of the major diseases that endangers the development of pig industry in our country.It was caused by swine fever virus,which had a wide prevalence,high morbidity and mortality,and the prevention and control of CSFV was more and more difficult.Vaccination was the main way to control hog cholera,and the experiment researched on the optimization of the process of swine fever passage cell source,in order to obtain better production technology parameters,so as to improve the titer of potency and stability of theproduct.
ST cells;digestion;toxicity;potency
S828;S852.65+1
:A
:1001-0084(2017)07-0026-04
2017-06-18
礼颖(1974-),女,辽宁辽中人,兽医师,主要从事疫苗生产的研究与应用。
