过敏性紫癜患儿肠道菌群结构及多样性研究
2017-08-28陈鹏德郝丽军王宝西
陈鹏德,林 燕,杨 洁,郝丽军,雷 达,兰 莉,江 逊,王宝西
(第四军医大学唐都医院儿科,陕西 西安 710038)
[专题研究]
过敏性紫癜患儿肠道菌群结构及多样性研究
陈鹏德,林 燕,杨 洁,郝丽军,雷 达,兰 莉,江 逊,王宝西
(第四军医大学唐都医院儿科,陕西 西安 710038)
目的 探讨过敏性紫癜(HSP)患儿的肠道菌群结构及多样性变化和粪便菌群与黏膜菌群结构及多样性的差异。方法 收集47例过敏性紫癜患儿粪便样本和其中7例腹型患儿的结肠黏膜样本,以11例健康儿童粪便样本为对照,采用试剂盒提取法提取样本DNA并进行高通量测序,对测序结果进行生物学信息分析。结果 HSP患儿与健康儿童粪便菌群存在结构差异,在门水平两组均以厚壁菌门(47.10%、57.75%),变形菌门(23.04%、10.13%),拟杆菌门(22.81%、21.74%)为主要优势菌群,在科水平,均以肠杆菌科(17.60%、8.72%)、拟杆菌科(18.90%、21.65%)、瘤胃菌科(16.44%、28.93%)、毛螺菌科(11.55%、10.74%)有较高的丰度。HSP患儿粪便菌群中变形菌门、欧文氏菌属(从目到属)、拟杆菌属-uniformis种、巨单胞菌属、肠球菌属(从科到属)丰度高于对照组健康儿童,而双歧杆菌属(从目到属)、链球菌属(从目到属)、普拉梭菌种(从科到种)丰度低于对照组健康儿童。腹型患儿粪便菌群多样性高于黏膜菌群;在门水平,粪便菌群以厚壁菌门(53.64%)、变形菌门(33.65%)、拟杆菌门(9.24%)丰度较高,黏膜菌群以变形菌门(88.13%)丰度最高,在科水平,粪便菌群以肠杆菌科(27.18%)、瘤胃菌科(15.58%)、毛螺菌科(12.31%)为优势菌科,黏膜菌群以肠杆菌科(87.19%)为优势菌科;粪便菌群以双歧杆菌属(从门到属)、链球菌属(从门到属)、动性球菌科(从门到科)、丹毒丝菌科(从门到科)、梭菌科(从门到科)、瘤胃菌科(从门到科)、毛螺菌科(从门到科)为主要特征差异细菌种类,结肠黏膜菌群以欧文氏菌属(从门到属)为主要特征差异细菌种类。结论 HSP患儿粪便菌群病原菌或机会致病菌增多而有益菌减少,腹型HSP患儿黏膜菌群与粪便菌群存在结构和多样性差异。
过敏性紫癜;肠道菌群;菌群结构;菌群多样性;高通量测序
过敏性紫癜(anaphylactoid purpura, AP)又被称为亨-舒综合征(henoch-schönlein purpura, HSP 或schönlein-henoch purpura, SHP),是儿童期常见的血管炎,是主要影响小血管(毛细血管及小静脉或小动脉)的全身综合征,以非血小板减少性紫癜、关节炎或关节痛、腹痛、胃肠道出血及肾炎为主要临床表现[1],小血管壁异常IgA沉积是其病理生理特征,因此2012年Chapel Hill 会议 (CHCC 2012)的血管炎分类标准基于疾病特点及病因将HSP直接命名为IgA血管炎(IgA vasculitis,IgAV)[2]。HSP病因及发病机制尚不明确,目前认为与免疫异常有关,近年来在HSP免疫机制的研究发现,肠道菌群变化可能影响HSP的发展及转归。人体肠道菌群的结构多样性及功能稳定,对于人体健康具有重要意义。本研究应用高通量测序技术检测HSP患儿与健康儿童肠道菌群,分析比较HSP患儿和健康儿童肠道菌群结构及多样性差异,以及腹型HSP患儿粪便菌群与结肠黏膜菌群结构与多样性差异,为临床医生认识肠道菌群多样性在HSP发病中的作用,探索微生态制剂及其他药物调节肠道菌群以治疗HSP、改善HSP预后提供理论依据。
1 对象与方法
1.1研究对象1.1.1过敏性紫癜患儿
选取2016年6至12月在唐都医院儿科住院的HSP患儿,在发病一周内收集粪便及结肠黏膜样本。同期张贴告示招募同龄健康志愿者及附近幼儿园同龄健康儿童作为对照组。
HSP患儿纳入标准:①新发病例;②2~14岁;③符合HSP诊断标准[3](2010 EULAR/PRINTO/PRES共同制定 )。
排除标准:①合并有其他系统基础疾病;②原发性免疫缺陷病和精神病患者;③标本采集前2周内使用抗生素、激素、免疫抑制剂、微生态制剂;
1.1.2 对照组
对照组纳入标准:①2~14岁;②大便常规检查无异常;③无哮喘、过敏性咳嗽等过敏性疾病史;④标本采集前2周内未使用抗生素、激素、微生态制剂。
HSP患儿及对照组儿童均收集粪便样本,对其中部分有腹痛症状的HSP患儿行电子结肠镜及活检明确肠道黏膜情况,收集结肠黏膜样本。
本研究获得医院医学伦理委员会的批准,研究对象及家长或监护人均知情同意。
1.2方法
1.2.1样本收集
1.2.1.1粪便样本 用无菌棉签剥去新鲜粪便表层,避免混入尿液或其他杂物,更换棉签,挑取内层粪便约1g,装入无菌冻存管,入液氮罐内保存。
1.2.1.2结肠黏膜样本 结肠镜检查若有溃疡,则在溃疡边缘活检钳夹取表层粘膜;若无溃疡,则在升、横、降、乙状结肠及直肠部位各取一份,总量约0.05g,装入无菌冻存管,入液氮罐内保存。
1.2.2样本总DNA提取
试剂盒提取法:采用QIAGEN公司QIAamp?DNA Stool试剂盒提取粪便样本和结肠粘膜样本总细菌DNA,具体步骤严格按照试剂盒说明书操作。
1.2.3 高通量测序
对提取DNA进行16S rDNA高通量测序,测序文库构建及高通量测序由安诺优达基因科技(北京)有限公司进行。
1.2.4数据处理及生物信息学分析
1.2.4.1数据处理 采用统计学软件SPSS 19.0,HSP患儿和对照组健康儿童年龄差异运用两独立样本t检验验证,性别差异运用卡方检验,当P>0.05时,差异无统计学意义。
1.2.4.2生物信息学分析OTU分析
分类操作单元(operational taxonomic unit,OTU),它代表的是一类相似序列的集合,挑选策略是以获得的序列与参考数据库中的OTUs序列进行比对,挑选相似度大于97%的序列归为一类OTUs。
根据每个组间的OTUs交叠情况做出以下Venn图,Venn图统计出每个组共有与特有的OTUs数目情况,可以比较直观的显示组间的OTUs组成的重叠情况。
Alpha多样性展示的是样品内的菌群的多样性情况,包括菌种的类别丰富度及菌种数目的均匀度。Alpha多样性越高即细菌种类越丰富,细菌数目越均匀则表示此群落愈加稳定。Alpha多样性指数包括Shannon指数、Chao1指数、Observed_species指数和Simpson指数。①Shannon指数:是根据样品中的物种种类以及每个物种的比例来计算的多样性指标,菌种分布越均匀,其Shannon值越大; ②Chao1指数:是一个可以不基于进化树来进行评价物种丰度的一个指数,在低丰度样品特别多的时候更能体现真实的多样性情况; ③Observed_species指数:是一个不基于进化树来对物种丰富度进行检测的指数,就是某次实验中观测到的种类数; ④Simpson指数:是一种基于分布格局的多样性的测度方法,是测量一个种群的集中程度或优势程度的。稀有种对Simpson值的影响较小,而常见种对其的影响较大。
在了解每个OTUs对应的物种后,由于存在同一个物种具有多个不同的OTUs的情况。把具有相同物种分类的OTUs合并到一起,统计不同样品间的物种成分变化,可以了解不同样品之间的菌群多样性。
LefSe(linear discriminant analysis coupled with effect size measurements)分析将线性判别分析和KW rank sum test、Wilcox test相结合,确定不同的物种对组间差异影响的效应大小,从而找出组间特异的一些物种或者对群落结构影响较大的物种。通过LefSe分析可以找出组间在丰度上有显著差异的物种,具有显著性差异的物种标注在进化分支图的不同分支上,组间的显著性差异以LDA(线性回归分析)获得的LDA分值表示并绘制LDA柱状图。
2 结果
2.1 一般资料比较
2016年6至12月唐都医院儿科住院HSP患儿,共入选HSP患儿47例,男34例,女13例,平均年龄(6.51±2.48)岁,其中17例患儿发病前1~3天内曾有上呼吸道感染或过敏等明确的诱因。对有腹痛症状的7例患儿行电子结肠镜,镜检示结肠不同肠段轻重不等的黏膜充血、水肿、黏膜下点状、片状出血,部分可见糜烂、溃疡,但结肠黏膜表现与临床症状无明显相关;黏膜活检病理示黏膜组织慢性炎伴炎性渗出,纤维肉芽组织增生及散在嗜酸性粒细胞浸润,部分腺上皮增生活跃,呈轻度不典型增生。HSP患儿予对症支持治疗、部分患儿加用抗生素控制感染、激素抑制炎症反应后,均症状好转出院。
对照组儿童11例,平均年龄(5.21±2.68)岁,男6例,女5例。HSP患儿与对照组健康儿童年龄、性别差异无统计学意义(t=1.546、χ2=1.319,均P>0.05),见表1。

Table 1 Comparison of basic information between HSP children and healthy children[±S,n(%)]
2.2 测序与质量控制
经测序获得RawReads共6 956 988条,优化后获得CleanReads共6 424 362条,平均每个样本98 836条,最多为112 856条/样本,最少为55 006条/样本,测序覆盖度较好,CleanReads经PEAR方法拼接后获得序列3 211 766条,总序列平均读长454.26bp,共注释获得OTU总数264。Shannon指数曲线随测序深度的增加趋向于平坦,表明测序数据足够大,足以反映各组微生物信息,见图1。

图1Shannon指数值与样品深度的关系
Fig.1RelationshipbetweenShannonindexandsampledepth
2.3 过敏性紫癜患儿与对照组儿童粪便菌群比较
2.3.1多样性分析
2.3.1.1OTU交叠Venn图 两组OTU总数为263,有179个OTU为两组所共有,有83个OTU为HSP患儿所独有,仅有1个OTU为对照组健康儿童所独有,提示两组间样本物种分布具有差异性,见如图2。
图2HSP患儿与对照组粪便菌群OTU交叠Venn图
Fig.2VenndiagramcomparingOTUbetweenHSPchildrenandhealthychildren
2.3.1.2比较两组样本OTU及Alpha多样性指数 经两独立样本t检验,P>0.05,差异均无统计学意义,见表2。
Table 2 Comparison of diversity of fecal flora between HSPchildren and healthy children(±S)
2.3.2 结构差异分析
2.3.2.1菌群结构 在门水平,两组均以厚壁菌门,变形菌门,拟杆菌门为主要优势菌群,见图3;在科水平,均以拟杆菌科、肠杆菌科、瘤胃菌科、毛螺菌科有较高的丰度,见图4。

图3 HSP与对照组粪便样本物种门水平分布柱状图
Fig.3 Species distribution histogram at phylum of stool samples of HSP children and healthy children

图4 HSP与对照组粪便样本物种科水平分布柱状图
Fig.4 Species distribution histogram at family of stool samples of HSP children and healthy children
2.3.2.2差异细菌种类 通过LefSe分析确定HSP患儿和对照组儿童粪便菌群在丰度上有显著差异的物种,见图5、图6。结果表明: HSP患儿粪便菌群中变形菌门、欧文氏菌属(从目到属)、拟杆菌属-uniformis种、巨单胞菌属、肠球菌属(从科到属)为主要特征差异细菌种类,而在对照组健康儿童粪便菌群中双歧杆菌属(从目到属)、链球菌属(从目到属)、普拉梭菌种(从科到种)为主要特征差异细菌种类。
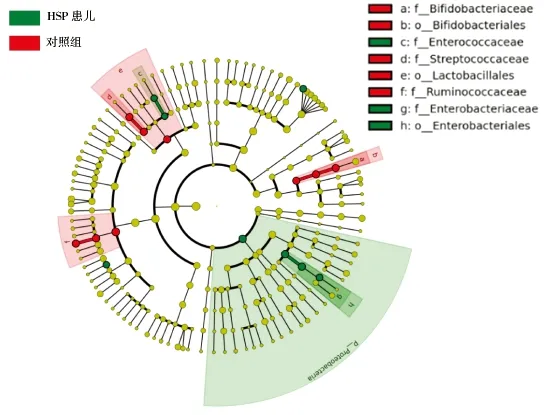
注:由内至外辐射的圆圈代表了不同的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比。着色原则:无显著差异的物种统一着色为黄色,差异物种随组进行着色,分别代表在该组中起到重要作用的微生物类群。图中英文字母表示的物种名称在右侧图例中进行展示。
图5 HSP与对照组粪便菌群LefSe进化分支图
Fig.5 LefSe evolutionary branch map in stool samples of HSP children and healthy children

注:横坐标表示物种的LDA得分,其中显著差异的LDA值设置为4,每个柱子表示一个物种。
图6 HSP与对照组粪便菌群LDA值分布柱状图
Fig.6 LDA value distribution histogram in stool samples of HSP children and healthy children
2.4腹型HSP患儿粪便与黏膜菌群差异
2.4.1 多样性分析
2.4.1.1OTU交叠Venn图 两组OTU总数为207,有92个OTU在两组所共有,有109个OTU为粪便菌群所独有,仅有6个OTU为黏膜菌群所独有,见图7,提示结肠黏膜菌群和粪便菌群分布具有差异性。
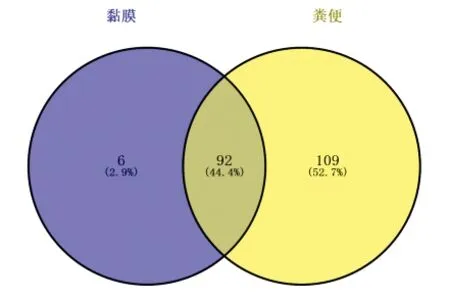
图7 腹型HSP患儿粪便菌群与结肠黏膜菌群OTU交叠Venn图
Fig.7 Venn diagram comparing OTU between fecal flora and mucosal flora in HSP children with abdominal symptoms
2.4.1.2腹型HSP患儿粪便菌群与结肠黏膜菌群OTU、Alpha多样性分析 比较OTU、chao1指数、observed_species指数、shannon指数、simpson指数差异经均有统计学意义(均P<0.01),粪便菌群多样性高于黏膜菌群。
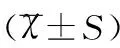
Table 3 Comparison of diversity between fecal flora and mucosal flora in HSP children with abdominal symptoms(±S)
2.4.2 结构差异分析
2.4.2.1菌群结构 在门水平,黏膜样本中变形菌门为优势菌群,而粪便样本中以厚壁菌门、变形菌门、拟杆菌门为主要优势菌群,见图8。在科水平,HSP患儿黏膜样本中肠杆菌科为优势菌群,而粪便中以肠杆菌科、瘤胃菌科、毛螺菌科、芽孢杆菌科、拟杆菌科有较高的丰度,见图9。

图8 腹型HSP患儿黏膜和粪便样本菌群门水平分布柱状图
Fig.8SpeciesdistributionhistogramatphylumoffecalfloraandmucosalflorainHSPchildrenwithabdominalsymptoms
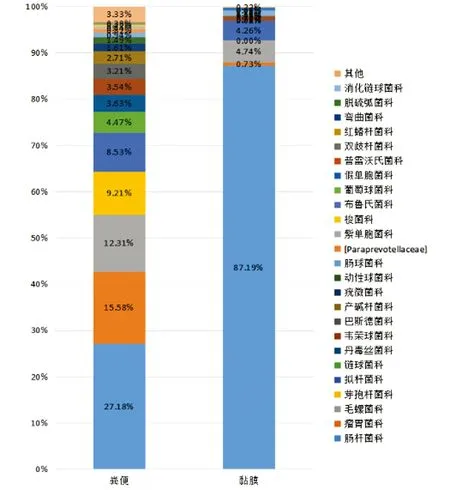
图9 腹型HSP患儿粪便和黏膜菌群科水平分布柱状图
Fig.9SpeciesdistributionhistogramatfamilyoffecalfloraandmucosalflorainHSPchildrenwithabdominalsymptoms
2.4.2.2差异细菌种类 通过LefSe分析确定HSP患儿粪便和黏膜菌群在丰度上有显著差异的物种,见图10、图11。结果显示:HSP患儿结肠黏膜菌群中欧文氏菌属(从门到属)为主要特征差异细菌种类,而HSP患儿粪便菌群中双歧杆菌属(从门到属)、链球菌属(从门到属)、动性球菌科(从门到科)、丹毒丝菌科(从门到科)、梭菌科(从门到科)、瘤胃菌科(从门到科)、厚毛螺菌科(从门到科)为主要特征差异细菌种类。

注:红色表示HSP患儿粪便样本,绿色表示HSP患儿结肠黏膜样本,由内至外辐射的圆圈代表了不同的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比。着色原则:无显著差异的物种统一着色为黄色,差异物种随组进行着色,分别代表在该组中起到重要作用的微生物类群。图中英文字母表示的物种名称在右侧图例中进行展示。
图10HSP患儿结肠黏膜菌群和粪便菌群LefSe进化分支图
Fig.10LefSeevolutionarybranchmapoffecalfloraandmucosalflorainHSPchildrenwithabdominalsymptoms

注:横坐标表示物种的LDA得分,其中显著差异的LDA值设置为4,每个柱子表示1个物种。
图11HSP患儿粪便和黏膜菌群LDA值分布柱状图
Fig.11LDAvaluedistributionhistogramoffecalfloraandmucosalflorainHSPchildrenwithabdominalsymptoms
3 讨论
随着人类微生物组计划的不断进展,目前越来越多的研究证明人类多种疾病与肠道菌群密切相关[4],肠道菌群的作用也有了新的诠释,微生物-肠-脑轴的提出,对部分神经系统疾病的发病机制提出了新的见解,并且指出了其新的治疗方向:益生菌。肠道菌群在免疫性疾病包括过敏性疾病如湿疹、哮喘[5]等及自身免疫性疾病如强直性脊柱炎[6]等疾病的发病中均发挥重要作用。HSP是一种具有遗传易感性人群在感染等因素诱发下,机体免疫功能出现异常,以致IgA免疫复合物在全身小血管壁沉积,促发炎症反应,而致系统性白细胞碎裂性小血管炎,其本质上也是一种免疫性疾病,肠道菌群紊乱可能发挥了极其重要的作用。
以往研究HSP肠道菌群[7-8]多应用变性梯度凝胶电泳、实时荧光定量聚合酶链式反应等传统分子生物学技术,这些技术具有其局限性,不能完整地反映整个群落的结构信息,且耗时长、工作量大。并且多对粪便标本中双歧杆菌、乳酸杆菌和大肠埃希菌等部分肠道细菌进行分析比较,不能完全表示肠道菌群结构变化。16SrDNA基因是编码原核生物核糖体16S亚基的基因,其可变区的V3~4区常作为人类肠道菌群分类的标志[9]。16SrDNA高通量测序技术可对数百万DNA分子同时测序,由于其测序深度大和准确性高等特点,目前被广泛用于微生物研究领域。
3.1 过敏性紫癜患儿与健康儿童粪便菌群种类分析
从OTU交叠Venn图看出HSP患儿粪便OTU(262)数值大于健康儿童(180),提示HSP患儿粪便菌群种类更加丰富,而统计学分析HSP患儿与对照组健康儿童粪便菌群OTU均值及Alpha多样性指数无差异,原因可能是,HSP患儿总体粪便菌群出现菌群种类较对照组健康儿童增多,但对于每个HSP患儿粪便菌群出现种类与对照组健康儿童无差异,提示HSP患儿粪便菌群在不同个体可能是成丛出现,即不同患儿之间菌群种类数目相似,但菌群种类不一致。
HSP患儿和对照组健康儿童粪便菌群在门水平上,均以厚壁菌门、变形菌门、拟杆菌门为主要优势菌群;在科水平上,均以肠杆菌科、拟杆菌科、瘤胃菌科、毛螺菌科有较高的丰度。对HSP患儿和对照组健康儿童粪便菌群分类学物种丰度差异进行比较,在门、目、科、属、种水平均发现具有统计学差异细菌。HSP患儿以变形菌门、欧文氏菌属(从目到属)、拟杆菌属-uniformis种、巨单胞菌属、肠球菌属(从科到属)为主要特征差异细菌种类,而对照组健康儿则以双歧杆菌属(从目到属)、链球菌属(从目到属)、普拉梭菌种(从科到种)为主要特征差异细菌种类。
本研究发现HSP患儿粪便菌群中变形菌门、欧文氏菌属(从目到属)、拟杆菌属-uniformis种、巨单胞菌属、肠球菌属(从科到属)丰度高于对照组健康儿童。变形菌门属革兰阴性杆菌,是兼性厌氧菌,包括多种病原微生物。变形杆菌在健康人体内较厚壁菌门和拟杆菌门丰度要少,但在人体口腔、皮肤、胃肠道、阴道等部位均可发现,其在口腔中丰度要高于其他部位,肠道内丰度较少,研究发现变形菌门丰度增高可作为肠道菌群紊乱的标志[10]。本研究也发现HSP患儿粪便菌群变形菌门丰度高于对照组健康儿童,再次说明HSP患儿存在肠道菌群紊乱。欧文氏菌属是变形菌门一个菌属,通常寄生于植物并可以引起植物腐败病,研究发现正常人及干眼症患者眼球表面[11]、牙龈炎患者龈下菌群中[12]存在欧文氏菌属的菌种,并可引起疾病如颈淋巴结炎[13];拟杆菌属-uniformis种是拟杆菌门一个菌种,被认为在肠道中可能与异黄酮的降解有关[14],部分菌株因含有β内酰胺酶或抗氯霉素质粒而对青霉素类和头孢类[15]、氯霉素[16]耐药,欧文氏菌属和拟杆菌属-uniformis种在肠道中的作用还需要进一步研究。巨单胞菌属是厚壁菌门的一个菌属,可存在于正常人体肠道菌群中,但在肠道中发挥的作用还不明确。研究发现,在湿疹患儿粪便中巨单胞菌属减少[17],在Behcet病粪便菌群中巨单胞菌属减少而双歧杆菌属增加[18]。肠球菌属是厚壁菌门的一个菌属,兼性厌氧菌,属机会致病菌,常存在于正常人体肠道中,肠球菌是目前医院内感染的最重要病原菌之一。
本研究还发现HSP患儿粪便菌群中双歧杆菌属(从目到属)、链球菌属(从目到属)、普拉梭菌种(从科到种)丰度低于对照组健康儿童,与以往研究HSP肠道菌群双歧杆菌及乳杆菌减少[7-8]一致。双歧杆菌是粘附于肠黏膜上皮的有益菌,粘附于结肠道黏膜上皮的双歧杆菌[19],可以消耗人乳中复杂寡糖,而使其成为母乳喂养婴儿肠道中最丰富的定植者;双歧杆菌能够抵抗肠道病原菌的定植和入侵、增强肠道上皮的屏障作用,其代谢产物还能够增强肠道的防御作用,研究发现,IBD肠道菌群中双歧杆菌较健康者降低,含有双歧杆菌的益生菌在诱导和维持溃疡性结肠炎缓解以及预防贮袋炎方面效果明显[20]。链球菌属是厚壁菌门的一个菌属,部分菌种可以引起人体疾病,如脑膜炎、肺炎、心内膜炎、结膜炎等,但大多数链球菌在体内并不致病,在人体皮肤、口腔、上呼吸道、胃肠道等部位构成与人体共生的正常菌群,并且在人乳中也含有链球菌[21]。普拉梭菌是厚壁菌门的一个菌种,是肠道中发现的最丰富的菌种之一,在维持肠道健康方面具有重要作用,是肠道主要的产丁酸菌,产生丁酸为肠细胞提供能量[22];在多种疾病状态下其丰度是降低的,并且认为普拉梭菌可以作为生物标志物来协助诊断肠道疾病[23]。瘤胃菌科是厚壁菌门的一个菌科,研究发现,在IBD和肝硬化肠道菌群中,瘤胃菌科也有较明显降低,且瘤胃菌科水平与肝硬化毒素血症及肝硬化患者严重评分呈负相关,显示瘤胃菌科具有保护作用[24]。
综上所述,HSP患儿粪便菌群中病原菌或条件致病菌增多,而有益菌减少,这种粪便菌群的变化可能在HSP的发病中发挥重要作用。在HSP患儿肠道,有益菌可能由于系统性血管炎致肠黏膜水肿出血、肠黏膜遭受损坏而失去黏附位置,有益菌的数量减少,以致病原菌或条件致病菌由于有益菌的竞争抑制作用减弱而增加,因此,是否能以增加外源性有益菌来调节肠道粪便菌群的结构,维持肠道菌群的稳定,以恢复HSP患儿免疫失衡状态,改善HSP患儿症状还需要进一步研究。
3.2腹型患儿粪便与黏膜菌群的差异性分析
腹型HSP患儿粪便和黏膜菌群分布具有差异:在总数207个OTU中仅92个OTU在黏膜菌群和粪便菌群中共同出现,粪便菌群OTU、Alpha多样性指数高于黏膜菌群;黏膜菌群中变形菌门(88.13%)丰度最高,而粪便菌群中厚壁菌门(53.64%)丰度最高,变形菌门丰度仅为33.65%;在科水平黏膜菌群肠杆菌科丰度为87.19%,而粪便菌群中肠杆菌科丰度仅为27.18%;对HSP患儿黏膜菌群和粪便菌群分类学物种丰度差异进行比较,在门、纲、目、科、属水平均发现具有统计学差异细菌。腹型患儿粪便菌群与结肠黏膜菌群结构及多样性存在较大差异。
肠道中的菌群在同段肠管中是分层分布的,内层靠近肠粘膜,包括双歧杆菌和乳酸杆菌等肠道共生菌,对正常生理功能的维持具有重要作用;中间层包括粪杆菌、消化链球菌等细菌;外层包括大肠杆菌、肠球菌等细菌。黏膜菌群由于直接和肠上皮黏膜接触,参与肠腔与黏膜代谢交换,维持肠道正常免疫耐受,充当肠道黏膜生物屏障,对于机体具有重要作用,黏膜菌群的变化对于机体整体正常功能的发挥以及疾病的发生发展均有重要影响。粪便是流体性混合物,与肠腔黏附性较低、变化快,一定程度上会影响微生物群落的构成变化,粪便样本只能部分反映肠道菌群变化情况。因此在研究中应综合考虑粪便和黏膜菌群结构变化,但在实际研究中,由于受到医学伦理学限制,并且部分家长也不愿意进行相应检查,因此只能以粪便菌群来表示肠道菌群。
本研究首次通过高通量测序技术对HSP患儿肠道粪便和黏膜菌群结构及多样性进行研究,发现HSP患儿粪便菌群病原菌或机会致病菌增多而有益菌较少,腹型HSP患儿粪便菌群和结肠黏膜菌群结构和多样性存在差异,粪便菌群不能完全代表肠道菌群,为认识肠道菌群多样性在HSP发病中的作用,探索微生态制剂及其他药物调节肠道菌群以治疗HSP、改善HSP预后提供理论依据。
[1]中华医学会儿科学分会免疫学组,《中华儿科杂志》编辑委员会.儿童过敏性紫癜循证诊治建议[J].中华儿科杂志,2013,51(7):502-507.
[2]Jennette J C, Falk R J, Bacon P A,etal. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J]. Arthritis Rheum, 2013,65(1):1-11.
[3]Ozen S, Pistorio A, Iusan S M,etal. EULAR/PRINTO/PRES criteria for Henoch-Sch?nlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis: Ankara 2008. Part II: final classification criteria[J]. Ann Rheum Dis, 2010,69(5):798-806.
[4]Tremlett H, Bauer K C, Appel-Cresswell S,etal. The gut microbiome in human neurological disease: a review[J]. Ann Neurol, 2017,81(3):369-382.
[][5]Dzidic M, Abrahamsson T R, Artacho A,etal. Aberrant IgA responses to the gut microbiota during infancy precede asthma and allergy development[J]. J Allergy Clin Immunol,2017,139(3):1017-1025.
[6]Yang L, Wang L, Wang X,etal. A Possible role of intestinal microbiota in the pathogenesis of ankylosing spondylitis[J]. Int J Mol Sci, 2016,17(12):2126.
[7]娄俊丽, 黄永坤, 刘梅, 等. 住院8天过敏性紫癜患儿肠道菌群的变化研究[J]. 中国微生态学杂志, 2009,21(5):410-414.
[8]梁庆红, 王烨, 张莹, 等. 过敏性紫癜儿童肠黏膜屏障与Treg/Th17作用关系的研究[J]. 中国微生态学杂志, 2015,27(9):1022-1026.
[9]Fadrosh DW, Ma B, Gajer P,etal. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J]. Microbiome, 2014,2(1):6.
[10]Shin N R, Whon T W, Bae J W. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends Biotechnol, 2015,33(9):496-503.
[11]Graham J E, Moore J E, Jiru X,etal. Ocular pathogen or commensal: a PCR-based study of surface bacterial flora in normal and dry eyes[J]. Invest Ophthalmol Vis Sci, 2007,48(12):5616-5623.
[12]Gamboa F, García D A, Acosta A,etal. Presence and antimicrobial profile of gram-negative facultative anaerobe rods in patients with chronic periodontitis and gingivitis[J]. Acta Odontol Latinoam, 2013,26(1):24-30.
[13]Shin S Y, Lee M Y, Song J H,etal. New Erwinia-like organism causing cervical lymphadenitis[J]. J Clin Microbiol, 2008,46(9):3156-3158.
[14]Renouf M, Hendrich S. Bacteroides uniformis is a putative bacterial species associated with the degradation of the isoflavone genistein in human feces[J]. J Nutr, 2011,141(6):1120-1126.
[15]Hedberg M, Lindqvist L, Bergman T,etal. Purification and characterization of a new beta-lactamase from Bacteroides uniformis[J]. Antimicrob Agents Chemother, 1995,39(7):1458-1461.
[16]Martínez-Suárez J V, Baquero F, Reig M,etal. Transferable plasmid-linked chloramphenicol acetyltransferase conferring high-level resistance in Bacteroides uniformis[J]. Antimicrob Agents Chemother, 1985,28(1):113-117.
[17]王和平, 王玉蕾, 郑跃杰, 等. 湿疹患儿肠道菌群高通量测序初步探索[J]. 中国微生态学杂志, 2016,28(7):751-755.
[18]Shimizu J, Kubota T, Takada E,etal. Bifidobacteria abundance-featured gut microbiota compositional change in patients with Behcet’s disease[J]. PLoS One, 2016,11(4):e153746.
[19]Chichlowski M, De Lartigue G, German J B,etal. Bifidobacteria isolated from infants and cultured on human milk oligosaccharides affect intestinal epithelial function[J]. J Pediatr Gastroenterol Nutr, 2012,55(3):321-327.
[20]薛爱娟, 黄瑛. 益生菌在儿童炎症性肠病的应用[J]. 中国实用儿科杂志, 2017,32(2):101-103.
[21]McGuire M K, McGuire M A. Got bacteria? The astounding, yet not-so-surprising, microbiome of human milk[J]. Curr Opin Biotechnol, 2017,44:63-68.
[22]Qiu X, Zhang M, Yang X,etal. Faecalibacterium prausnitzii upregulates regulatory T cells and anti-inflammatory cytokines in treating TNBS-induced colitis[J]. J Crohns Colitis, 2013,7(11):e558-e568.
[23]Lopez-Siles M, Duncan S H, Garcia-Gil L J,etal. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics[J]. ISME J, 2017,11(4):841-852.
[24]Bajaj J S, Ridlon J M, HylemonP B,etal. Linkage of gut microbiome with cognition in hepatic encephalopathy[J]. Am J Physiol Gastrointest Liver Physiol, 2012,302(1):G168-G175.
[专业责任编辑:刘黎明]
Structure and diversity of intestinal flora in children with Henoch-Schönlein purpura
CHEN Peng-de, LIN Yan, YANG Jie, HAO Li-jun, LEI Da, LAN Li, JIANG Xun, WANG Bao-xi
(Department of Pediatrics, Tangdu Hospital of Fourth Military Medical University, Shaanxi Xi’an 710038, China)
Objective To study the structure and diversity of intestinal flora and structure and diversity difference of fecal flora and mucosal flora in children with Henoch-Schönlein purpura (HSP). Methods Stool samples from 47 children with HSP were collected, including colon mucosa samples from 7 HSP children with abdominal symptoms, and stool samples from 11 healthy children were used as controls. DNA of samples was extracted using extraction kit method and subjected to high throughput sequencing, and biological information analysis was conducted on results.Results Structure of fecal flora was different between HSP children and healthy children. Predominant bacteria in two groups were Firmicutes (47.10%, 57.75%), Proteobacteria (23.04%, 10.13%) and Bacteroidetes (22.81%, 21.74%) at phylum, and Enterobacteriaceae (17.60%, 8.72%), Bacteroidaceae (18.90%, 21.65%), Ruminococcaceae (16.44%, 28.93%), Lachnospiraceae (11.55%, 10.74%) were more abundant at family. Abundances of Proteobacteria, Erwinia (from order to family), B-uniformis, Megamonas and Enterococcus (from family to genus) in fecal flora of HSP children were higher than those of children in the control group, while abundances of Streptococcus (from order to family), Bifidobacterium (from order to family) and F.prausnitzii (from family to species) in HSP children were lower than those in children in the control group. Diversity of fecal flora was higher than that of mucosal flora in HSP children with abdominal symptoms. Abundances of Firmicutes (53.64%), Proteobacteria (33.65%) and Bacteroidetes (9.24%) were higher in fecal flora at phylum, while abundance of Proteobacteria (88.13%) was higher in mucosal flora. Predominant bacteria in fecal flora were Enterobacteriales (27.18%), Ruminococcaceae (15.58%) and Lachnospiraceae (12.31%) at family, while predominant bacteria in mucosal flora was Enterobacteriaceae (87.19%). Bifidobacterium (from phylum to genus), Streptococcus (from phylum to genus), Planococcaceae (from phylum to family), Erysipelotrichaceae (from phylum to family), Clostridiaceae (from phylum to family), Ruminococcaceae (from phylum to family) and Lachnospiraceae (from phylum to family) were major in fecal flora, while Erwinia (from phylum to genus) was the major bacteria in mucosal flora. Conclusion Pathogenic bacteria or opportunistic pathogen are increased and beneficial bacteria are reduced in feces of children with HSP. Structure and diversity of fecal flora and mucosal flora are different in HSP children with abdominal symptoms.
Henoch-Schönlein purpura (HSP); intestinal flora; flora structure; flora diversity; high-throughput sequencing
2017-06-20
国家自然科学基金资助项目(编号:81370490)
陈鹏德(1986-),医师,在读硕士研究生,主要从事小儿消化系统疾病及肠道微生态的研究。
王宝西,教授/主任医师。
10.3969/j.issn.1673-5293.2017.07.001
R725
A
1673-5293(2017)07-0747-06
