FAT10在结直肠癌中的表达及其临床病理意义
2017-08-25张春阳王星孙洁王翠芳
张春阳,王星,孙洁,王翠芳
(1.沈阳医学院附属中心医院 急诊科,辽宁 沈阳 110024;2.病理科)
结直肠癌是胃肠道最常见的恶性肿瘤,居男性恶性肿瘤的第4位,居女性第3位。世界范围内的死亡率约为发病率的1/2,虽然治疗方法不断改进,但其预后并不乐观。结直肠癌的病因和发病机制与环境和遗传两种因素有关:前者主要是饮食,尤其是脂肪和动物蛋白;遗传因素本身以多种方式表现,最众所周知的是结直肠癌好发于家族性腺瘤性息肉患者和Lynch综合征患者,其他息肉病类型癌发生的比例非常低。基因水平上的研究发现,结直肠癌的发生发展是一个复杂的过程,涉及原癌基因的激活、抑癌基因的失活、突变以及凋亡基因的失调等。
泛素是细胞周期的关键调节因子,近年来越来越多的一些与泛素相关的低分子量蛋白,即泛素样蛋白被鉴定出来,它们与多种细胞进程有关。迄今为止,两个泛素样蛋白家族被鉴定出来,分别命名为泛素样修饰蛋白(the ubiquitin-like modifiers,UBLs)和泛素域蛋白(ubiquitin-domain proteins,UDPs)[1]。
FAT 10也称双泛素,属于泛素样蛋白的UBL家族。FAT 10是一个18 kD的蛋白,与泛素在N端和C端分别有29%和36%的同源性,最初认为它是定位于6号染色体的主要组织相容性复合体的一个基因[2]。尽管FAT 10的功能并未完整阐明,但有研究显示它在多种细胞进程中发挥了重要作用。本研究应用免疫组化法检测FAT 10在结直肠癌及癌旁组织中的表达情况,分析FAT 10的表达与结直肠癌临床病理资料之间的关系。
1 资料与方法
1.1 结直肠癌组织标本
收集本院2010年3月-2011年3月结直肠癌患者外科手术切除标本61例,所有患者术前均未接受放、化疗。其中男38例,女23例。患者中位年龄67岁(39~97岁)。中位肿瘤大小50 mm(25~110 mm)。高中分化46例,低分化15例。临床分级Ⅰ期和Ⅱ期共22例,Ⅲ期和Ⅳ期共39例。淋巴结转移38例,无淋巴结转移23例。癌旁组织为距癌2 cm内的组织,正常结直肠黏膜组织取自手术切除标本切缘组织(距癌>5 cm)。所收集标本均于手术切除后迅速保存于液氮中备用。
1.2 免疫组织化学染色及结果判定
组织标本经中性福尔马林溶液固定,石蜡包埋,制成4μm厚切片。切片经二甲苯脱蜡,梯度酒精脱苯、水化后,采用链霉素抗生物素蛋白-过氧化物酶法(S-P法)检测FAT 10蛋白的表达。一抗为鼠抗人FAT10单克隆抗体 (1:200,Santa Cruz公司),DAB显色,以细胞核中出现棕黄色颗粒为阳性显色。高倍视野(×400)下选阳性信号最强区域计数200个肿瘤细胞中阳性细胞数,按FAT10表达百分率分为以下五个等级:0%为0分,≤10%为1分,10%~50%为2分,51%~80%为3分,≥80%为4分。根据免疫组化染色强度分为四个等级:无染色为0分,浅棕黄色计为1分,棕黄色计为2分,黄褐色计为3分。以阳性细胞率和染色强度的分值之和 0,1,2,3,4,5,6,7 作为每一例的染色评分(IS,Immunoreactive score),得分<4判定为阴性,积分≥4为阳性。
1.3 统计学分析
采用SPSS 21.0统计学分析软件,数据用均数±标准差表示。对FAT10表达及其与临床病理因素之间关系采用χ2检验,两组间均数比较采用t检验,多组间均数比较采用方差分析,两两比较方差齐时采用LSD检验,方差不齐时采用Tamhane’s检验。检验水准α=0.05。
2 结果
2.1 FAT 10在结直肠癌组织中高表达
免疫组化结果显示,正常结直肠黏膜及癌旁组织的细胞核中分别只有4例(6.56%)和11例(18.03%)FAT10呈核阳性,且多为弱阳性,其余均为阴性(图1A)。按上述免疫组化染色评分,正常结直肠黏膜组织中只有1例(1.64%)、癌旁组织中有6例(9.84%)的FAT10表达可认为是阳性。结直肠癌中有46例FAT 10呈核阳性表达(75.41%),其中有39例为均匀的中等到强阳性(63.93%)(图1 B)。结直肠癌组织与其对应的癌旁组织和正常结直肠黏膜组织相比,差异均有统计学意义(P<0.05),癌旁组织与其对应的正常结直肠黏膜相比,差异无统计学意义(P>0.05)(表 1,图 2)。
2.2 结直肠癌中FAT10的表达与肿瘤分期及淋巴结转移相关
在61例结直肠癌中,我们对FAT10的表达与一些临床病理学参数(包括年龄、性别、肿瘤大小、肿瘤分期、分化以及淋巴结转移情况)之间关系进行分析,结果发现FAT10的表达与肿瘤临床分期及淋巴结转移相关(表2)。
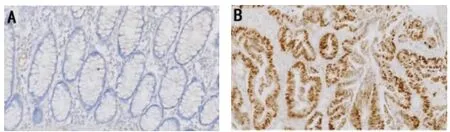
图1免疫组织化学(S-P法)检测FAT10在结直肠组织中的表达(原始放大倍数:100×);A FAT10在结肠癌旁组织中阴性表达;B FAT10在中分化结肠腺癌中呈强阳性表达

图2 FAT 10在正常结直肠黏膜组织、癌旁组织及结直肠癌中表达的半定量分析
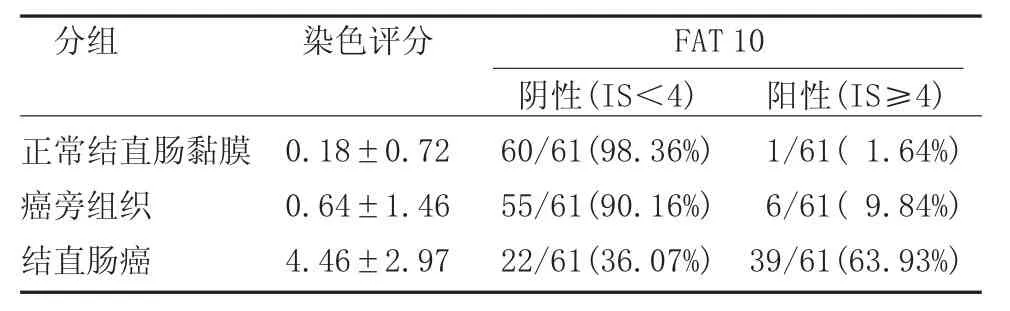
表1 FAT 10在结直肠组织中的表达(x±s)

表2 61例结直肠癌中FAT 10表达与临床病理学参数相关性分析
3 讨论
FAT10,泛素化调节蛋白,调节多种细胞进程,包括有丝分裂、染色体稳定性、凋亡、免疫控制和26S蛋白酶体介导的蛋白质转换[3,4]。FAT 10能够与人纺锤体聚集检测点蛋白(mitotic arrest deficie-ncy 2,MAD 2)非共价结合,而此蛋白负责在有丝分裂时保持纺锤体的完整性,MAD 2功能受到抑制则导致染色体不稳定,这是许多肿瘤发生的重要特征[5]。
已在一些恶性肿瘤中发现FAT 10基因过度表达,其过度表达可导致致癌细胞及非致癌细胞恶变[6],并与人纺锤体聚集检测点蛋白(mitotic arrest deficiency 2,MAD 2)非共价结合,而此蛋白负责在有丝分裂时保持纺锤体的完整性[7],这其中包括胃肠道和妇科的恶性肿瘤。有报道称IFN-γ和TNF-α能够上调FAT 10基因表达[2,6,10]。并已经确定为FAT 0的相互作用蛋白[12],而P 53在调节细胞周期过程中发挥重要作用[13]。一些恶性肿瘤中FAT 10的异常高表达,细胞周期前中期细胞中高表达FAT 10蛋白,MAD 2着丝粒位点所导致的非染色体分离有丝分裂和染色体不稳定性,并且FAT 10的表达受TNF-α(一个假定的肿瘤启动子)正调节[4,14],受P 53(基因组的守护者)负调节[15],这些都提示FAT 10在调控细胞周期和肿瘤发生中发挥重要作用。
我们的实验结果显示,FAT 10蛋白在结直肠正常黏膜组织、癌旁组织和结直肠癌中的阳性表达率逐渐增高,提示FAT 10表达增加在结直肠癌的癌变过程中可能发挥了重要作用。
此外,在61例结直肠癌中,我们对FAT 10的表达与一些临床病理学参数(包括年龄、性别、肿瘤大小、肿瘤分期、分化以及淋巴结转移情况)之间关系进行分析,结果发现FAT 10的表达与肿瘤的临床分期及淋巴结转移相关。临床分期Ⅲ+Ⅳ期的结直肠癌中FAT 10表达明显高于临床分期Ⅰ+Ⅱ期,差异有统计学意义;有淋巴结转移的结直肠癌更易于表达FAT 10。这些在一定程度上说明了FAT 10与结直肠癌的恶性程度及癌细胞的侵袭、增殖密切相关。
综上所述,FAT 10作为一个泛素样修饰蛋白,与多种肿瘤的发生发展密切相关,本研究发现FAT 10在结直肠癌中表达增高,且与结直肠癌的临床分期及淋巴结转移密切相关。因此,深入研究探讨FAT 10在结直肠癌发生发展中的作用及其机制,尤其是其与细胞周期的关系,明确FAT 10在结直肠癌中的诊断、预后及治疗价值将是十分必要的,这也是我们下一步研究的目标。
[1]Jentsch S,Pyrowolakis G.Ubiquitin and its kin:how close arethe family ties[J].Trends Cell Biol 2000,10(3):335-342.
[2]Fan W,Cai W,Parimoo S,et al.Identification of sevennew human MHC class I region genesaround the HLA-F locus[J].Immunogenetics,1996,44(1):97-103.
[3]Ren J,Kan A,Leong SH,er al.J Biol Chem[J].2006,281(114):11413-11421.
[4]Raasi S,Schmidtke G,de Giuli R,et al.A ubiquitin-like protein which is synergistically inducible by interferon-gamma and tumor necrosis factor-alpha[J].Eur J Immunol,1999,12(40):4030-4036.
[5]Liu YC,Pan J,Zhang C,et al.A MHC-encoded ubiquitinlike protein(FAT10)binds noncovalentlyto the spindle assembly checkpoint protein MAD2[J].Proc Natl Acad Sci U SA.1999,96(43):4313-4318.
[6]Gao Y,Theng S.FAT10,an Ubiquitin-like Protein,Confers Malignant Properties in Non-tumorigenic and Tumorigenic Cells[J].Carcinogenesis,2015,35(4):923-934.
[7]Gao Y.Theng S Silibinin down-regulates FAT10 and modulate TNF-alpha/IFN-gamma-induced chromosomal instability and apoptosis sensitivity Biol[J].Open,2015,4(8):961-969.
[8]Bates EE,Ravel O,Dieu MC,et al.Identification andanalysis of a novel member of the ubiquitin family expressedin dendritic cells and mature B cells[J].Eur J Immunol,1997,27(24):2471-2477.
[9]AichemA,KalveramB,SpinnenhirnV,etal.Theproteomic analysis of endogenous FAT10 substrates identifies p62/SQSTM1 as a substrate of FAT10ylation[J].J Cell Sci.125,4576-4585.
[10]Szlosarek PW,Balkwill FR.Tumour necrosis factor alpha:apotentialtargetforthetherapyofsolid tumours[J].Lancet Oncol,2003,4:565-573.
[11]Lane DP.Guardian of the genome[J].Nature,1992,358(1):15-16.
[12]Dyczkowski J,Vingron M.Comparative analysis of cell cycle regulatedgenes in eukaryotes[J].Genome Inform Ser Workshop GenomeInform,2005,16(1):125-131.
