Secukinumab治疗成人中重度银屑病疗效和安全性的Meta分析
2017-08-24田怀平唐跃年
李 超 田怀平 唐跃年
·论著·
Secukinumab治疗成人中重度银屑病疗效和安全性的Meta分析
李 超 田怀平 唐跃年
目的:评价Secukinumab治疗成人中重度银屑病的疗效和安全性。方法:计算机检索PubMed、EMBASE、Cochrane图书馆、中国知网、维普期刊数据库、万方医学数据库、中国生物医学文献数据库有关Secukinumab治疗成人中重度银屑病的随机对照试验文献,时间为数据库建库时间至2017年2月,由两名独立的研究员对纳入的文献进行质量评价,用RevMan 5.3软件进行Meta分析。结果:分析共纳入7篇文献、3474例成人中重度银屑病患者。Meta分析结果显示,300 mg Secukinumab治疗组中PASI积分下降75% 、90%和100%的患者例数和研究者全面评估(IGA)分数为0或1的患者例数高于150 mg Secukinumab治疗组及安慰剂组,差异均有统计学意义(P<0.00001)。300 mg和150 mg Secukinumab治疗组中患者不良反应发生率明显高于安慰剂组,但 300 mg Secukinumab治疗组和150 mg Secukinumab治疗组间不良反应发生率差异无统计学意义。结论:300 mg Secukinumab治疗中重度银屑病疗效明显优于150 mg Secukinumab,不良反应发生率无明显差异。
Secukinumab; 银屑病; 成人; Meta分析
银屑病是一种免疫细胞介导的慢性、复发性、炎症性皮肤病,具有一定的遗传性。它的主要特征是角质形成细胞过度生长和分化,但是经过治疗可完全逆转这种现象。角质形成细胞的过度生长和分化反应激活了细胞免疫系统,与T细胞、树突状细胞和各种免疫相关的细胞因子和趋化因子密切相关[1]。目前认为银屑病发病机制的关键因子是T细胞,皮肤炎性浸润的T细胞是IL-17A在银屑病中的主要来源[2]。研究显示,缺乏IL-17RA的小鼠经咪喹莫特诱导后,不能形成类似银屑病的病理特征,小鼠表皮中的IL-17A、IL-17F的表达减少[3],而且在银屑病患者外周血和皮损处IL-17A均明显增高[4]。这提示IL-17A在银屑病的发病机制中有重要作用,可以通过抑制IL-17A的信号通路治疗银屑病。Secukinumab是一种完全人源化抗IL-17的单克隆抗体,能够选择性中和IL-17A。Secukinumab已经被美国FDA于2015年1月批准用于治疗成人中重度斑块型银屑病。已有多项临床试验证明Secukinumab对银屑病具有良好的疗效,本文对Secukinumab治疗成人中重度斑块型银屑病的疗效和安全性进行了系统评价,进一步为Secukinumab治疗银屑病提供依据。
1 资料与方法
1.1 文献检索与筛查 计算机检索PubMed、EMBASE、Cochrane图书馆、中国知网、维普期刊数据库、万方医学数据库、中国生物医学文献数据库。以Secukinumab和psoriasis为英文关键词,采用主题词结合自由词的方式搜索英文文献,在中文数据库中搜索Secukinumab和银屑病,纳入已公开发表的文献。
1.2 文献纳入与排除标准
1.2.1 纳入标准 (1)研究类型:随机对照试验;(2)研究对象:中重度斑块型银屑病患者,银屑病皮损面积和严重程度指数( psoriasis area and severity index, PASI )评分≥12分,病程≥6个月,年龄≥18岁;(3)干预措施:试验组为给予Secukinumab治疗,对照组为安慰剂治疗;(4)结局指标:经药物治疗后的疗效评价指标为PASI评分下降75%、90%、100%的患者例数(以PASI 75、PASI 90、PASI 100表示)和研究者全面评估(Investigator’s Global Assessment, 2011 modified version,IGA mod 2011)分数为0或1的患者例数(以IGA 0 or 1表示),安全性评价指标为不良反应发生率。
1.2.2 排除标准 (1)银屑病型关节炎;(2)与其它具有治疗作用药物的对比研究;(3)回顾性研究;(4)只有摘要而缺乏全文;(5)重复发表。
1.3 资料提取 确定纳入的文献后,使用统一设计的数据收集表,由两位研究者分别对每个随机对照研究的题目和摘要进行审查和评价,阅读全文提取数据资料,内容包括:样本的入选标准和样本量;受试者的基本信息,治疗方案、疗效指标等。如资料提取中存在争议,通过与第三方讨论解决分歧。
1.4 文献质量评价 按照Cochrane系统评价员手册所表述的质量评价标准,对纳入的文献进行质量评价。评分标准基于以下6点,主要评价项目包括:(1)研究的随机方法是否恰当;(2)是否做到分配隐藏;(3)是否正确采用双盲法;(4)数据是否完整,有无失访或者退出;(5)是否存在选择偏倚;(6)是否存在其他偏倚。根据文献内容中是、否以及未提及来进行文献等级划分,分A、B、C三等。若满足全部6个条件,则为A等,满足3个及以上条件为B等,3个以下则为C等。
1.5 统计学方法 采用RevMan 5.3软件对纳入文献进行Meta分析。计算差值比(odd ratio,OR) 及其95%可信区间(confudence interval,CI)。异质性检验(Heterogeneity test):纳入研究间的异质性检验,评估异质性大小,如P>0.05且I2<50%则提示无明显异质性,采用固定效应模型(fixed model)进行分析; 反之,则有统计学异质性,采用随机效应模型(random model)进行分析。
2 结果
2.1 纳入研究的基本情况及质量评价 经过筛选,最终纳入7篇文献含8个临床试验研究进行Meta分析[5-11],均为随机、对照试验,研究对象为临床诊断时中重度银屑病患者,总计纳入3474例接受Secukinumab治疗的患者。根据文献质量评判标准,7篇文献均为高质量研究,评判结果为B等,一般情况见表1。
2.2 临床疗效
2.2.1 PASI 75 4篇文献共5项临床试验研究均比较了300 mg Secukinumab与安慰剂的治疗后PASI 75的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.35,I2=10%),采用固定效应模型分析;6篇文献共7项临床试验研究均比较了150 mg Secukinumab与安慰剂的治疗后PASI 75的情况[5-10],异质性分析结果显示各研究间不存在明显异质性(P=0.64,I2=0%),采用固定效应模型分析;5篇文献共6项临床试验研究均比较了300 mg Secukinumab与150 mg Secukinumab的治疗后PASI 75的情况[5-7,9,11],异质性分析结果显示各研究间不存在明显异质性(P=0.91,I2=0%),采用固定效应模型分析。Meta分析结果显示:300 mg Secukinumab与安慰剂组间的PASI 75有统计学差异[OR=92.66,95%CI:(61.54,139.53),P<0.00001](图1a);150 mg Secukinumab与安慰剂组间的PASI 75有统计学差异[OR=54.80,95%CI:(37.29,80.55),P<0.00001](图1b);300 mg Secukinumab与150 mg Secukinumab组间的PASI 75有统计学差异[OR=1.71,95%CI:(1.40,2.09),P<0.00001](图1c)。
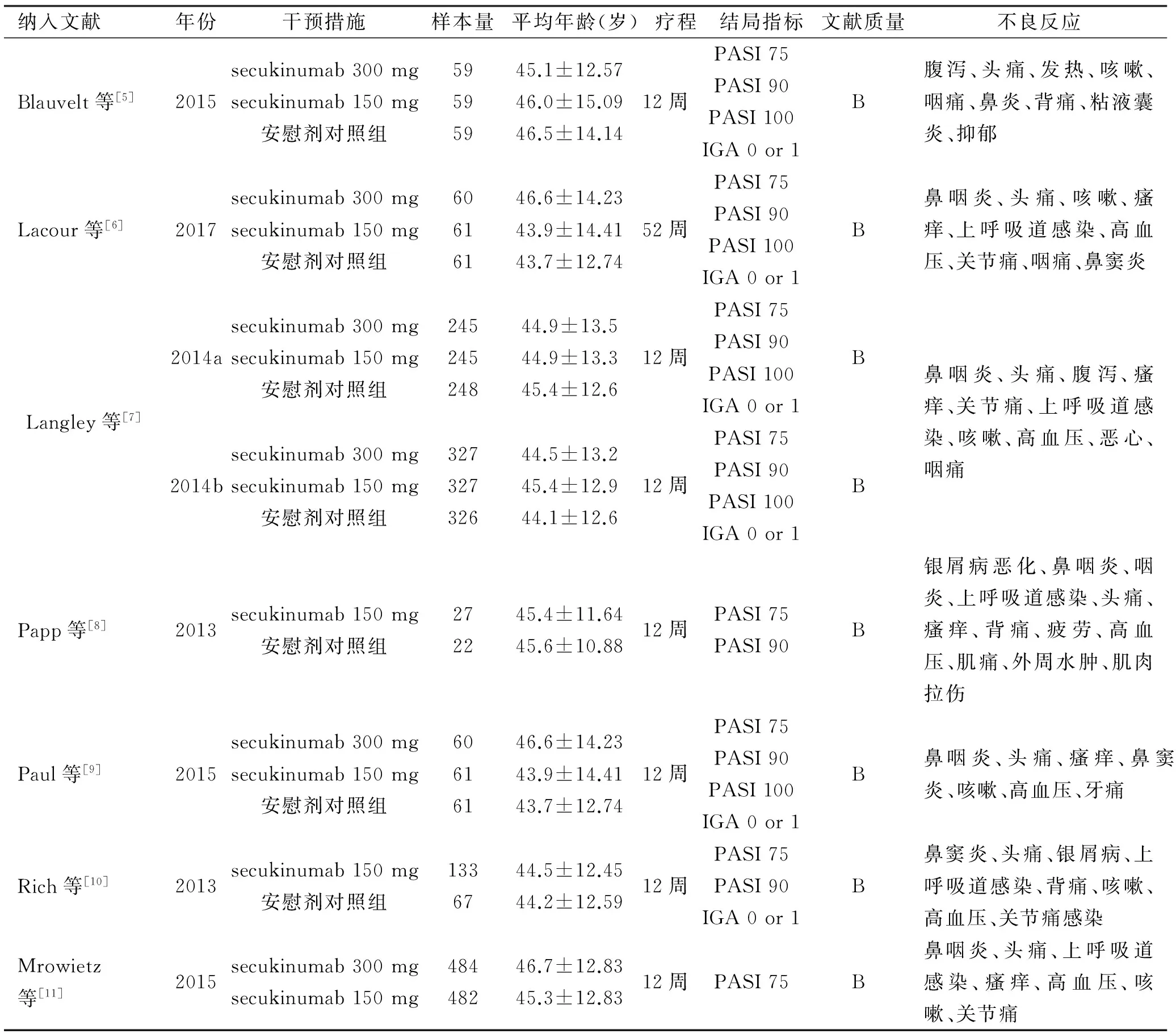
表1 纳入研究的基本信息及质量评分
2.2.2 PASI 90 4篇文献共5项临床试验研究均比较了300 mg Secukinumab与安慰剂的治疗后PASI 90的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.92,I2=0%),采用固定效应模型分析;6篇文献共7项临床试验研究均比较了150 mg Secukinumab与安慰剂的治疗后PASI 90的情况[5-10],异质性分析结果显示各研究间不存在明显异质性(P=0.95,I2=0%),采用固定效应模型分析;4篇文献共5项临床试验研究均比较了300 mg Secukinumab与150 mg Secukinumab的治疗后PASI 90的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.74,I2=0%),采用固定效应模型分析。Meta分析结果显示:300 mg Secukinumab与安慰剂组间的PASI 90有统计学差异[OR=102.74,95%CI:(53.39,197.69),P<0.00001](图2a);150 mg Secukinumab与安慰剂组间的PASI 90有统计学差异[OR=50.41,95%CI:(27.68,91.83),P<0.00001](图2b);300 mg Secukinumab与150 mg Secukinumab组间的PASI 90有统计学差异[OR=1.84,95%CI:(1.50,2.26),P<0.00001](图2c)。
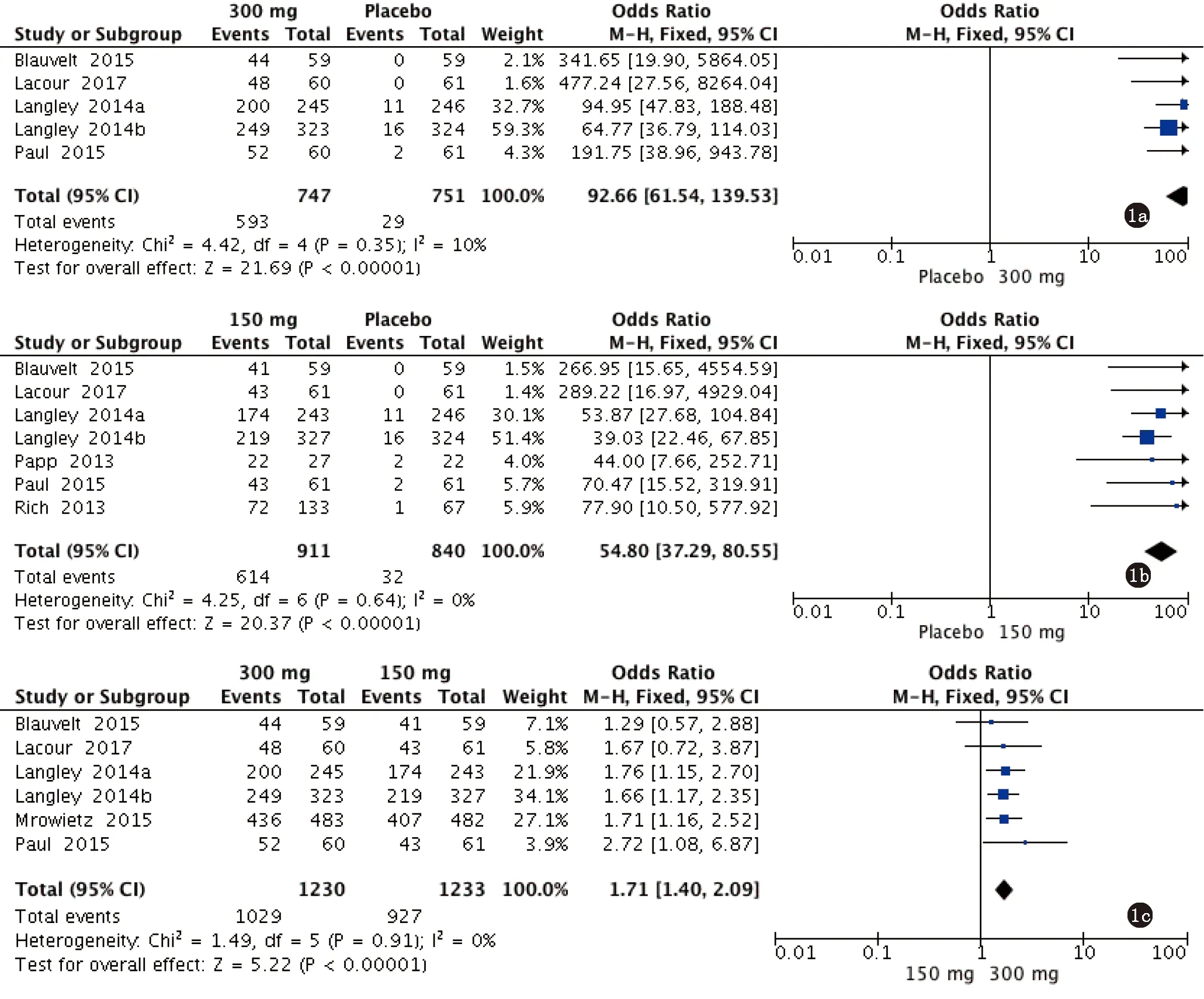
a.300 mg Secukinumab组vs安慰剂组;b.150 mg Secukinumab组vs安慰剂组;c.300 mg Secukinumab组vs 150 mg Secukinumab组图1 Secukinumab治疗中重度斑块型银屑病的达到PASI 75患者例数的Meta分析
2.2.3 PASI 100 4篇文献共5项临床试验研究均比较了300 mg Secukinumab与安慰剂的治疗后PASI 100的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.91,I2=0%),采用固定效应模型分析;4篇文献共5项临床试验研究均比较了150 mg Secukinumab与安慰剂的治疗后PASI 100的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.73,I2=0%),采用固定效应模型分析;4篇文献共5项临床试验研究均比较了300 mg Secukinumab与150 mg Secukinumab的治疗后PASI 100的情况[5-7,9],异质性分析结果显示各研究间存在明显异质性(P=0.08,I2=52%),采用随机效应模型分析。Meta分析结果显示:300 mg Secukinumab与安慰剂组间的PASI 100有统计学差异[OR=77.36,95%CI:(28.39,210.80),P<0.00001](图3a);150 mg Secukinumab与安慰剂组间的PASI 100有统计学差异[OR=33.21,95%CI:(12.20,90.40),P<0.00001](图3b);300 mg Secukinumab与150 mg Secukinumab组间的PASI 100有统计学差异[OR=2.35,95%CI:(1.55,3.56),P<0.0001](图3c)。

a.300 mg Secukinumab组vs安慰剂组;b.150 mg Secukinumab组vs安慰剂组;c.300 mg Secukinumab组vs 150 mg Secukinumab组图2 Secukinumab治疗中重度斑块型银屑病的达到PASI 90患者例数的Meta分析
2.2.4 IGA 0 or 1 4篇文献共5项临床试验研究均比较了300 mg Secukinumab与安慰剂的治疗后IGA 0 or 1的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.53,I2=0%),采用固定效应模型分析;5篇文献共6项临床试验研究均比较了150 mg Secukinumab与安慰剂的治疗后IGA 0 or 1的情况[5-7,9,10],异质性分析结果显示各研究间不存在明显异质性(P=0.82,I2=0%),采用固定效应模型分析;4篇文献共5项临床试验研究均比较了300 mg Secukinumab与150 mg Secukinumab的治疗后IGA 0 or 1的情况[5-7,9],异质性分析结果显示各研究间不存在明显异质性(P=0.85,I2=0%),采用固定效应模型分析。Meta分析结果显示:300 mg Secukinumab与安慰剂组间的IGA 0 or 1有统计学差异[OR=81.53,95%CI:(49.08,135.43),P<0.00001](图4a);150 mg Secukinumab与安慰剂组间的IGA 0 or 1有统计学差异[OR=46.50,95%CI:(28.31,76.40),P<0.00001](图4b);300 mg Secukinumab与150 mg Secukinumab组间的IGA 0 or 1有统计学差异[OR=1.77,95%CI:(1.44,2.18),P<0.00001](图4c)。

a.300 mg Secukinumab组vs安慰剂组;b.150 mg Secukinumab组vs安慰剂组;c.300 mg Secukinumab组vs 150 mg Secukinumab组图3 Secukinumab治疗中重度斑块型银屑病的达到PASI 100患者例数的Meta分析
2.3 药物安全性评价 4篇文献共5项临床试验研究均比较了300 mg Secukinumab与安慰剂的治疗后不良反应发生率的情况[5,7,9],异质性分析结果显示各研究间存在明显异质性(P=0.005,I2=81%),采用随机效应模型分析;5篇文献共6项临床试验研究均比较了150 mg Secukinumab与安慰剂的治疗后不良反应发生率的情况[5,7-10],异质性分析结果显示各研究间存在明显异质性(P=0.002,I2=77%),采用随机效应模型分析;5篇文献研究均比较了300 mg Secukinumab与150 mg Secukinumab的治疗后不良反应发生率的情况[5-7,9,11],异质性分析结果显示各研究间不存在明显异质性(P=0.35,I2=10%),采用固定效应模型分析。Meta分析结果显示:300 mg Secukinumab与安慰剂组间的不良反应发生率有统计学差异[OR=2.18,95%CI:(1.00,4.78),P=0.05](图5a);150 mg Secukinumab与安慰剂组间的不良反应发生率有统计学差异[OR=1.76,95%CI:(0.96,3.25),P=0.07](图5b);300 mg Secukinumab与150 mg Secukinumab组间的不良反应发生率无统计学差异[OR=1.09,95%CI:(0.91,1.31),P=0.32](图5c)。
3 讨论
治疗银屑病的传统药物有糖皮质激素、甲氨蝶呤、环孢素、非类固醇类抗炎药等,当一线治疗失败后,生物药物就会用于银屑病的后续治疗。目前研究较多的生物制剂有TNF抑制剂(infliximab、etanercept)、IL-12/IL-23抑制剂(Ustekinumab)、IL-17受体抑制剂(Brodalumab),本文中的Secukinuab是IL-17抑制剂,暂时还未引进我国。希望通过本文系统评价Secukinuab用于中重度斑块型银屑病治疗的临床疗效和安全性,为临床应用提供循证医学证据。

a.300 mg Secukinumab组vs安慰剂组;b.150 mg Secukinumab组vs安慰剂组;c.300 mg Secukinumab组vs 150 mg Secukinumab组图4 Secukinumab治疗中重度斑块型银屑病的达到IGA 0 or 1患者例数的Meta分析
本研究以患者PASI 75、PASI 90、PASI 100、IGA 0 or 1为药物疗效评价指标,通过与安慰剂比较,评估Secukinumab治疗中重度斑块型银屑病的疗效,结果显示,300 mg Secukinumab和150 mg Secukinumab治疗中重度斑块型银屑病患者均具有良好的临床疗效,但均存在不良反应问题;300 mg Secukinumab治疗组的临床疗效优于150 mg Secukinumab治疗组,且不良反应发生率无统计学差异;研究结果对临床用药方面具有一定的指导意义。
本研究纳入的文献均具有较高质量,研究结果均显示Secukinumab可以缓解中重度斑块型银屑病患者的症状,可能是因为一般阳性结论的文章较容易发表,而阴性结论的文章不容易发表。本研究进行文献检索时将语种限定为中文和英文,可能存在语言偏倚;所纳入的文献只是公开发表的,大量未公开发表的文献没有检索到,这也会导致发表偏倚的出现;所纳入的7篇文献均有诺华制药有限公司赞助参与,所以可能会导致Secukinumab疗效阳性结果的发表偏倚。
综上所述,Secukinumab治疗中重度斑块型银屑病患者有一定疗效。本研究纳入文献和患者样本量较少,有一定的局限性,但是对临床应用仍具有一定的参考价值。对于Secukinumab的研究,需要今后有更多高质量、多中心、大样本量的长期随机对照试验研究,以进一步验证其疗效,提高可信度。
[1] Lowes MA, Bowcock AM, Krueger JG. Pathogenesis and therapy of psoriasis[J]. Nature,2007,445(7130):866-873.
[2] Cai Y, Fleming C, Yan J. New insights of T cells in the pathogenesis of psoriasis[J]. Cellular & Molecular Immunology,2012,9(4):302-309.
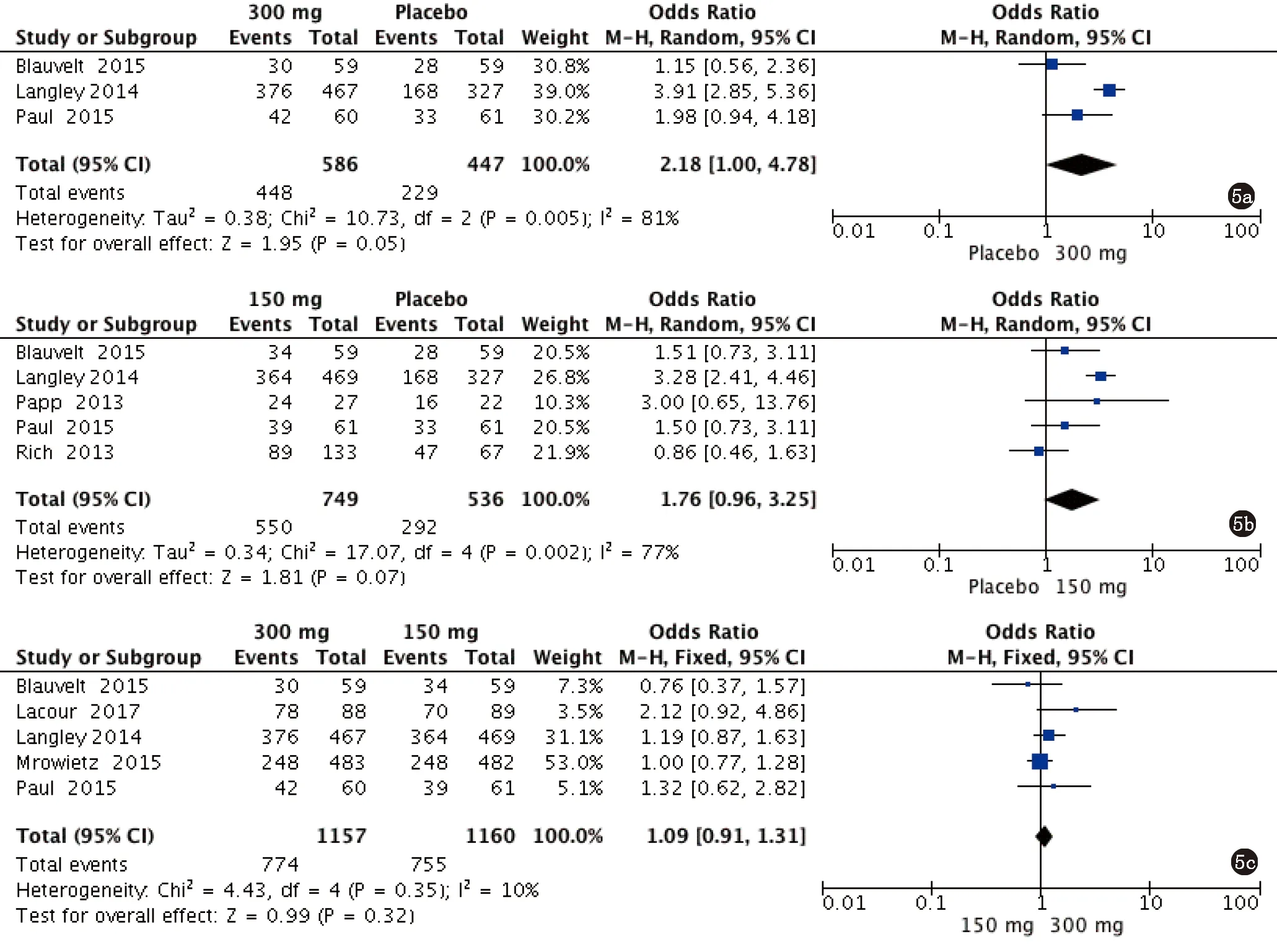
a.300 mg Secukinumab组vs安慰剂组;b.150 mg Secukinumab组vs安慰剂组;c.300 mg Secukinumab组vs 150 mg Secukinumab组图5 Secukinumab治疗中重度斑块型银屑病后不良反应事件发生率的Meta分析
[3] van der Fits L, Mourits S, Voerman JSA, et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis[J]. J Immunol,2009,182(9):5836-5845.
[4] Zhang L, Yang XQ, Cheng J, et al. Increased Th17 cells are accompanied by FoxP3+ Treg cell accumulation and correlated with psoriasis disease severity[J]. Clinical Immunology,2010,135(1):108-117.
[5] Blauvelt A, Prinz JC, Gottlieb AB, et al. Secukinumab administration by pre‐filled syringe: efficacy, safety and usability results from a randomized controlled trial in psoriasis (FEATURE)[J]. Br J Dermatol,2015,172(2):484-493.
[6] Lacour JP, Paul C, Jazayeri S, et al. Secukinumab administration by autoinjector maintains reduction of plaque psoriasis severity over 52 weeks: results of the randomized controlled JUNCTURE trial[J]. J Eur Acad Dermatol Venereol,2017,31(5):847-856.
[7] Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis-results of two phase 3 trials[J]. New England Journal of Medicine,2014,371(4):326-338.
[8] Papp KA, Langley RG, Sigurgeirsson B, et al. Efficacy and safety of secukinumab in the treatment of moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled phase II dose-ranging study[J]. Bri J Dermatol,2013,168(2):412-421.
[9] Paul C, Lacour JP, Tedremets L, et al. Efficacy, safety and usability of secukinumab administration by autoinjector/pen in psoriasis: a randomized, controlled trial (JUNCTURE)[J]. J Eur Acad Dermatol Venereol,2014,29(6):1082-1090.
[10] Rich P, Sigurgeirsson B, Thaci D, et al. Secukinumab induction and maintenance therapy in moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled, phase II regimen-finding study[J]. Bri J Dermatol,2013,168(2):402-411.
[11] Mrowietz U, Leonardi CL, Girolomoni G, et al. Secukinumabretreatment-as-needed versus fixed-intervalmaintenanceregimen for moderate to severe plaquepsoriasis: A randomized, double-blind, noninferiority trial (SCULPTURE)[J]. J Am Acad Dermatol,2015,73(1):27-36.
(收稿:2017-03-17 修回:2017-05-01)
Efficacy and safety of secukinumab in the treatment of adults patients with moderate-severe psoriasis: a meta-analysis
LIChao,TIANHuaiping,TANGYuenian.
DepartmentofPharmacy,XinhuaHospitalAffiliatedtoSchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200092,China
TANGYuenian,E-mail:tangyuenian@xinhuamed.com.cn
Objective: To assess the efficacy and safety of secukinumab in the treatment of adults patients with moderate-severe psoriasis. Methods: The articles of the randomized, controlled clinical trials about secukinumab in the treatment of moderate-severe psoriasis in adults were searched in PubMed, Cochrane Library, EMBASE, China National Knowledge Infrastructure, VIP Database for Chinese Technical Periodicals, Wanfang Med Online, and China Biology Medicine disc from the data base establishment to February 2017. The quality of the articles was assessed by two reviewers and meta-analysis was performed using the RevMan 5.3 software. Results: Seven articles including 3474 patients met the criteria. The results of meta-analysis showed that the number of the patients with a decrease of PASI scores up to 75%, 90% and 100% and a score of Investigator's Global Assessment (IGA) of 0 or 1 in 300 mg secukinumab group was more than those treated with 150 mg secukinumab and placebo (P<0.00001). The adverse reaction in the patients treated with 300 mg and 150 mg secukinumab was higher than those treated with placebo (P<0.05). However, the difference in adverse reaction was not significant between the patients treated with 300 mg and 150 mg secukinumab. Conclusion: 300 mg secukinumab is more effective in the treatment of moderate-severe psoriasis than 150 mg and there is no significant difference in adverse reaction between the two groups.
secukinumab; psoriasis; adult; meta-analysis
上海交通大学医学院附属新华医院药学部,上海,200092
唐跃年,E-mail: tangyuenian@xinhuamed.com.cn
