基于蛋白质交联的氧化酶特性与应用
2017-08-23王稳航路福平
程 珊, 王稳航,*, 路福平
(1.天津科技大学 食品工程与生物技术学院, 天津 300457; 2.天津科技大学 生物工程学院, 天津 300457)
基于蛋白质交联的氧化酶特性与应用
程 珊1, 王稳航1,*, 路福平2,*
(1.天津科技大学 食品工程与生物技术学院, 天津 300457; 2.天津科技大学 生物工程学院, 天津 300457)
蛋白质交联属于蛋白质改性修饰的一部分,是重组食品与新型食品制造的重要内容。与化学交联、物理交联相比,酶法交联因其反应条件温和、不产生副产物、交联效果好等特点,成为最为容易接受的一种蛋白质交联方式。除谷氨酰胺转胺酶外,一些氧化酶也被证明能够在蛋白质分子间形成共价键而形成交联。介绍了目前应用较多的酚氧化酶(酪氨酸酶、漆酶)、过氧化物酶以及赖氨酰氧化酶的酶学性质、交联机制等,并对其在食品蛋白质交联中研究现状以及潜在应用进行总结与展望。
氧化酶; 蛋白质修饰; 氧化; 共价交联
随着食品材料科学研究的快速发展,对蛋白质交联研究逐渐增多[1-2]。蛋白质交联是指通过一定的化学试剂或催化剂,在蛋白质内部多肽链之间(分子内交联)或蛋白质之间(分子间交联)形成共价键。在蛋白质形成共价键的过程中,根据反应方式可以分为化学交联、物理交联和酶法交联。与化学交联、物理交联相比,酶法交联因其反应条件温和、不产生副产物、交联效果好等特点,成为最为容易接受的一种蛋白质交联方式。目前,已证明蛋白质中有几个酶交联的重要活性基团如谷氨酰胺、赖氨酸、酪氨酸和半胱氨酸残基等。蛋白质的酶法共价交联主要为转酰基交联(也就是谷氨酰胺转氨酶交联)和氧化交联。目前,利用谷氨酰胺转氨酶进行蛋白质交联的研究已比较深入[3-5],利用氧化酶进行蛋白质氧化交联也开始引起人们广泛关注[6-9]。为此,本文对近年来国内外食品蛋白质的酶法氧化修饰研究及在蛋白质交联中的应用进行综述,以期为食品蛋白质酶法交联的进一步研究提供参考。
1 蛋白质的酶法氧化交联
1.1 蛋白质交联机制
蛋白质交联的主要机制包括(如图1[10]):1)蛋白质羰基与赖氨酸残基反应,形成希夫碱交联衍生物;2)组氨酸、赖氨酸或半胱氨酸残基与4 -羟基壬烯醛(HNE)等α,β -不饱和醛发生迈克尔加成反应(Michael addition)形成醛加合物,再进一步与其他赖氨酸反应生成希夫碱- 蛋白质交联衍生物[11];3)多不饱和脂肪酸氧化形成丙二醛等二醛分子与两分子不同的蛋白质的赖氨酸残基反应,形成蛋白质- 蛋白质交联衍生物[10]。
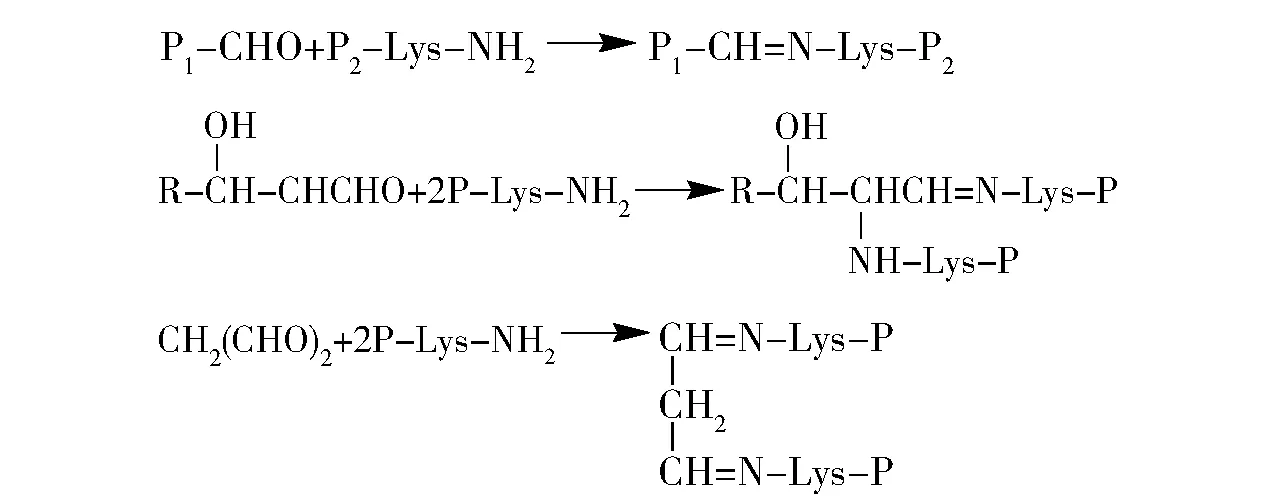
图1 基于羰- 氨反应的蛋白质交联Fig.1 Protein cross -linking based on carbonyl -amino reaction
1.2 蛋白质的酶法氧化交联特性
蛋白质的酶法交联也称酶法聚合改性,是指通过酶试剂在蛋白质内部多肽链之间(分子内交联)或蛋白质之间(分子间交联) 形成共价键,改变蛋白质的结构,从而达到改善蛋白质功能特性的目的。酶法交联是蛋白质改性的重要组成部分,随着食品重组技术与产品的不断推广,其角色日益举足轻重。目前能催化蛋白质发生交联作用的酶主要有谷氨酰胺转氨酶(TG)和一些氧化酶,如多酚氧化酶和过氧化物酶,后者涉及蛋白质氧化反应。蛋白质氧化是指在自由基及其相关氧化物的作用下,某些特定的氨基酸残基发生反应,使蛋白质功能与结构发生变化,如:对氧化物的亲和力增强,易于水解、聚合和交联。氧化酶可通过直接作用蛋白质的基团如巯基使其氧化为二硫键而形成共价交联,也可以先氧化蛋白质或其他前体分子生成醌类、自由基、过氧化氢等活性交联剂,再与蛋白质中特定的化学基团产生非酶反应而产生一系列的交联反应。应该说,目前除去TG酶介导的蛋白质交联外,其他酶法改性而形成的共价交联均属于氧化交联。
1.3 氧化酶种类与催化原理
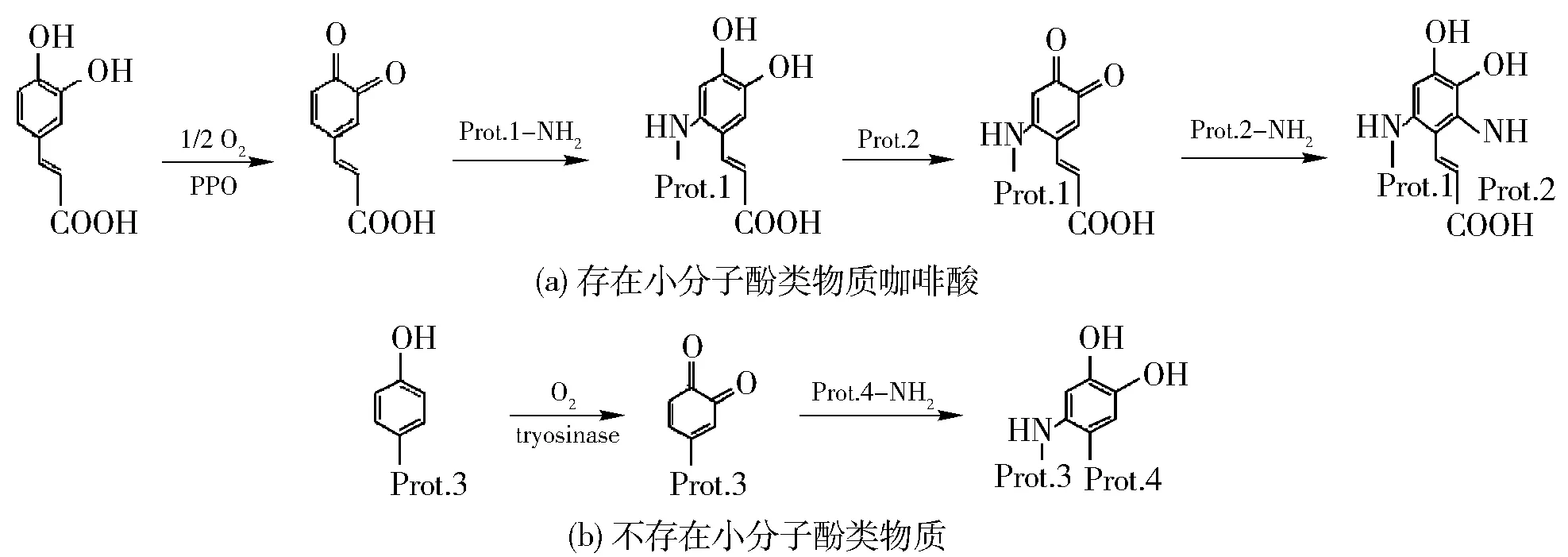
图2 酪氨酸酶催化反应机制Fig.2 Reaction mechanism of tyrosinase
氧化酶是一类催化从一个分子(氧化剂、氢供体或电子供体)到另一个分子(还原剂、氢受体或电子受体)电子转移的酶。两个蛋白质分子之间共价键的形成是由氧化还原酶类发起的,涉及至少两个连续的化学步骤。在这些反应中,只有初始氧化反应与初始底物是由酶直接催化的,由此产生的活性产物例如醌类、自由基类或者醛类可能会在随后经历非酶催化转化反应而形成各种类型的共价键。
在食品加工中有潜在应用价值的氧化酶是酚氧化酶、过氧化物酶、葡萄糖和己糖氧化酶、巯基氧化酶[12]。目前,具有蛋白质明显交联效果并进行了较为深入研究的仅限于前两类。最近在生物材料领域开始发展的胺氧化酶尤其是赖氨酰氧化酶由于其独特的蛋白交联特性也逐渐受到关注。这里主要介绍多酚氧化酶、过氧化物酶、赖氨酰氧化酶类。
2 多酚氧化酶特性与应用
多酚氧化酶是在氧分子存在下把酚类氧化成邻苯醌或对苯醌的酶。广义上,多酚氧化酶可分为三大类:单酚氧化酶(如酪氨酸酶)、双酚氧化酶(如儿茶酚氧化酶)和漆酶。目前对多酚氧化酶的研究中以酪氨酸酶的研究最为广泛,双酚氧化酶的研究相对较少,因此主要对酪氨酸酶和漆酶进行简单介绍。
2.1 酪氨酸酶特性与应用
2.1.1 酪氨酸酶的性质与催化交联机制
酪氨酸酶(tyrosinase, E.C.1.14.18.1)是一类广泛分布于细菌、真菌、植物、昆虫和高等动物中的含铜蛋白质。酪氨酸催化位点有两个铜原子,每一个铜原子由3个高度保守的组氨酸调节[13]。酪氨酸酶是一个有两种不同生物学功能的酶,它催化一元酚的正交羟基化和随后的二元酚氧化成醌。蛋白质中有弱的三维结构和展开的蛋白质结构更容易成为酪氨酸交联的目标,然而那些球状蛋白质则不会[14]。
图2[15]为酪氨酸酶催化反应机制。酪氨酸酶催化两种独特的氧化反应,分别为单酚酶催化的羟基化反应和儿茶酚酶催化的氧化反应,氧气是这两个反应共同的底物[16]。对于羟基化反应,氧气分子的一个原子嵌入到一元酚底物的芳香环中,另一个原子进入水中。第一步的氧化反应中邻苯二酚(DOPA)在单酚中形成,在第二步反应中DOPA进一步氧化形成相应的邻醌[17]。醌类是有活性的复合物,可以自发反应形成高分子量的复合物或者黑色素。
2.1.2 酪氨酸酶的功能与应用
酪氨酸酶是生物体内黑色素合成的限速酶,是筛选色素沉积抑制剂的靶标之一[18]。同时,对比酪氨酸酶和转谷酰胺酶交联促进明胶和壳聚糖凝胶的形成,发现酪氨酸酶能够使凝胶的速度更快。然而由酪氨酸酶催化的水凝胶只有在壳聚糖存在的条件下形成,并且机械性能比较弱且不稳定[19];另外,研究证明,酪氨酸交联在蛋白质中的形成可以通过添加小分子的酚类化合物来形成,这些分子可能作为交联介质起作用进而克服靶蛋白表面暴露的酪氨酸残基的缺失问题[20]。与转谷酰胺酶相比,酪氨酸不需要对牛奶预热便可允许酶法交联,这可能对特定的牛奶制品质量产生影响[21]。
值得注意的是,在酪氨酸酶作用下,由酪氨酸与自由氨基酸产生醌类的反应可能会影响食品产品的颜色和香味,这些可能会限制酪氨酸在食品工业中的应用[22]。
2.2 漆酶特性与应用
2.2.1 漆酶的性质与催化机制
漆酶(laccase, E.C.1.10.3.1)属于多铜氧化酶类。漆酶在自然界很常见,并且广泛分布在真菌中,在高等植物中则较为少见[23]。漆酶中除了高度保守的催化中心,在蛋白质结构、分子大小、最适pH值和底物专一性方面有很大不同。漆酶的底物范围非常广泛,能够氧化多种酚化合物、二元胺类、芳香氨基酸[24]。漆酶温度稳定性的变化很大,这主要取决于酶的来源。
由漆酶催化的氧化反应是在由4个铜原子组成的酶催化中心的协助下完成。催化循环的结果是一分子氧气减少进入到两个水分子中去,同时底物氧化反应产生4个氧自由基中心。自由基形成和醌类能够导致底物分子发生聚合作用,不稳定的自由基能够进一步将非酶转化为半醌形式。在蛋白质中,暴露的酪胺酰侧链可为漆酶氧化提供底物,由此产生的苯氧基可以自发地启动后续的蛋白质交联反应。
2.2.2 漆酶的功能与应用
漆酶稳定性好,作用底物广泛,在氧气分子的参与下可直接氧化底物。目前,除了将漆酶应用于去除果汁中的多酚物质以降低其苦涩感外[25],更多的研究开始集中在漆酶对蛋白质的氧化修饰方面。例如,漆酶能够与α-乳白蛋白相互作用,显著提高胶凝强度和氧化性[26];同时,也有研究表明,漆酶能够交联花生蛋白并改变其免疫调节活性[27]。漆酶在食品领域的应用越来越广泛。
3 过氧化物酶特性与应用
过氧化物酶(peroxidase,POD,E.C.1.11.1.7)是由微生物或植物所产生的一类氧化还原酶,是一种血红素蛋白,包含三价铁的原卟啉Ⅸ。过氧化物酶可以在过氧化物如过氧化氢存在条件下催化许多反应。过氧化物酶包括专一性的酶,例如NADH过氧化物酶、谷胱甘肽过氧化物酶和碘化过氧化物酶,还包括非专一性的酶,就是被人们所熟知的过氧化物酶[28]。
虽然过氧化物酶已经被广泛研究,但是据报道[29],只有植物过氧化物酶能够进行酶反应形成蛋白质联,这主要包括辣根过氧化物酶和大豆过氧化物酶。其中,以辣根过氧化物酶研究最为广泛,并且由于大豆过氧化物酶具有和辣根过氧化物酶相似的稳定性和催化机制,因此这里仅以辣根过氧化物酶为例进行简单介绍。
3.1 辣根过氧化物酶的性质与催化机制
辣根过氧化物酶(horesradish peroxidase, HRP, E.C. 1.11.1.7)是一类以铁卟啉为辅基的血红素蛋白质。HRP中的酶分子含有三价铁血红素,两个Ca2+和一条多肽链。HRP催化过氧化氢和还原底物之间的氧化还原反应。典型的底物包括芳香酚类、酚酸、吲哚、胺类和磺酸盐[30]。研究表明,HRP能够被位点专一性的含有酪氨酸标签(如GGGGY 或 GGYYY) 的重组体蛋白交联[31]。
过氧化物酶用过氧化氢作为电子接受体来氧化大量的有机和无机底物,氧化的结果是自由基的形成,并且可以与其他底物发生进一步反应。大多数的氧化酶催化的反应可以由方程式表达:
H2O2+2AH2→2H2O+2AH·
其中AH2代表底物,AH·是自由基产物,同时过氧化氢转变成水。
辣根过氧化物酶催化反应机制如图3[32]。图3中,在HRP催化的反应中,过氧化氢首先取代了与过氧化物酶分子中血红素相结合的水形成酶- 底物络合物(Ei);Ei和外源氢供体底物作用生成化合物Eii,并形成自由基(RO·);化合物Eii和第二个氢供体底物分子作用后,过氧化物酶E分子再生,同时生成第二个自由基(RO·),这些自由基可以进一步聚合生成新的化合物[33]。
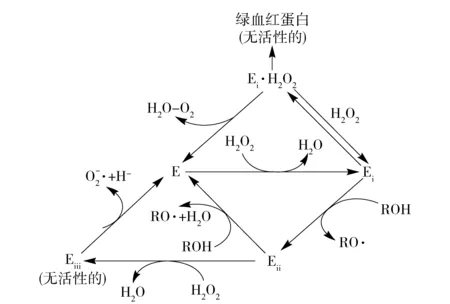
图3 辣根过氧化物酶催化反应机制Fig.3 Reaction mechanism of horseradish peroxidase
3.2 辣根过氧化物酶的功能与应用
HRP在食品工业中具有重要的应用价值。温研等[33]利用HRP处理牛乳得到固定型酸奶,结果显示,酸奶硬度及黏度均有所提高,能明显改善固定性酸奶的品质;马超越等[34]将固定的HRP用于啤酒中H2O2的测定,结果发现有很好的回收率,且啤酒的稳定性更好;展海军等[35]将固定的HRP应用到火腿肠的NaNO2测定,实验表明有良好的回收性,火腿肠的品质得到提升。不过,过氧化物酶的稳定性是一个比较难以解决的问题,因此,从不同的植物源中获得有更高稳定性和活性的过氧化物酶对实际生产将会产生更大帮助。
4 胺氧化酶特性与应用
胺氧化酶(amine oxidase)是在生物体内广泛存在的一类酶,参与生物胺的代谢,使胺氧化裂解成醛和氨。反应方程式为:
RCH2NH2+O2+H2O→RCHO+NH3+H2O
胺氧化酶可分为两类:一类为以醌为辅因子的含铜胺氧化酶(copper -containing amine oxidases,CAO)(E.C.1.4.3.6),另一类为含黄素的胺氧化酶[36]。其中CAO是一类包含铜离子和酪氨酸衍生醌辅因子的酶(E.C.1.4.3.4),可以分为两类不同源的家族:2,4,5 -三羟苯基丙氨酸醌依赖的CAOs和赖氨酸酪氨酰醌依赖的赖氨酰氧化酶家族(lysyl oxidase,LOXs)[37]。
胺氧化酶普遍存在微生物中,因此具有胺氧化酶活性的菌株被广泛应用到食品中。乳酸菌属的香肠乳杆菌可以用来降解红酒中的组胺、酪胺和腐胺[38],木糖葡萄糖球菌被发现可以抑制凤尾鱼腌制和发酵过程中生物胺的形成并且效果显著[39]。一系列的相关文献已对CAOs和LDX(E.C.1.4.3.13)进行了报道[40-42]。这里简单介绍对蛋白质交联贡献最大的赖氨酰氧化酶。
LOX是由细胞分泌的、作用于细胞外基质胶原和弹性蛋白赖氨酸残基而产生分子交联的一种含有铜结合部位的胺氧化酶,能将伯胺氧化成醛。这类广泛存在的酶氧化赖氨酸的初级伯胺形成乙醛,活性乙醛进一步反应交联细胞外基质。LOX 基因家族共有5个成员,每个成员都含有两个高度保守的区域,分别为N末端,含有4个组氨酸的铜结合部位的信号肽区域;C末端,含有酪氨酸残基的催化区域,含有高度保守的铜离子结合位点、赖氨酸酪氨酰醌残基和细胞因子受体区域[43]。
4.1 LOX催化交联机制
图4为赖氨酰氧化酶的催化机制[36]。如图4所示, LOX氧化胶原中的肽基脯氨酰赖氨酸、羟酰赖氨酸残基和弹性蛋白中的赖氨酸残基产生肽基α -氨基乙二酸 -δ -半醛。这些醛修饰能够自发地与邻近的肽醛或者肽基脯氨酰赖氨酸的ε -氨基结合形成共价交联来稳定胶原和弹性蛋白纤维的稳定性,使其不溶于细胞外基质[37]。醛的产生替代了正常的赖氨酸残基不活跃的亚甲基,形成了潜在的亲电子的羰基。产生的肽基醛就可以与相邻的未修饰的赖氨酸的NH2形成脱氢赖氨酸正亮氨,从而形成交联反应。
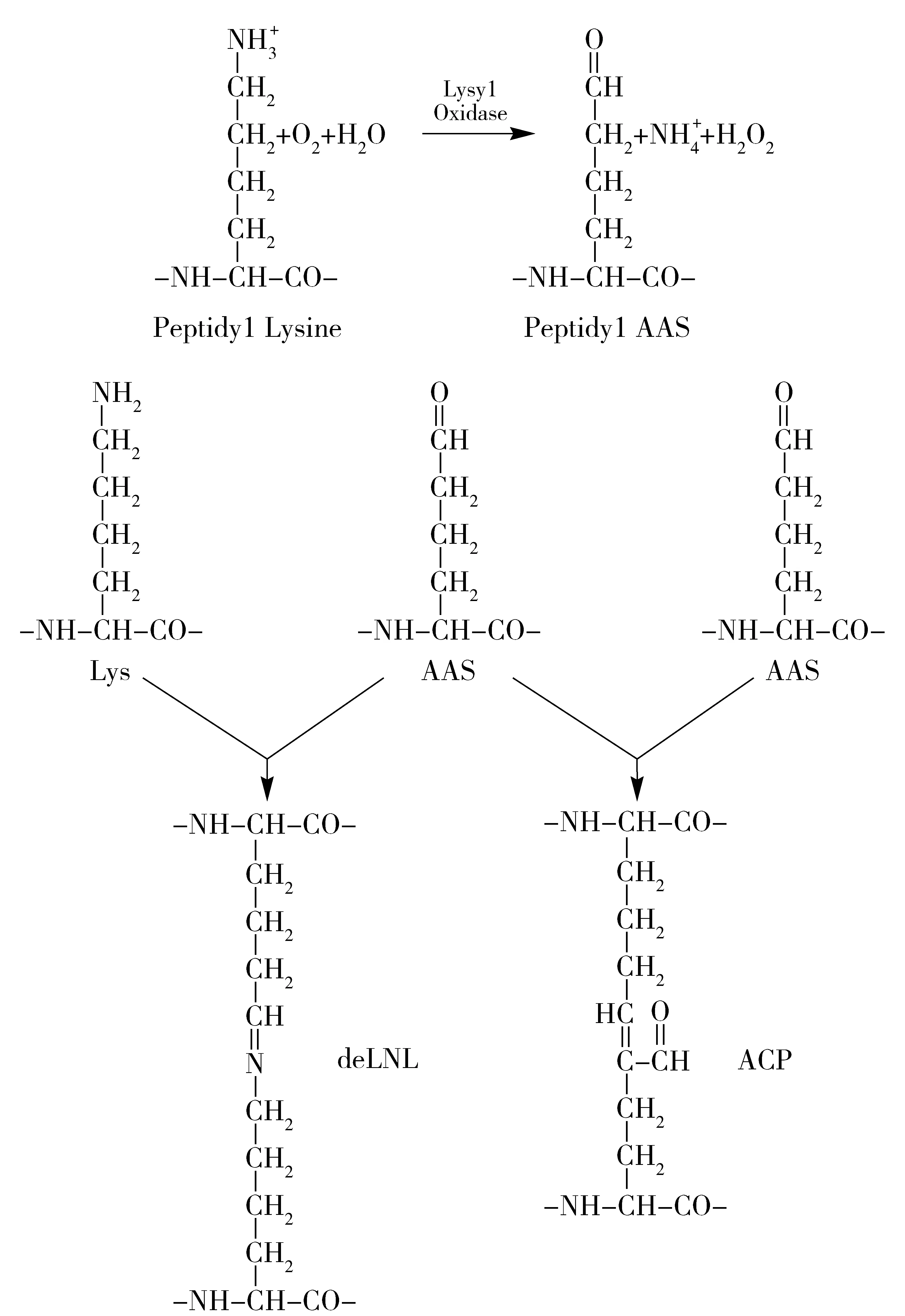
图4 赖氨酰氧化酶的催化机制Fig.4 Catalytic mechanism of lysyl oxidase
4.2 LOX的功能与应用
LOX能使细胞外基质胶原纤维和弹性蛋白分子共价交联反应产生肽基α -氨基己二酸 -δ -半醛。这种醛修饰可以稳定胶原和弹性纤维的结构,使其在细胞外基质不可溶[37]。近年来,赖氨酰氧化酶的多种生物学功能被发现,LOX对肺泡形成、末梢和近端气道的形成有重要作用[37];LOX对心血管、呼吸系统、骨骼和其他器官相关组织的形态学形成和修复有重要作用[44]。在生物材料中,LOX催化形成的水凝胶由于赖氨酰氧酶连续的催化作用使结构更稳定,这一特征导致水凝胶机械性能的稳定性不断提高,并不像其他的凝胶系统会随着时间的推移而发生降解[37]。食品蛋白质种类繁多,理化性质各异,利用LOX进行氧化交联,将呈现不同的交联机制与交联效果,对其在这一领域的研究与开发具有重要的科学意义与应用价值。
5 结束语
酶促进氨基酸残基之间的共价交联为蛋白质修饰提供更多的可能性,从而为食品重组与新型食品制造提供科学基础与技术支持。目前,仅有非常少的几种酶能被用作蛋白质交联,涉及氧化交联的更少。氧化酶的蛋白质交联作用机制与TG酶完全不同,并且这些氧化酶之间在理化特性、反应机理和作用底物等方面也存在很大差异性。对这些氧化酶酶学性质与氧化交联效果进行深入分析,将有利于蛋白质交联的差异化,并以此达到食品产品质构的调节与控制。
酶催化的蛋白质氧化交联已经引起了研究者的广泛关注,逐渐成为新的蛋白质修饰的研究热点。然而,交联蛋白质也可能会影响消费者食用最终产品的生理特性,如消化性和变应原性。应该说,蛋白质的酶法交联对蛋白质的生物容性、食用安全性等方面将产生一定的积极的或者消极的影响,但是这些并没有被研究透彻,需要更多的关注。尤其是氧化酶,其在反应过程中产生的自由基团以及其他副产物,在反应体系的消减与残留,以及对人体健康的有无可能危害性,也是值得深入研究的课题。
目前除了已经建立在谷氨酰胺转氨酶基础上的酶交联方法比较成熟外,酶法氧化交联技术在蛋白质交联领域还尚未成熟。因此,有必要开发与成熟氧化酶氧化相关的交联方法、检测手段等系列集成化技术体系,以丰富与拓展氧化酶类在蛋白质交联与重组食品中的应用。
[1] CONDÉS M C, AN M C, MAURIA N. Amaranth protein films prepared with high -pressure treated proteins[J]. Journal of Food Engineering, 2015, 166: 38-44.
[2] ISASCHAR -OVDAT S, ROSENBERG M, LESMES U, et al. Characterization of oil -in -water emulsions stabilized by tyrosinase -crosslinked soy glycinin[J]. Food Hydrocolloids, 2015, 43: 493-500.
[3] GASPAR A L , DEGES -FAVONI S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins: a review[J]. Food Chemistry, 2015, 171(15): 315-322.
[4] LERNE A, MATTHLAS T. Possible association between celiac disease and bacterial transglutaminase in food processing: a hypothesis[J]. Nutrition Reviews, 2015, 73(8): 544-552.
[5] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry: a review[J]. Folia Microbiologica, 2014, 59(3): 241-250.
[6] DHAYAL S K, GRUPPEN H, VRIES R D, et al. Controlled formation of protein nanoparticles by enzymatic cross -linking of α -lactalbumin with horseradish peroxidase [J]. Food Hydrocolloids, 2014, 36(36): 53-59.
[7] JUS S, STACHEL I, SCHLOEGL W, et al. Cross -linking of collagen with laccases and tyrosinases[J]. Materials Science and Engineering C, 2011, 31(5): 1068-1077.
[8] HELLMAN M, MATTINEN M L, FU B, et al. Effect of protein structural integrity on cross -linking by tyrosinase evidenced by multidimensional heteronuclear magnetic resonance spectroscopy [J]. Journal of Biotechnology, 2011, 151(1): 143-150.
[9] LEIBOWTTZ M J, SOFFER R L. Enzymatic modification of proteins [J]. Journal of Biological Chemistry, 1971, 246: 731-737.
[10] 李国林, 印大中. ROS介导的蛋白质氧化的生化机制 [J]. 生命的化学, 2007, 27(6): 516-520.
[11] YIN D, CHEN K. The essential mechanisms of aging: irreparable damage accumulation of biochemical side -reactions [J]. Experimental Gerontology, 2005, 40(6): 455-465.
[12] WHITAKER J R. Handbook of food enzymology [J]. Revista Brasileira De Ciências Farmacêuticas, 2003, 40(2): 993-1018.
[13] MU Y, LI L, DONG F Y, et al. Inhibition mechanism of 4 -methoxycinnamic acid to tyrosinase [J]. Journal of South China University of Technology, 2012,40(12): 134-138.
[14] HELLMAN M, MATTINEN M L, FU B, et al. Effect of protein structural integrity on cross -linking by tyrosinase evidenced by multidimensional heteronuclear magnetic resonance spectroscopy [J]. Journal of Biotechnology, 2011, 151(1): 143-150.
[15] 杨柳, 刘玉环, 阮榕生, 等. 交联作用对蛋白类食品的影响 [J]. 食品科学, 2010, 31(19): 394-398.
[16] ISMAYA W T, ROZEBOOM H J, WEIJN A, et al. Crystal structure ofAgaricusbisporusmushroom tyrosinase: identity of the tetramer subunits and interaction with tropolone [J]. Biochemistry, 2011,50(24): 5477-5486.
[17] CLAUS H, DECKER H. Bacterial tyrosinases [J]. Systematic and Applied Microbiology, 2006, 29(1): 3-14.
[18] CHANG T S. Natural melanogenesis inhibitors acting through the down -regulation of tyrosinase activity [J]. Materials, 2012, 5(9): 1661-1685.
[19] CHEN T, EMBREE H D, WU L, et al.Invitroprotein -polysaccharide conjugation: tyrosinase -catalyzed conjugation of gelatin and chitosan [J]. Biopolymers, 2002, 64(6): 292-302.
[20] FAIRHEAD M, THNYMEYER L. Bacterial tyrosinases: old enzymes with new relevance to biotechnology [J]. New Biotechnology, 2012, 29(2): 183-191.
[21] CURAD E. Effect ofTrichodermareeseityrosinase on rheology and microstructure of acidified milk gels [J]. International Dairy Journal, 2010, 20(12): 830-837.
[22] BITTNER S. When quinones meet amino acids: chemical, physical and biological consequences [J]. Amino Acids, 2006, 30(3): 205-224.
[23] MAYERA M, STAPLES R C. Laccase: new functions for an old enzyme [J]. Phytochemistry, 2002, 60(6):551-565.
[24] XU F. Oxidation of phenols, anilines, and benzene -thiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition [J]. Biochemistry, 1996, 35(23): 7608-7614.
[25] LETTERA V,PEZZELLA C,CICATIELLO P,et al. Efficient immobilization of a fungal laccase and its exploitation in fruit juice clarification [J]. Food Chemistry,2016,196:1272-1278.
[26] JIANG Z,YUAN X,YAO K,et al. Laccase -aided modification: effects on structure, gel properties and antioxidant activities ofα-lactalbumin [J]. LWT -Food Science and Technology,2017,80:355-363.
[27] MIHAJLOVIC L,RADOSAVLJEVIC J,NORDLUND E,et al. Peanut protein structure, polyphenol content and immune response to peanut proteinsinvivoare modulated by laccase [J]. Food Function,2016,7:2357-2366.
[28] MOHSINA H, REHMAN K. Potential applications of peroxidases [J]. Food Chemistry, 2009, 115(4): 1177-1186.
[29] TEIXEIRA L S, FEIJEN J, VAN BLITTERSWIJK C A, et al. Enzyme -catalyzed crosslinkable hydrogels: emerging strategies for tissue engineering [J]. Biomaterials, 2012, 33(5): 1281-1290.
[30] VEITCH N C. Horseradish peroxidase: a modern view of a classic enzyme [J]. Phytochemistry, 2004, 65(3): 249-259.
[31] MINAMIHATAI K, GOTO M, KAMIYA N. Site -specific protein cross -linking by peroxidase -catalyzed activation of a tyrosine -containing peptide tag [J]. Bioconjugate Chemistry, 2011, 22(1): 74-81.
[32] 李君文, 赵新淮. 食品中的蛋白质交联技术 [J]. 食品工业科技, 2011(1): 380-384.
[33] 温研, 赵新淮. 牛乳的过氧化物酶处理与凝固型酸奶品质的变化 [J]. 食品与发酵工业, 2011, 37(2): 41-45.
[34] 马超越, 展海军, 赵亚. 聚中性红辣根过氧化物酶传感器测定啤酒中的过氧化氢 [J]. 食品科技, 2011,36(4): 266-268.
[35] 展海军, 马超越, 白静. 固定化辣根过氧化物酶生物传感器测定火腿肠中亚硝酸盐 [J]. 食品研究与开发, 2011, 32(2): 123-125.
[36] 胡玲玲, 汤其群, 黄海艳. 赖氨酰氧化酶的结构和功能 [J]. 生命的化学, 2009, 29(2): 291-294.
[37] SETHI A, WORDINGER R J, CLARK A F. Focus on molecules: lysyl oxidase [J]. Experimental Eye Research, 2012, 104(8): 97-98.
[39] ZAMAN M Z, ABU B F, JINAP S, et al. Novel starter cultures to inhibit biogenic amines accumulation during fish sauce fermentation [J]. International Journal of Food Microbiology, 2011, 145(1): 84-91.
[40] DUBOIS J L, KLINMAN J P. Mechanism of post -translational quinone formation in copper amine oxidases and its relationship to the catalytic turnover [J]. Arch Biochem Biophys, 2005, 433(1): 255-65.
[42] O’SULLIVAN J, UNZETA M, HEALY J, et al. Semicarbazide -sensitive amine oxidases: enzymes with quite a lot to do [J]. Neurotoxicology, 2004, 25(1/2): 303-315.
[43] LUCERO H A, KAGAN H M. Lysyl oxidase: an oxidative enzyme and effector of cell function [J]. Cellular and Molecular Life Sciences Cmls, 2006, 63(19/20): 2304-2316.
[44] 李景涛, 刘剑仑, 韦薇, 等. 干扰LOX表达对MDA -MB -231细胞侵袭迁移影响及其机制的探讨 [J]. 中华肿瘤防治杂志, 2012, 19(13): 970-974.
(责任编辑:叶红波)
Enzymatic Properties of Oxidases and Their Application in Covalent Cross -Linking of Proteins
CHENG Shan1, WANG Wenhang1,*, LU Fuping2,*
(1.CollegeofFoodEngineeringandBiotechnology,TianjinUniversityofScienceandTechnology,Tianjin300457,China; 2.CollegeofBiotechnology,TianjinUniversityofScienceandTechnology,Tianjin300457,China)
Protein cross -linking, belonging to protein modification, plays an important role in food restructure and new food preparation.Compared with chemical and physical cross -linking methods, enzymatic cross -linking has become the most acceptable cross -linking method of protein due to its mild reaction conditions, no by -products and good cross -linking characteristics. Apart from glutaminase, some oxidases have also been shown to form covalent bond between protein molecules and promote formation of covalent cross -linking. This paper summarizes the enzymatic properties, cross -linking mechanism of phenol oxidase (e.g., tyrosinase, laccase), peroxidase and lysyl oxidase. Lastly, the research status and application potential of these enzymes in food proteins are summarized.
oxidase; protein modification; oxidation; covalent cross -linking
10.3969/j.issn.2095 -6002.2017.03.005
2095 -6002(2017)03 -0036 -07

程珊, 王稳航, 路福平. 基于蛋白质交联的氧化酶特性与应用[J]. 食品科学技术学报,2017,35(3):36-42.
CHENG Shan, WANG Wenhang, LU Fuping. Enzymatic properties of oxidases and their application in covalent cross -linking of proteins[J]. Journal of Food Science and Technology, 2017,35(3):36-42.
2017 -04 -12
国家自然科学基金面上项目(31671806)。
程 珊,女,硕士研究生,研究方向为食品生物技术;
TS202.3; Q814.4; Q816
A
*王稳航,男,教授,博士,主要从事食品酶及其应用方面的研究,通信作者;
*路福平,男,教授,博士,主要从事生物催化工程方面的研究,通信作者。
