复合植物水解酶提取花生油脂体工艺研究
2017-08-23赵自通郝莉花李宇健陈复生
赵自通, 郝莉花, 李宇健, 陈复生
(河南工业大学 粮油食品学院, 河南 郑州 450001)
复合植物水解酶提取花生油脂体工艺研究
赵自通, 郝莉花, 李宇健, 陈复生*
(河南工业大学 粮油食品学院, 河南 郑州 450001)
为了提高花生油脂体的提取率,选用复合植物水解酶辅助提取花生油脂体。通过单因素实验考察了料液比、酶用量、酶解时间、酶解温度对复合植物水解酶提取花生油脂体提取率的影响。在单因素实验的基础上,采用正交试验对复合植物水解酶提取花生油脂体的工艺进行优化。实验结果表明,在所选取的参数范围内,各因素对花生油脂体提取率的影响由大到小为:料液比、酶解温度、酶解时间、酶用量。获得其较佳工艺条件为料液比1∶4 (g/mL)、酶用量1.25%、酶解时间80 min、酶解温度50 ℃,在该条件下花生油脂体提取率为48.92%。
花生; 油脂体; 复合植物水解酶; 提取率
花生是我国重要的油料资源之一,在世界农业生产和贸易中占有重要地位。研究表明,花生油主要储存在花生油脂体中[1]。油脂体是植物油料的一个重要亚细胞结构,几乎所有的油料细胞中都有油脂体[2-3]。由于油脂体特殊的结构和性质,近年来被研究者广泛关注,关于各类植物油脂体提取、纯化和性质的研究成果不断增加[4-8],这些研究大多以水剂法获得油脂体。水剂法技术具有无溶剂污染和相对安全性高的优点,适合于食品工业生产,但该法生产油脂体存在效率较低、得率不高的缺点,有待采取适当的方法对其进行改进。随着科技的发展,商业酶制剂的成本越来越低,酶制剂在食品工业中的应用也越来越广泛,利用酶制剂辅助提取油脂体是一种具有较高研究价值的方法[9]。本研究以花生为原料,采用复合植物水解酶ViscozymeL.提取花生油脂体,在单因素实验的基础上,通过正交试验优化提取工艺,以期为拓宽花生的加工利用途径提供理论依据。
1 材料与方法
1.1 材料与试剂
花生购于郑州市农贸市场,去壳后贮存于4 ℃冰箱待用;试剂均为分析纯,天津市科密欧化学试剂有限公司;复合植物水解酶ViscozymeL.(包括阿拉伯聚糖酶、纤维素酶、β -葡聚糖酶、半纤维素酶和木聚糖酶的复合酶,酶活5 086 U/mL,最适pH值3.3~3.5,最适温度40~45 ℃),诺维信(中国)生物技术有限公司。
1.2 仪器与设备
BSA224S- CW型分析天平,赛多利斯科学仪器(北京)有限公司; DHG- 9246A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;FM200型均质机,上海弗鲁克流体机械制造有限公司;THZ- 82型数显水浴恒温振荡器,金坛华峰仪器有限公司;DZ267- 32C6型离心机,上海安亭科学仪器厂; FW- 100型高速万能粉碎机,北京市永光明医疗仪器有限公司;Milli- Q型超纯水机,美国默克密理博公司; LGJ- 25型冷冻干燥机,北京四环科学仪器有限公司;DZF- 2B型真空干燥箱,北京市永光明医疗仪器有限公司。
1.3 操作方法
将脱红衣花生用高速万能粉碎机粉碎,使花生成粉末状。称取粉碎花生20 g,按料液比(g/mL)1∶5加去离子水,加入复合植物水解酶,均质。在50 ℃水浴恒温振荡器中震荡2 h,充分酶解。酶解结束后于沸水浴中灭酶5 min,取出后冷却。将冷却的样液转移至离心管以5 000 r/min离心20 min,将上层乳脂固体(油脂体)取出,真空干燥箱中干燥,将下层沉淀物冷冻干燥24 h,并称量。按式(1)计算油脂体的提取率。
油脂体提取率=(m1/m)×100%。
(1)
式(1)中,m1为油脂体干质量,g;m为样品质量,g。
1.4 单因素实验
1.4.1 料液比对油脂体提取率的影响实验
选取料液比为1∶2,1∶3,1∶4,1∶5,1∶6的样品,酶解温度50 ℃,酶用量0.75%,酶解时间2 h,按照1.3的方法进行水酶法提取花生油脂体实验。
1.4.2 酶用量对油脂体提取率的影响实验
选取酶用量为0.75%,1.00%,1.25%,1.50%,1.75%,2.00%的样品,酶解温度50 ℃,料液比1∶5,酶解时间2 h, 按照1.3的方进行水酶法提取花生油脂体实验。
1.4.3 酶解时间对油脂体提取率的影响实验
选取酶解时间为40,60,80,100,120,140 min,酶解温度50 ℃,料液比1∶5,酶用量为0.75%,按照1.3的方法进行水酶法提取花生油脂体实验。
1.4.4 酶解温度对油脂体提取率的影响实验
选取酶解温度为40,45,50,55,60,65 ℃,料液比为1∶5,酶用量为0.75%,酶解时间为2 h,按照1.3的方法进行水酶法提取花生油脂体实验。
1.5 正交试验
根据单因素实验结果,确定正交试验因素水平表。因素A为料液比(g/mL),B为酶用量(%),C为酶解时间(min),D为酶解温度(℃),试验因素水平如表1。采用SPSS 20.0软件进行正交试验设计。以酶解温度、料液比、酶用量、酶解时间4个因素为自变量,以花生油脂体提取率为因变量,生成L9(34)正交设计表,按照1.3的方法进行水酶法提取花生油脂体实验,确定优化的提取工艺条件,并进行验证实验。

表1 正交试验因素水平表
2 结果与讨论
2.1 单因素实验结果分析
为了提高复合植物水解酶酶解花生细胞壁制备花生油脂体的效率,对酶解工艺进行单因素实验分析。按1.3进行酶解反应,分别考察了酶解温度、料液比、酶用量和酶解时间对花生油脂体提取率的影响,并对实验结果进行分析。
2.1.1 料液比对油脂体提取率的影响
料液比对油脂体提取率的影响规律如图1。由图1可知,在料液比由1∶2增加到1∶4的过程中,油脂体的提取率也随之增加,且油脂体提取率在1∶4时最高,达到42.16%;在达到最大提取率后,随着料液比的增加,油脂体提取率呈现出逐渐下降的趋势。这是因为随着料液比增加,一定程度上增加了酶制剂和底物的接触,从而使油脂体提取率升高;但当料液比达到最适条件后,增加料液比反而降低了酶制剂的浓度,不利于油脂体的提取[10]。李倩等[11]在利用酶制剂辅助提取红花料时也发现当水过量时,酶反应体系中酶浓度和底物浓度低,使酶分子与底物分子碰撞几率降低,酶的作用效果也因此降低。综合考虑提取率和实验操作条件,选取料液比为1∶3~1∶5作为正交试验的范围。

图1 料液比与油脂体提取率的关系Fig.1 Effect of different liquid -solid ratios on peanut oil bodies yield
2.1.2 酶用量对油脂体提取率的影响
酶用量对油脂体提取率的影响规律如图2。由图2可知,随着酶用量的增加,油脂体提取率逐渐增加,并在1.25%时达到最大值(39.22%);随着酶用量的继续升高,油脂体的提取率相对平稳,这是由于随着复合植物水解酶酶用量的增加,花生细胞壁的破坏程度也相应增加,细胞内的油脂体等物质被充分释放出来;但酶用量达到一定程度时,油脂体已经基本被释放出来,并在萃取体系中形成了一种相对平衡的状态[10-11]。综合考虑提取率和实验操作条件,选取酶用量为1.00%~1.50%作为正交试验范围。
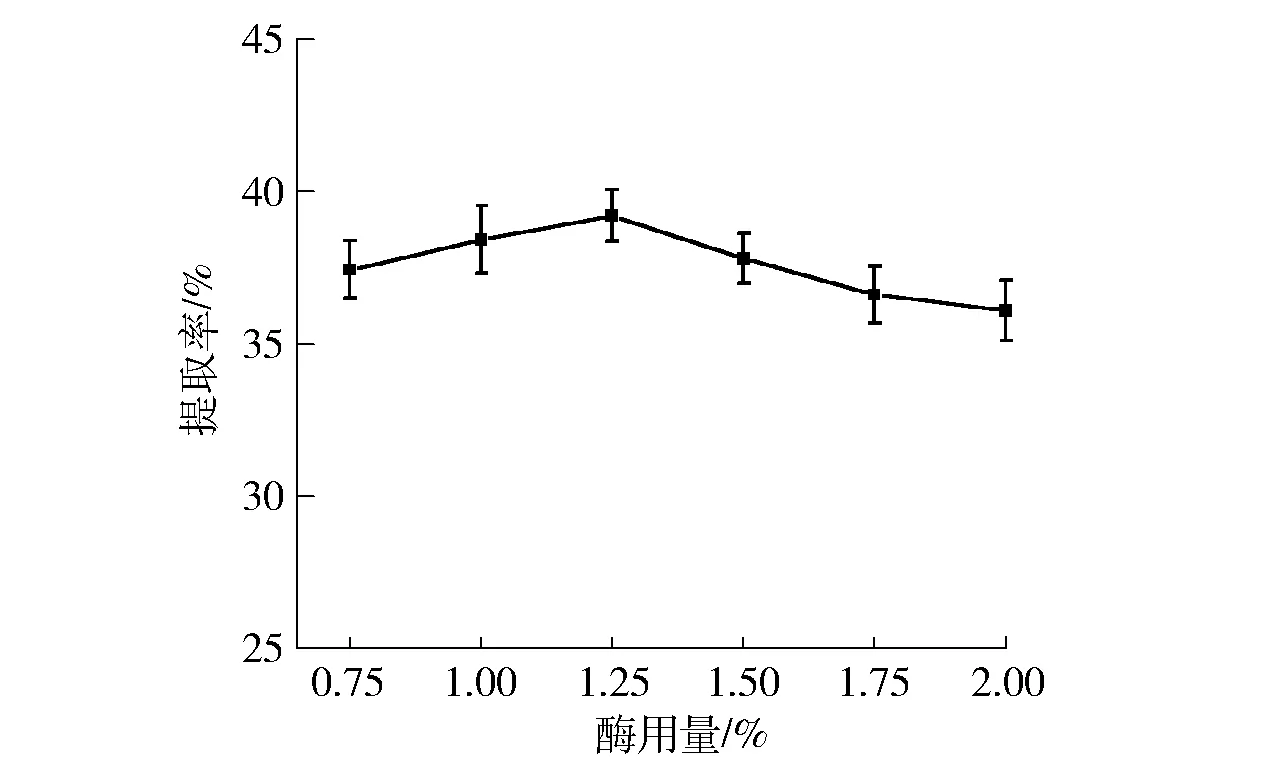
图2 酶用量与油脂体提取率的关系Fig.2 Effect of different enzymatic contents on peanut oil bodies yield
2.1.3 酶解时间对油脂体提取率的影响
酶解时间对油脂体提取率的影响规律如图3。由图3可知,随着酶解时间的增加,花生油脂体的提取率整体呈现先上升后下降的趋势,在酶解时间由40 min增加到80 min的过程中,油脂体得率上升速度较快,并在80 min时达到最大值37.87%。出现这种趋势的原因可能是在一定的时间范围内酶制剂与底物充分接触,反应速率较快,酶解充分,当反应时间增加后,底物浓度降低,反应速率慢。最终随着酶解时间继续增加,提取率基本不变,说明底物已经充分降解[12]。综合考虑提取率和生产经济成本,选择60~100 min的时间范围进行正交试验。
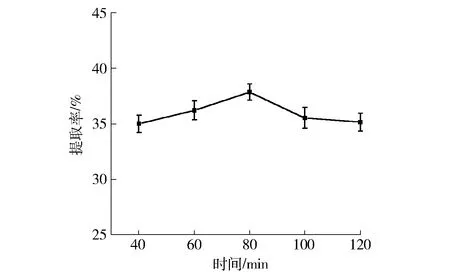
图3 酶解时间与油脂体提取率的关系Fig.3 Effect of different enzymatic time on peanut oil bodies yield
2.1.4 酶解温度对油脂体提取率的影响
酶解温度对油脂体提取率的影响规律如图4。由图4可知,花生油脂体的提取率在40~50 ℃时一直上升,在50 ℃时达到最大值,此时油脂体提取率为38.28%;从50~65 ℃油脂体提取率呈现出线性下降的趋势,这与阮瑜琳等[13]的研究结果相似。这是因为随着温度的升高,酶解温度达到了最适温度,酶解效果达到最好,温度继续升高会抑制酶的活性,使油脂体的提取率下降[14]。这与酶自身的性质有关,即酶在一定的温度范围内会表现出最大活力,而偏离最适温度时会改变整个酶分子的结构,从而使酶变性失活。综合考虑提取率和实验操作条件,选择45~55 ℃为正交设计的试验范围。
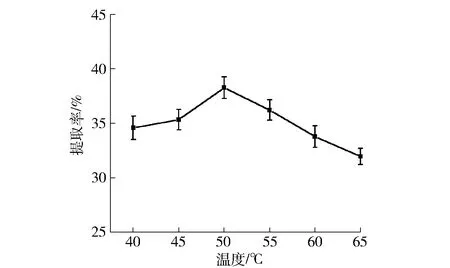
图4 酶解温度与油脂体提取率的关系Fig.4 Effect of different enzymatic temperatures on peanut oil bodies yield
2.2 正交试验结果分析
在单因素实验的基础上对复合植物水解酶提取花生油脂体的条件进行正交试验优化,试验结果和分析如表2。
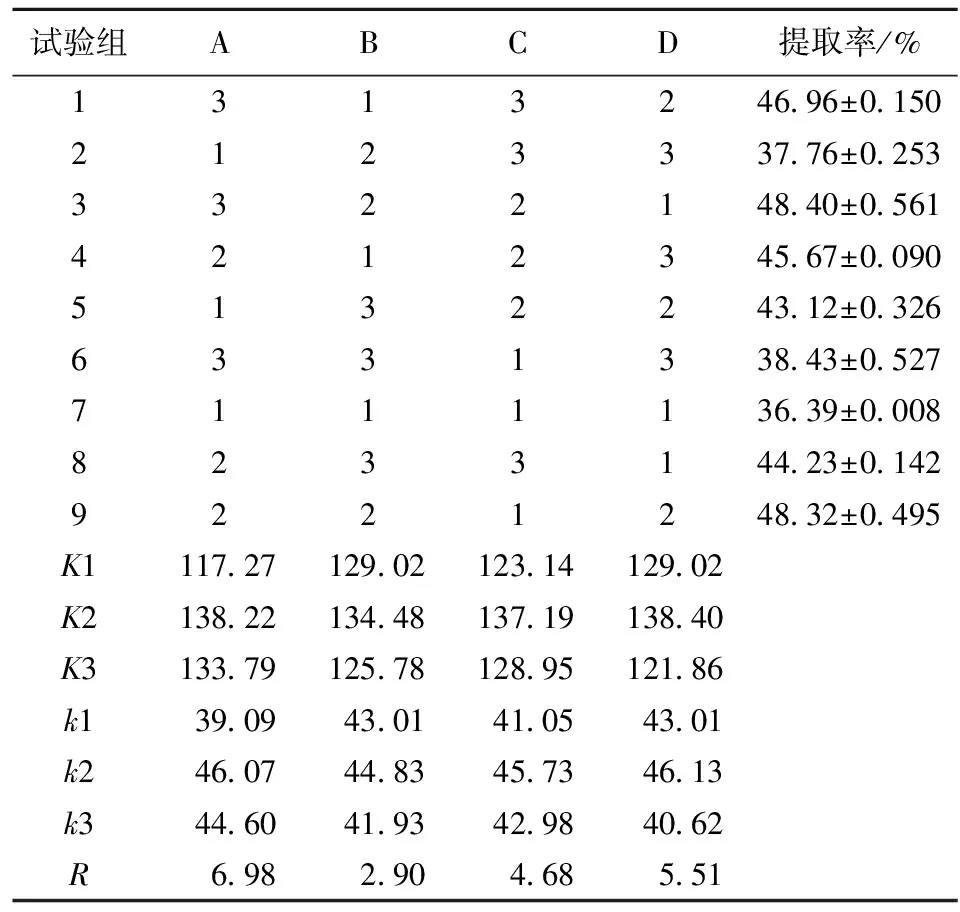
表2 正交试验结果与分析
由极差分析可得:影响花生油提取率的各因素由大到小为A(料液比)、D(酶解温度)、C(酶解时间)、B(酶用量)。正交试验结果也表明酶用量对油脂体提取率影响最小,这可能是因为酶用量实验选取的范围太小而造成结果不显著,需要进一步的研究验证。
正交试验方差分析结果见表3。由表3可知,料液比、酶用量、酶解时间、酶解温度的p值均小于0.05,说明料液比、酶用量、酶解时间、酶解温度对花生油脂体提取率的影响都非常显著。

表3 正交试验方差分析结果
根据正交试验的结果分析可知,花生油脂体提取率的优化工艺条件为料液比1∶4、酶用量1.25%、酶解时间80 min、酶解温度50 ℃。在优化工艺条件下,验证实验结果得到,花生油脂体提取率为48.92%。在不添加酶制剂而其他条件不变的情况,花生油脂体提取率仅有35%,远低于添加复合植物水解酶时的油脂体提取率。
3 结 论
利用复合植物水解酶水解花生细胞壁辅助提取花生油脂体,通过单因素实验发现:随着料液比、酶用量、酶解温度的增加,油脂体的提取率均呈现先增加后下降的趋势。在料液比1∶4 、酶用量1.25%、酶解温度50 ℃时,油脂体提取率最高。在单因素实验基础上进行正交试验,结果表明,在所选取的参数范围内,料液比、酶用量、酶解时间、酶解温度对花生油脂体提取率具有不同程度的影响,其影响顺序由高到低依次为:料液比、酶解温度、酶解时间、酶用量。根据正交试验结果得到优化的工艺条件为料液比1∶4、酶用量1.25%、酶解时间80 min、酶解温度50 ℃。在该条件下花生油脂体提取率为48.92%,而不添加酶制剂时的油脂体提取率仅为35%,因此复合植物水解酶能够提高花生油脂体提取率,具有一定的应用前景。
[1] 郝莉花, 陈复生, 刘昆仑, 等. 不同品种花生油脂体粒径电位和蛋白质组成的分析[J]. 农业工程学报, 2016, 32(18): 279-284. HAO L H, CHEN F S, LIU K L, et al. Analysis of sizes, zeta potential and protein component of oil bodies extracted from different peanut varieties [J]. Chinese Journal of Agricultural Engineering, 2016, 32(18): 279-284.
[2] PURKRTOVA Z, JOLIVET P, MIQUEL M, et al. Structure and function of seed lipid -body -associated proteins[J]. Comptes Rendus Biologies, 2008, 331(10): 746-754.
[3] HUANG A H. Oleosins and oil bodies in seeds and other organs[J]. Plant Physiology, 1996, 110(4): 1055.
[4] WU N, YANG X, TENG Z, et al. Stabilization of soybean oil body emulsions usingκ,ι,λ-carrageenan at different pH values[J]. Food Research International, 2011, 44(4): 1059-1068.
[5] NANTIYAKUL N, FURSE S, FISK I D, et al. Isolation and characterization of oil bodies from oryza sativa bran and studies of their physical properties[J]. Journal of Cereal Science, 2013, 57(1): 141-145.
[6] IWANAGA D, GRAY D, DECKER E A, et al. Stabilization of soybean oil bodies using protective pectin coatings formed by electrostatic deposition[J]. Journal of Agricultural and Food Chemistry, 2008, 56(6): 2240-2245.
[7] PAYNE G, LAN M, FOSTER T, et al. Composition and properties of the surface of oil bodies recovered fromEchiumplantagineum[J]. Colloids and Surfaces B: Biointerfaces, 2014, 116:88-92.
[8] ADAMS G G, IMRAN S, WANG S, et al. Extraction, isolation and characterisation of oil bodies from pumpkin seeds for therapeutic use[J]. Food chemistry, 2012, 134(4): 1919-1925.
[9] SUKHOTU R. 玉米胚芽油脂体的水- 酶法提取及其物理化学特性[D]. 北京: 中国农业大学, 2014.
[10] 王瑞, 童玲, 曹慧. 水酶法提取文冠果油的工艺研究[J]. 潍坊学院学报, 2016, 16(2): 11-15. WANG R, TONG L, CAO H. Technology research of aqueous enzymatic extraction ofXanthocerassorbifoliaoil[J]. Journal of Weifang University, 2016, 16 (2): 11-15.
[11] 李倩, 赵丽, 马媛, 等. 水酶法提取红花籽油工艺的研究[J]. 食品与发酵科技, 2016, 52(1): 52-59. LI Q, ZHAO L, MA Y, et al. Study on extraction process of safflower oil by aqueous enzymatic[J]. Food and Fermentation Technology, 2016, 52(1): 52-59.
[12] 黄亚芳, 李罗明, 李俊杰, 等. 水酶法提取杨梅核仁油的工艺优化[J]. 食品科学, 2016, 37(12): 65-70. HUANG Y F, LI L M, LI J J, et al. Optimization of enzyme -assisted aqueous extraction forMyricarubrakernel oil[J]. Food Science, 2016, 37(12): 65-70.
[13] 阮瑜琳, 万聪, 钟武, 等. 水酶法同时提取文冠果油及蛋白质的研究[J]. 中国油脂, 2016, 41(9): 1-6. RUAN Y L, WAN C, ZHONG W, et al. Simultaneous extraction ofXanthocerassorbifoliaBunge oil and protein by aqueous enzymatic method[J]. China Oils and Fats, 2016, 41(9): 1-6.
[14] 罗明亮, 申爱荣, 蒋丽娟. 生物酶的选择对水酶法提取蓖麻油的影响[J]. 中南林业科技大学学报, 2013, 33(9):55-59. LUO M L, SHEN A R, JIANG L J, et al. Effects of different enzymes and other factors on aqueous enzymatic extraction of castor oil[J]. Journal of Central South University of Forestry and Technology, 2013, 33(9):55-59.
(责任编辑:叶红波)
Optimization of Enzyme -Assisted Aqueous Extraction for Peanut Oil Body
ZHAO Zitong, HAO Lihua, LI Yujian, CHEN Fusheng*
(CollegeofFoodScienceandTechnology,HenanUniversityofTechnology,Zhengzhou450001,China)
In order to improve the extraction rate of peanut oil bodies,ViscozymeL. was used to assist the extraction of peanut oleosome. The effects of material ratio, enzyme concentration, incubation time, and incubation temperature on extraction rate of peanut oil body with compound plant hydrolase were investigated by using the single factor experiment. On the basis of single factor experiment, the orthogonal experiment was used to optimize the process conditions of extracting peanut oil body with compound plant hydrolase. The results showed that the influence order from high to low of the factors was material ratio, incubation temperature, incubation time, enzyme concentration. The optimum conditions were as follows: material ratio 1∶4 (g/mL), enzyme concentration 1.25%, the incubation time 80 min and the incubation temperature 50 ℃. Under the optimum conditions, the extraction rate of peanut oil body was 48.92%.
peanut; oil body; compound plant hydrolase; yield
10.3969/j.issn.2095 -6002.2017.03.004
2095 -6002(2017)03 -0031 -05

赵自通, 郝莉花, 李宇健, 等. 复合植物水解酶提取花生油脂体工艺研究[J]. 食品科学技术学报,2017,35(3):31-35.
ZHAO Zitong, HAO Lihua, LI Yujian, et al. Optimization of enzyme -assisted aqueous extraction for peanut oil body[J]. Journal of Food Science and Technology, 2017,35(3):31-35.
2017 -04 -09
国家自然科学基金资助项目(21376064;21676073);国家“863”计划项目(2013AA102208);“粮油食品加工与新技术研究”河南省优秀科技创新团队项目;中国博士后科学基金资助项目(2015M582184)。
赵自通,男,硕士研究生,研究方向为食品资源开发与利用;
TS224.4; Q814.4
A
*陈复生,男,教授,博士生导师,主要从事食品资源开发与利用方面的研究,通信作者。
