高考化学实战演练
2017-08-22本刊编辑部
■本刊编辑部
高考化学实战演练
■本刊编辑部
1.下列各项表达中正确的是( )。
A.SiO2既能表示物质的组成,又能表示物质的分子式
B.18272Hf(铪-182)与18274W(钨-182)互为同位素

D.标准状况下,质量相等,体积不相等的N2和C2H4的分子数相等
2.某链状有机物的分子式为C4H8O2,且能与NaOH溶液反应,则该有机物的同分异构体共有(不考虑立体异构)( )。
A.3种 B.4种 C.5种 D.6种
3.下列各组物质中能够发生反应,且甲为取代反应,乙为加成反应的是( )。
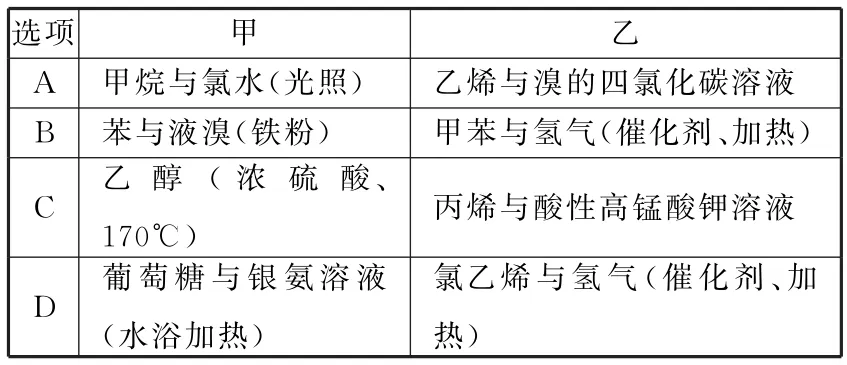
选项甲乙_A_ _甲烷与氯水(光照)__ _乙烯与溴的四氯化碳溶液_B_ _苯与液溴(铁粉)甲苯与氢气(催化剂、______加热) C乙醇(浓硫酸、170℃)丙烯与酸性高锰酸钾溶液D葡萄糖与银氨溶液(水浴加热)________ _氯乙烯与氢气(催化剂、加热)______________________
4.下表关于化学方程式的评价正确的是( )。
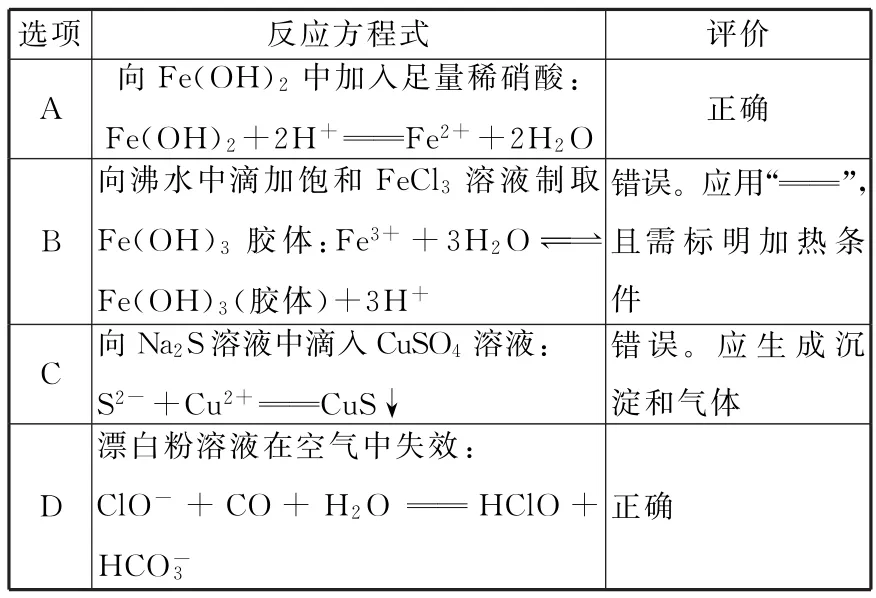
选项反应方程式评价______ A向Fe(OH)2中加入足量稀硝酸: Fe(OH)2+2H+આઆFe2++2H2O正确B向沸水中滴加饱和FeCl3溶液制取Fe(OH)3胶体:Fe3++3H2Oܪܩܒ_____Fe(OH)3(胶体)+3H+错误。应用“આઆ”且需标明加热条件C向Na2S溶液中滴入CuSO4溶液: S2-+Cu2+આઆCuS↓错误。应生成沉淀和气体________ D漂白粉溶液在空气中失效: ClO-+CO+H2OઆઆHClO+ __________HCO-3__________________________________________ _________________________正确
5.已知镍氢电池的某极是储氢合金X (合金X结合氢气的形式可表示为XH6),另一电极为NiOOH/Ni(OH)2,其总反应式为法正确的是( )。A.充电时电源的正极与电池的X极相连B.放电时负极电极反应式为XH6+6e-આઆX+6H+
C.充电时阳极电极反应式为6Ni(OH)2+6OH--6e-આઆ6NiOOH+6H2O
D.电池放电时反应了1molXH6,若用于电解水,理论上可得到16g氧气
6.下列有关说法正确的是( )。
A.某物质的水溶液显酸性,则该物质一定是酸或强酸弱碱盐
B.0.1mol·L-1醋酸溶液加水稀释时,
C.0.1mol·L-1的NH4Fe(SO4)2溶液中离子浓度大小顺序为:c(CO2-3)>c(Fe3+) =c(NH+4)>c(H+)>c(OH-)
D.0.2mol·L-1的Na2CO3溶液与0.1mol·L-1的NaHCO3溶液等体积混合: c(Na+)+c(H+)=c(HCO-3)+2c(CO2-3)+ c(OH-)
7.已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列有关说法不正确的是( )。
A.元素A、B形成的化合物在常温下一定为气体
B.一定条件下,元素C、D、E的最高价氧化物对应的水化物之间能相互发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.C、E形成的化合物在熔化时能导电,说明该化合物中一定存在离子键
8.0.98gCu(OH)2固体样品受热的热重曲线(样品质量随温度变化的曲线)如图1所示。
请回答下列问题:
(1)试确定100~270℃时固体物质A的化学式为____,写出推断过程:____。
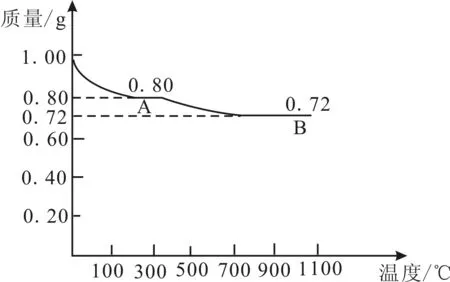
图1
(2)取第一阶段的产物A,加热至1026℃,得到一种红色固体物质B和一种气体,根据图示提供的数据写出A受热生成B的化学方程式:____。将物质B加入到足量的稀硫酸中可以得到一种蓝色溶液,在溶液底部有红色固体析出,该反应的离子方程式为____。
(3)通过上述表格中的数据及变化曲线对物质B进行的实验可以得出A与B的稳定性大小的结论是:高温时____,在酸性溶液中____。
(4)对(2)中B与稀硫酸反应后的混合体系进行过滤,在滤液中通入足量硫化氢,使溶液中的Cu2+转化为CuS,测得溶液的pH= 1,c(S2-)=5.0×10-6mol·L-1。则原来滤液中的c(Cu2+)=____,沉淀后的溶液中c(Cu2+)=____。[Ksp(CuS)=8.5×10-45]
9.研究碳及其化合物的性质、用途具有非常重要的意义。
(1)在常温下,碳酸与次氯酸的电离常数如表1所示。
请根据上述酸的电离常数回答下列问题:
①相同温度下,浓度均为0.1mol·L-1的NaClO溶液、Na2CO3溶液和NaHCO3溶液,溶液pH最大的是____(填化学式)。
②相同温度下,1mol·L-1的HClO溶液的电离常数____(填“大于”、“小于”或“等于”) 0.1mol·L-1的HClO溶液的电离常数。
③在等物质的量浓度的NaClO和NaHCO3的混合溶液中,下列各种粒子浓度关系正确的是____。

表1___
A.c(HCO-3)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO-3)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO-3)+ c(H2CO3)
D.c(Na+)+c(H+)=c(HCO-3)+ c(ClO-)+c(OH-)
(2)甲醇是目前推广车用燃料,该物质可用天然气(主要成分为CH4)合成。变化的曲线是_____(填图2中的序号)。
(3)工业上大量的氢气来源于焦炭与水蒸气在高温下的反应: C(s)+H2O(g)H2(g)。在一定温度下,向体积为2L的恒容密闭容器中加入1molC和1molH2O发生上述反应。
①一段时间后,下列物理量不再发生变化时,能表明该反应已达到平衡状态的有____(填序号)。
A.容器内混合气体的密度
B.容器内混合气体的压强
C.H2O(g)的物质的量浓度
D.CO的体积分数
②若2min时反应达到平衡,混合气体的平均相对分子质量为16,则平均反应速率v(CO)=____;该温度下的平衡常数K=____。
③平衡时,若增加C的物质的量,则平衡____(填“正向”、“逆向”或“不”)移动。
(4)燃料电池所用燃料为可燃性气体,例如以CO为燃料就可以制作原电池,这种电池的一个电极中通入O2,另一个中通入CO,电解质采用的是熔融碳酸盐,由此可知该燃料电池放电时的负极反应式为____,如果使用该电池电解饱和食盐水制取NaClO,则理论上生成1molNaClO需要标准状况下的氧气的体积为____L。
10.某化学研究性学习小组同学提出从含铜电缆废料中提取铜的两种方案,并向老师咨询,老师就以下几个方面与同学们展开讨论。
方案甲:
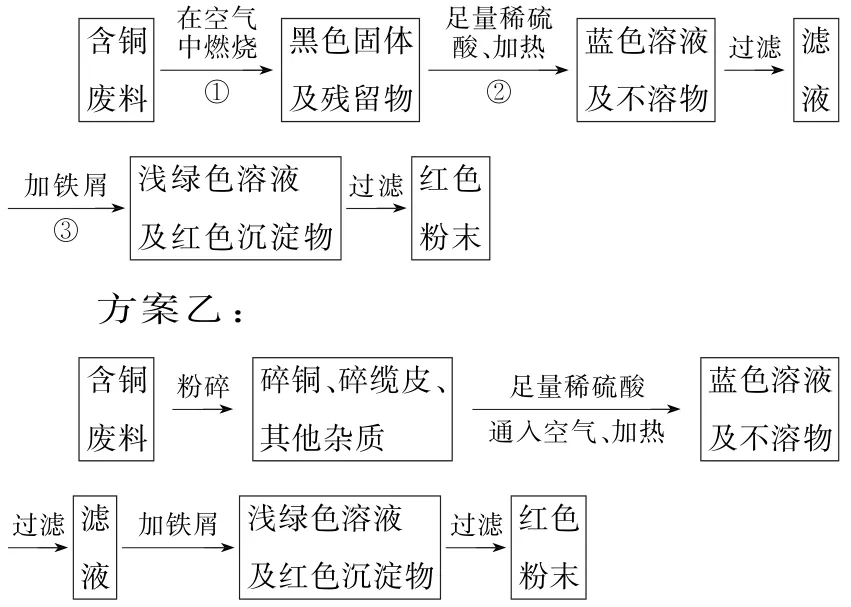
(1)两个方案哪个符合当前生产的绿色理念,为什么?
答:____。
(2)写出方案甲步骤②③中与铜有关的反应的离子方程式:____。
(3)老师建议,无论是方案甲还是方案乙,在“加铁屑”这一步时,均应加入略过量的铁屑,目的是____。
(4)老师请同学们用化学方法检验红色粉末中是否含有过量的铁屑。请你填写表2。
表2
(5)为了提高原料的利用率,老师建议把最后一步所得浅绿色滤液通过蒸发、冷却结晶、过滤、洗涤、自然干燥,得到一种带结晶水的硫酸亚铁晶体。
研究小组按老师的建议完成上面操作步骤,获得晶体后对其进行检测。
①先取ag晶体进行脱水实验,获得无水固体(a-1.26)g。
②将无水固体溶于足量的水配成溶液后滴加1.00mol·L-1的BaCl2溶液,当滴加10.00mL溶液时,沉淀恰好完全。
研究小组通过计算测知该晶体的化学式为____。
11.【化学——选修3:物质结构与性质】
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数依次增大,其相关信息如表3。

表3
(1)N元素的基态原子的核外电子排布式为____,与N同周期的所有元素的基态原子中最外层电子数与N原子相同的元素有____(填元素符号)。
(2)XY3分子的空间构型为____,中心原子X的杂化类型为____。
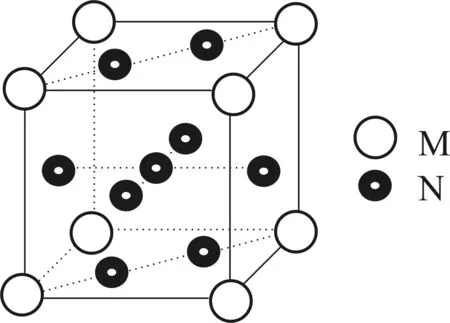
图3
(3)图3是金属M和N所形成的某种合金的晶胞结构示意图,则该合金中M和N的原子个数比为____。
(4)单质W的晶体类型为____,1mol晶体中含有W—W键的数目为____(设NA为阿伏加德罗常数的值)。
(5)Y与W形成的分子中,其键角为____,其中所含σ键个数为____,该分子内所含化学键为____(填“极性键”或“非极性键”)。
12.【化学——选修5:有机化学基础】
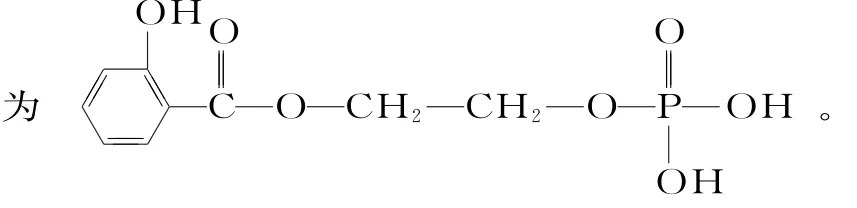
已知H是一种重要的化学工业的中间体,在很多领域有重要的应用。其结构简式它是由最常见的几种化工原料经过一系列反应制得的。其转化过程如下(部分产物省略)。
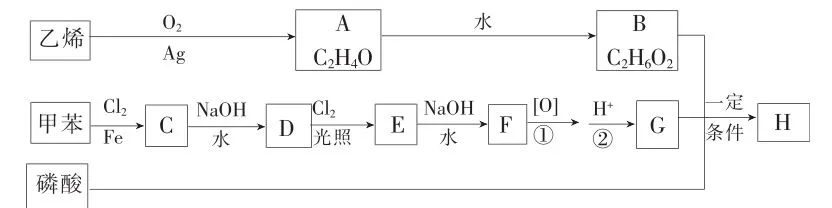
已知以下信息:
C核磁共振氢谱中有五个峰;F能发生银镜反应;同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
试回答下列问题:
(1)A是环状化合物,它的结构简式为____。
(2)由甲苯生成C的反应类型为____。C的化学名称为____。
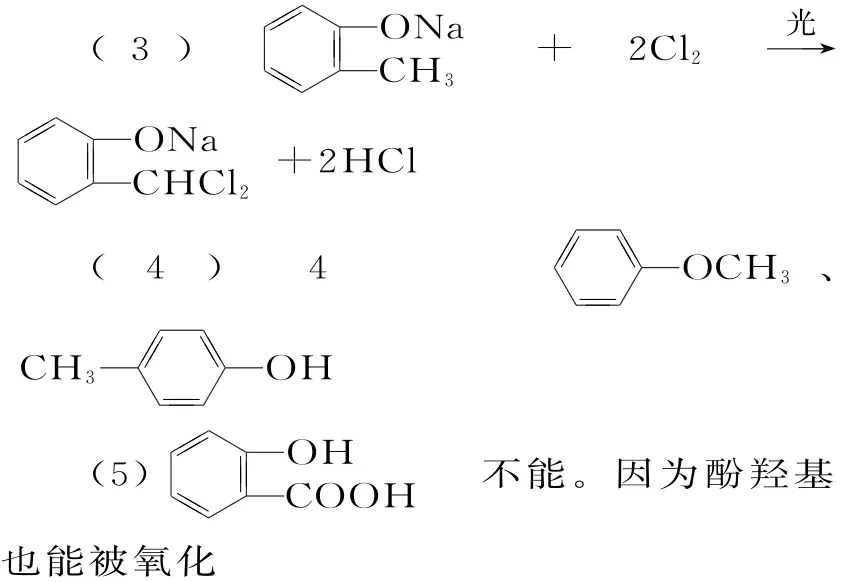
(3)由D生成E的化学方程式为____。
(5)G的结构简式为____。F→G需经历两步,①②能颠倒吗?为什么?____。
参考答案
1.D 2.B 3.B 4.B 5.C 6.D 7.A
8.(1)CuO

解得:n=2,故分解后固体氧化物为CuO。
(2)4CuO高温2CuO+O↑ CuO+આઆ2222H+આઆCu2++Cu+H2O
(3)Cu2O比CuO稳定 CuO比Cu2O稳定
(4)0.05mol·L-11.7×10-39mol·L-1
9.(1)①Na2CO3②等于 ③A
(2)-126 Ⅰ
(3)①ABCD ②0.125mol·L-1·min-10.25mol·L-1③不
10.(1)方案乙。方案甲步骤①中会产生污染空气的气体、粉尘、烟雾等

(3)确保铜完全被置换出来
(4)如表4。
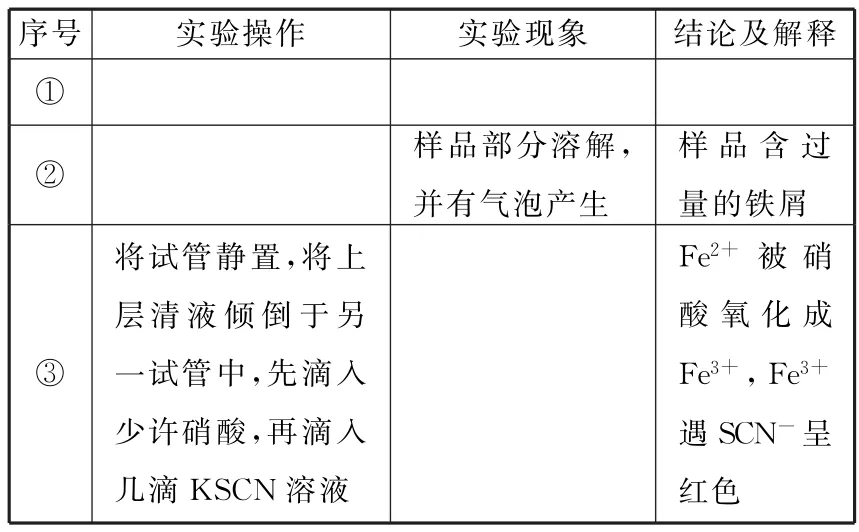
表4
(5)FeSO4·7H2O
11.(1)1s22s22p63s23p63d104s1或[Ar]3d104s1K、Cr
(2)平面三角形 sp2(3)1∶5 (4)原子晶体 2NA
(5)109°28' 4 极性键

(2)取代反应 2-氯甲苯(或邻氯甲苯)
(责任编辑 谢启刚)
