高考化学冲刺试题
2017-08-22河北省宣化县第一中学栾春武
■河北省宣化县第一中学 栾春武
高考化学冲刺试题
■河北省宣化县第一中学 栾春武
可能用到的相对原子质量:H1 He4
C12 N14 O16 Na23 Al27 Cl35.5 K39 Mn55 Fe56 Ni59 Cu 64
第Ⅰ卷(共48分)
一、选择题:本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意。
1.化学在生产、生活中有广泛应用,下列对应关系正确的是( )。
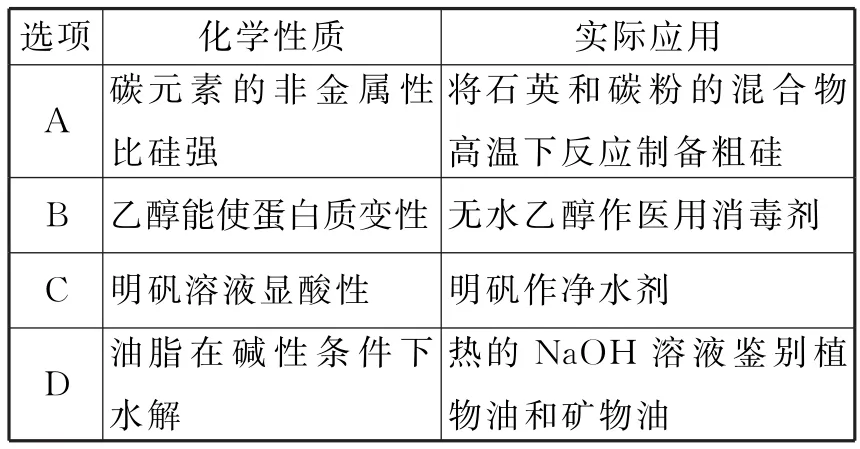
选项化学性质实际应用A碳元素的非金属性比硅强_____________将石英和碳粉的混合物高温下反应制备粗硅___ _B_乙醇能使蛋白质变性无水乙醇作医用消毒剂_C_明矾溶液显酸性明矾作净水剂D油脂在碱性条件下水解_______________热的NaOH溶液鉴别植物油和矿物油__________
2.下列说法正确的是( )。
A.溶液和胶体的本质区别为是否能产生丁达尔效应
B.K2Cr2O7溶液和氢溴酸能存放于同一药品橱内
C.用带玻璃塞的细口试剂瓶保存氢氟酸
D.CH4和C2H4均属于常用危险品中的易燃气体
3.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )。
A.4.0g氦气中含有的最外层电子数为4NA
B.3.9g2H37Cl中含有的中子数为2.1NA
C.标准状况下,11.2L丙烷中含有的非极性键数目为NA
D.100mL1mol·L-1CH3COOH溶液中含有的分子数目大于0.1NA
4.已知:25℃时,Ksp[Mg(OH)2]=2.0× 10-11,Ksp[Mn(OH)2]=2.0×10-13。该温度下,关于含有Mg(OH)2和Mn(OH)2两种固体的悬浊液,下列说法正确的是( )。
B.若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小
C.若加入少量MgCl2,溶液中的c(Mg2+)和c(Mn2+)均增大
D.若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变
5.下列离子方程式正确的是( )。
A.加热TiCl4浓溶液制备TiO2·xH2O: Ti4++(x+2)H2OઆઆTiO2·xH2O+4H+
B.(NH4)2Fe(SO4)2溶液中加入少量KOH溶液:+OH-આઆNH3↑+H2O
C.钢铁发生吸氧腐蚀时的正极反应:O2+4H++4e-આઆ2H2O
D.酸性KI溶液中通入O2:4H++2I-+ O2આઆ2H2O+I2
6.下列说法正确的是( )。
A.化学反应中,化学能全部转化为热能
C.测定中和热时,用铜制搅拌棒代替环形玻璃搅拌棒不影响测定结果
D.反应C(s)+CO2(g)આઆ2CO(g) ΔH>0在较高温度下能自发进行
A.分子式为C15H14O4
B.苯环上的一氯代物有7种
C.能发生氧化反应和取代反应
D.1molM与足量的Na反应,最多消耗3molNa
8.25℃时,下列溶液中的微粒浓度的关系正确的是( )。
A.pH=4的CH3COOH溶液中,水电离出来的c(H+)=1.0×10-4mol·L-1
B.物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中的c():①<②
C.pH=3的0.1mol·L-1NaHC2O4溶液中:c(Na+)>c()>c(H+)> c(OH-)
D.0.1mol·L-1的Na2CO3溶液中: c(OH-)=c()+c(H2CO3)+c(H+)
9.下列实验操作和现象所得结论正确的是( )。


图1
10.一种碳纳米管新型二次电池的装置如图1所示。该电池放电时,下列说法中正确的是( )。
A.离子交换膜选用阳离子交换膜(只允许阳离子通过)
B.正极的电极反应为NiO(OH)+H2O +e-આઆNi(OH)2+OH
C.导线中通过1mol电子时,理论上负极区溶液质量增加1g
D.充电时,碳电极与电源的正极相连
11.四种短周期主族元素X、Y、Z、W的原子序数依次增大。化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol·L-1甲溶液与W同周期,且W的最高正价与最低负价的代数和为4。下列说法中正确的是( )。
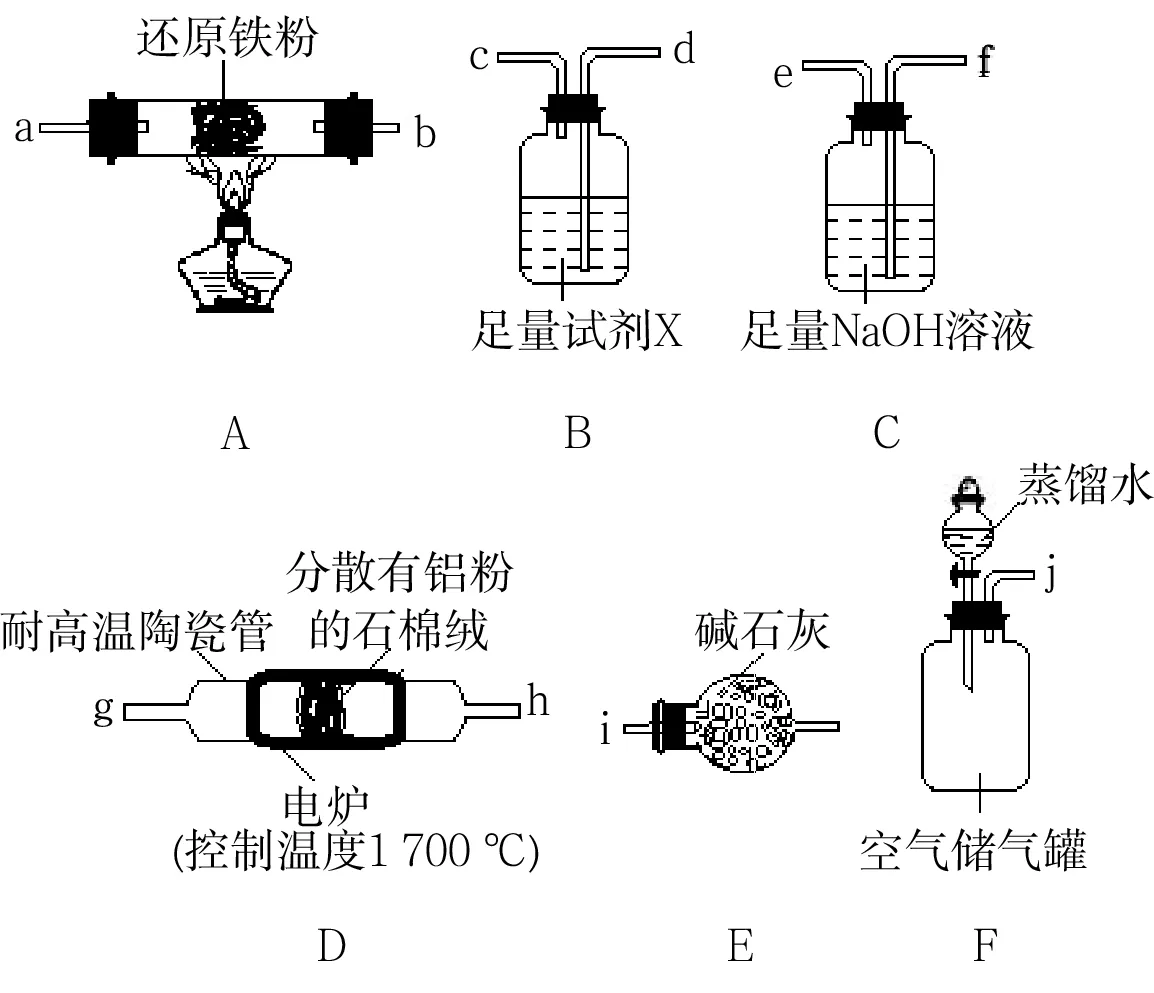
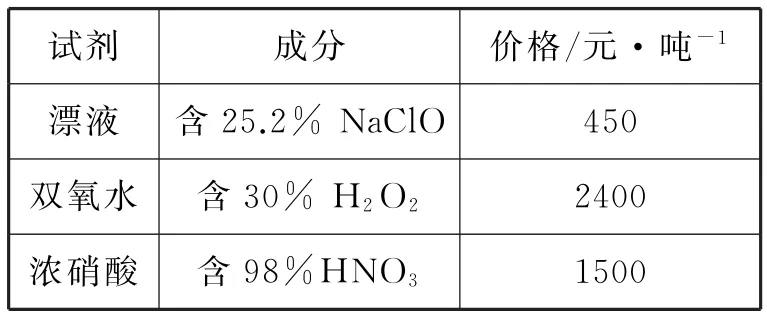
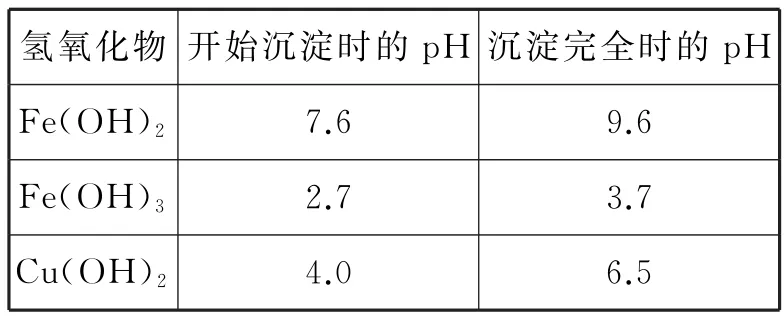
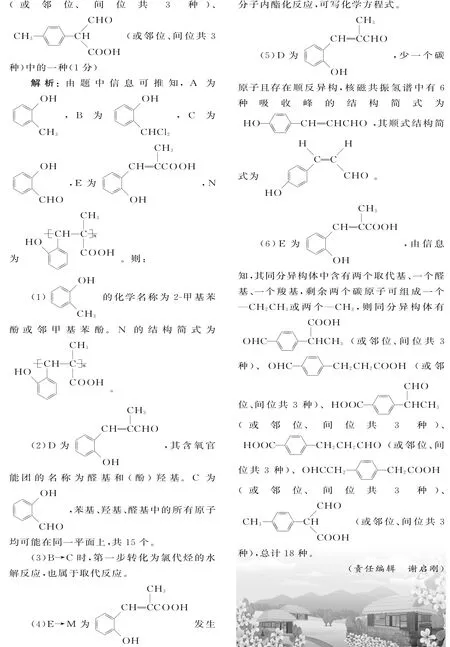
A.原子半径:X B.最简单氢化物的稳定性:Y>W C.Z分别与Y、Z组成的化合物中化学键类型均相同 D.粘有W的单质的试管可用酒精洗涤 12.T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应: NH2COONH4(s)ܪܩܒCO2(g)+ 2NH3(g) ΔH>0 5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是( )。 A.0~5min内,v(CO2)= 0.16mol·L-1·min-1 B.氨气体积分数不变时,该反应一定达到平衡状态 C.平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大 D.其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80% 13.乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图2所示。对于在密闭容器中进行的合成反应,下列说法不正确的是( )。 图2 A.H2SO4是乙烯间接水合法合成乙醇的催化剂 B.缩小容器容积,乙烯的转化率增大 C.反应①和反应②均为放热反应 D.反应②的反应热ΔH= -(E3-E4)kJ·mol-1 14.已知:加热条件下,含高价态锰元素的化合物能被Cl-还原为Mn2+,氧化产物为Cl2。将1.0molKMnO4加热,生成标准状况下5.6L气体后停止加热;向残留固体中加入足量浓盐酸,在加热条件下充分反应,又生成bmol气体,则b等于( )。 A.2 B.1 C.0.5 D.0.25 15.某小组以石膏(CaSO4·2H2O)为主要原料制备(NH4)2SO4的流程如下: 下列说法正确的是( )。 A.气体B是NH3,可循环利用 B.操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗 C.操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4 D.整个过程的总反应方程式为CaSO4+ CO2+2NH3+H2OઆઆCaCO3↓+ (NH4)2SO4 图3 16.25℃时,NH3·H2O的电离平衡常数Kb=1.75×10-5。该温度下,用0.01mol·L-1盐酸滴定10mL amol·L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图3所示。下列说法正确的是( )。 B.原氨水的物质的量浓度约为1.006× 10-2mol·L-1 C.B、D两点溶液中水电离出来的c(OH-):B D.C点溶液中的H2O不发生电离 二、非选择题:本卷包括必考题和选考题两部分。第17-19题为必考题,每个试题考生都必须作答。第20-21题为选考题,考生根据要求作答。 (一)必考题:共37分。 17.(13分)氮化铝(AlN)是一种综合性能优良的陶瓷材料,能缓慢水解,不耐酸碱腐蚀。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。 Ⅰ.制备AlN。 (1)实验时,以空气为原料制备N2。按气流由左向右的方向,图4所示装置的正确连接顺序为:j→____→i(填仪器接口字母编号)。 图4 (2)上述装置中,需要检漏的仪器名称为____。 (3)试剂X的作用为____。 (4)装置D中发生反应的化学方程式为____。 Ⅱ.测定产品纯度。 (5)设计实验证明装置D的产品中含有Al单质:____。 (6)测定产品纯度:取装置D中产品4.37g,加入足量NaOH浓溶液;通入水蒸气,将生成的气体全部蒸出,用V1mL c1mol·L-1的盐酸吸收;以酚酞作指示剂,用c2mol·L-1的NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗V2mLNaOH标准溶液。则: ①达到滴定终点的现象为____。 ②产品中AlN的质量分数为____。 18.(12分)以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下。 已知:ⅰ.溶液中离子浓度小于或等于1.0×10-5mol·L-1时,认为该离子沉淀完全。 ⅱ.相关试剂成分和价格如表1所示。 表1 ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。 表2 请回答: (1)FeCu4SiO5(OH)4用氧化物的形式可表示为____。 (2)结合题中信息,所选用的试剂1的名称为____;加入该试剂时,所发生反应的离子方程式为____。 (3)加入试剂2,需调节溶液的pH的合理范围为____;试剂2可以选择下列物质中的____(填选项字母)。 A.Cu B.CuO C.Cu(OH)2D.Fe (4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=____。 (5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632× 104C的电量时,理论上阴极质量增加____g。(已知:1个电子的电量为1.6×10-19C) ③H2(g)+Cl2(g)આઆ2HCl(g) ΔH3= -185kJ·mol-1 ④相关化学键的键能数据如表3所示。 表3 请回答: (1)根据化学反应原理,缩小容器容积对反应②的影响为____。 (2)根据反应①和表中数据计算,x= ____。 ①ΔH4=____。 ②该反应正、逆反应平衡常数与温度的关系如图5所示,其中表示正反应平衡常数K正的曲线为____(填“A”或“B”),理由为____。 图5 ③T1℃时,该反应的平衡常数K= ____。该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol始时,v(正)____(填“>”“<”或“=”)v(逆)。 (二)选考题:共15分。请考生从两道题中任选一题作答。如果多做,则按所做的第一题计分。 20.【化学——选修3:物质结构与性质】(15分) 铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答: (1)基态Cu+的价层电子排布图为____。基态Fe3+中有____种运动状态不同的电子。 (2)铁单质能形成Fe(CO)5,其熔点为-21℃,沸点为102.8℃。则Fe(CO)5晶体的类型为____;其分子σ键和π键的数目之比为____。与CO互为等电子体的离子符号为____(任写一种)。 (3)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为____。 (4)[Cu(NH3)4]SO4中,所含基态非金属原子的第一电离能由小到大的顺序为____。阴离子的空间构型为____;其中心原子的杂化轨道类型为____。 (5)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为apm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm。则两种晶体中,铁原子和铜原子的配位数之比为____;晶体的密度之比为____(用代数式表示)。 21.【化学——选修5:有机化学基础】(15分) A是重要的有机合成中间体,以A为原料合成香料M和线型高分子树脂N的路线如下所示(部分反应条件和物质略去)。 已知:①A是芳香烃的含氧衍生物,其蒸气密度是相同条件下氢气密度的54倍; ②有机物分子中,同一个碳原子上连接两个—OH不稳定,会自动失水; ③RCHO+R'CH2CHO表示烃基或氢原子)。 请回答: (1)A的化学名称为____。N的结构简式为____。 (2)D中含氧官能团的名称为____。C的分子中最多有____个原子共平面。 (3)B→C时,第一步转化的反应类型为____。 (4)E→M的化学方程式为____。 (5)L是D的一种同系物,比D少1个碳原子且存在顺反异构;核磁共振氢谱中有6种吸收峰。则L的顺式结构简式为____。 (6)同时满足下列条件的E的同分异构体有____种(不考虑立体异构),任写其中一种的结构简式:____。 ①苯环连有两个取代基 ②能发生银镜反应 ③能与NaHCO3反应生成CO2 参考答案: 1.D 解析:石英与碳粉的反应中,碳作还原剂,不能体现碳比硅的非金属性强,A项错误;医用酒精的体积分数为75%,而非无水乙醇,B项错误;明矾净水的原理是Al3+水解生成Al(OH)3胶体,吸附水中悬浮杂质, C项错误;植物油的主要成分为酯类,在热的NaOH溶液中水解使液体不分层,而矿物油主要成分为烃类,在碱性条件下不能水解,液体分层,故热的NaOH溶液可用于鉴别植物油和矿物油,D项正确。 2.D 解析:溶液和胶体的本质区别为分散质粒子大小不同,A项错误;不同类别的试剂不能存放于同一药品橱内,B项错误;氢氟酸能腐蚀玻璃,C项错误;CH4和C2H4属于气态烃类,易燃烧,D项正确。 3.A 解析:氦分子为单原子分子,4.0g氦气含有1molHe原子,最外层电子数为2NA,A项错误;1mol2H37Cl含有的中子数为21NA,3.9g2H37Cl的物质的量为0.1mol,含有的中子数为2.1NA,B项正确;1mol丙烷中含有的非极性键数目为2NA,则0.5mol丙烷中含非极性键数目为NA,C项正确; CH3COOH溶液中含有CH3COOH和H2O分子,故100mL1mol·L-1CH3COOH溶液中含有的分子数目大于0.1NA,D项正确。 5.A 解析:TiCl4水解生成TiO2·xH2O, A项正确;(NH4)2Fe(SO4)2溶液中加入少量KOH溶液时,OH-先与Fe2+反应,B项错误;吸氧腐蚀的正极反应式为O2+2H2O+ 4e-આઆ4OH-,C项错误;酸性KI溶液中通入O2的离子方程式为4H++4I-+O2આઆ2H2O+2I2,D项错误。 6.D 解析:化学反应中,化学能可能转化为热能、光能、电能等多种形式的能量,A项错误;碳的燃烧热为1mol碳完全燃烧生成CO2放出的热量,B项错误;铜制搅拌棒散热快,所测放热值偏小,C项错误;反应自发进行的条件为ΔG=ΔH-TΔS<0,C(s)+ CO2(g)આઆ2CO(g) ΔH>0为熵增的吸热反应,故需在较高温度下自发进行,D项正确。 7.B 解析:由结构简式知M的分子式为C15H14O4,A项正确;由对称原则和单键可旋转的特点,M苯环上的一氯代物有4种,B项错误;M能燃烧,且醇羟基也能被氧化,故能发生氧化反应,羧基、羟基、苯环上的氢原子均能发生取代反应,C项正确;醇羟基、羧基均能与Na反应,故1molM与足量的Na反应,最多消耗3molNa,D项正确。 8.C 解析:pH=4的CH3COOH溶液中,水电离出来的c(H+)=1.0×10-10mol·L-1,A项错误;物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中的c():①>②,B项错误;pH=3的0.1mol·L-1NaHC2O4溶液中,c(Na+)>c(),的电离程度大于水解程度,故c(H+)>c(OH-),少量电离, c()>c(H+),C项正确;由质子守恒式知,c(OH-)=c)+2c(H2CO3)+ c(H+),D项错误。 9.A 解析:由现象,KNO3不水解而Na2SiO3水解,则酸性:HNO3>H2SiO3,非金属性:N>Si,A项正确;使湿润的KI-淀粉试纸变蓝的气体不一定为Cl2,B项错误;浓硫酸不能吸收挥发出来的HCl,CuSO4也不能检测SO2中混有的HCl,C项错误;FeCl3与Cu反应还会有CuCl2生成,D项错误。 10.B 解析:由信息知,碳电极为负极,电极反应式为H2+2OH--2e-આઆ2H2O, Ni电极为正极,电极反应式为NiO(OH)+ H2O+e-આઆNi(OH)2+OH-,故离子交换膜应选用阴离子交换膜,A项错误、B项正确;导线中通过1mol电子时,负极表面有0.5molH2参加反应,溶液质量增加1g,同时有1molOH-通过阴离子交换膜迁移进负极区,溶液质量又增加17g,共增加18g,C项错误;充电时,碳电极与电源的负极相连, D项错误。 11.B 解析:由信息推知,X、Y、Z、W分别为H、O、Na、S。则原子半径:H 12.D 解析:由信息知,平衡时, NH2COONH4(s)的物质的量为0.2mol,生成的CO2为0.8mol,NH3为1.6mol。0~5min内,用CO2表示该反应速率为项错误;起始只加入NH2COONH4(s),从反应开始到建立平衡,氨气的体积分数保持不变,B项错误;该反应的平衡常数K= c(CO2)·c2(NH3),缩小容器容积,平衡常数不变,则c(CO2)不变,C项错误;原容器中NH2COONH4的转化率为80%,该反应为吸热反应,改为绝热容器后,反应开始,容器内温度降低,反应向正向进行的程度小, NH2COONH4的转化率减小,D项正确。 13.D 解析:由图像信息知,乙烯间接水合法合成乙醇的两步反应分别为: 14.A 解析:KMnO4中Mn原子得电子的总物质的量为1.0mol×5=5.0mol。生成O2时氧原子失电子的物质的量为原子失电子的物质的量为2bmol,根据电子守恒得,1.0mol+2b=5.0mol,b=2,A项正确。 15.D 解析:由信息,A为NH3,B为CO2,滤渣为CaCO3,A项错误;过滤不需分液漏斗,B项错误;(NH4)2SO4受热易分解, C项错误;整个过程完成了CaSO4转化为CaCO3并制备(NH4)2SO4的过程,D项正确。 16.B 解析:一定温度下,适当稀释氨水,c(OH-)减小,c(NH+4)减小,Kw不变,图知,盐酸和氨水等体积混合,溶液的pH= 7,则c(OH-)=c(H+)=1×10-7mol·L-1, c()=c(Cl-)=0.01mol·L-1÷2= 0.005mol·L-1,c(NH3·H2O)=amol·L-1÷ 2-0.005mol·L-1,根据:Kb=1.75× 10-5=0.005mol·L-1×1×10-7mol·L-1÷ (amol·L-1÷2-0.005mol·L-1),计算得a约为1.006×10-2mol·L-1,B项正确;B点溶液为NH3·H2O和NH4Cl的混合液, pH=9时,溶液中水电离出来的c(H+)= 1×10-9mol·L-1,D点溶液为NH4Cl和HCl的混合液,pH=5时,溶液中水电离出来的c(OH-)=1×10-9mol·L-1,二者水电离程度相同,C项错误;C点溶液显中性,水电离出来的c(OH-)=c(H+),D项错误。 17.(13分)Ⅰ.(1)fedcab(或ba)gh (或hg)(2分) (2)分液漏斗(1分) (3)吸收空气中的水蒸气,避免其与还原铁粉反应干扰实验(2分,其他合理答案也给分) Ⅱ.(5)取D中产品少量加入足量稀硫酸,有无色无味的可燃性气体生成,则产品中含有Al单质(2分,其他合理答案也给分) (6)①滴入最后一滴NaOH标准溶液时,溶液从无色恰好变为浅红色,半分钟不变色(2分) 解析:Ⅰ.(1)高温下,空气中的CO2、O2和H2O(g)会干扰实验,应先用NaOH溶液除去CO2,再用浓硫酸除去水蒸气,最后用还原铁粉除掉O2,进而使N2与Al高温反应,最后用碱石灰阻止空气进入装置,避免产品变质。 (2)由题图信息知,该装置中的分液漏斗洗净后需检漏。 (3)由题中信息知,装置C中NaOH溶液的作用是吸收空气中的CO2,装置A中还原铁粉的作用为除去O2,故试剂B中试剂X为浓硫酸,其作用是干燥氮气,避免水蒸气进入装置A中与还原铁粉反应。 (4)装置D为生成AlN的装置,可写反应方程式。 Ⅱ.(5)向含有AlN和Al的固体混合物中加入稀硫酸,AlN生成Al2(SO4)3和(NH4)2SO4,Al生成Al2(SO4)3和H2,检验H2的生成即可证明有Al单质。 (6)①强碱滴定强酸时,以酚酞为指示剂,颜色变化描述为由无色变为浅红色时,更接近恰好完全反应,滴定误差更小。 ②由关系式AlN~NH3~HCl, NaOH~HCl可知,n(AlN)=n(HCl)-n(NaOH),计算可得AlN的质量分数为 18.(12分)(1)FeO·4CuO·SiO2·2H2O(1分) (2)漂液(1分) ClO-+2Fe2++2H+આઆCl-+2Fe3++H2O(2分) (3)3.7≤pH<4.0(2分) BC(2分,漏选得1分,错选不得分) (4)1.0×10-20(2分) (5)32(2分) 解析:(1)硅酸盐改写成氧化物形式时,根据组成和元素守恒,按照相对活泼金属氧化物→相对不活泼金属氧化物→SiO2→H2O的顺序书写。 (2)氧化1molFe2+所需NaClO、H2O2、HNO3的物质的量分别为0.5mol、0.5mol、1mol,质量分别为37.25g、17g、63g,费用分别为37.25g÷25.2%×450元÷106g= 0.067元、17g÷30%×2400元÷106g= 0.136元、63g÷98%×1500元÷106g= 0.096元,故选漂液可以节约成本,引入的离子不干扰后续生产,也不产生污染性气体。根据氧化还原反应和离子反应的配平原则,可写离子方程式。 (3)加入试剂2的目的是为了使Fe3+沉淀完全而Cu2+不沉淀,由题表信息可知调节pH的范围。加入难溶性的CuO和Cu (OH)2以增大pH,使Fe3+沉淀完全而Cu2+不沉淀,且不引入新杂质,故选B、C。 (4)由题表信息,在25℃、Cu2+沉淀完全时,c(Cu2+)=1.0×10-5mol·L-1;溶液的pH=6.5,则c(OH-)=10-7.5mol·L-1,则Ksp[Cu(OH)2]=1.0×10-5×(10-7.5)2= 1.0×10-20。 (5)导线中通过9.632×104C的电量时,转移电子的物质的量为1mol,则阴极生成Cu的质量为0.5mol×64g·mol-1=32g。 19.(12分)(1)反应速率加快,平衡向正反应方向移动,反应物的转化率增大(2分,速率、平衡两点变化,每答出一点得1分) (2)615(2分) (3)①-118kJ·mol-1(2分) ②B(1分) 该反应的正反应方向为放热反应,升高温度,平衡常数减小(2分) ③1(2分) =(1分) 解析:(1)反应②为气体气体分子总数减小的反应,则缩小容器容积,反应速率加快,平衡向正反应方向移动。 (2)反应热ΔH=反应物的总键能-生成物的总键能,由反应①ΔH1=-54kJ·mol-1=xkJ·mol-1-348kJ·mol-1+432kJ·mol-1-412kJ·mol-1-341kJ·mol-1,则x=615。 (3)①ΔH4=ΔH1-ΔH2+ΔH3= -118kJ·mol-1。 ②由ΔH4=-118kJ·mol-1,该反应的正向为放热反应,升高温度,平衡常数减小,则为曲线B。 ③由图知,T1℃时,正、逆反应的平衡常数相等,又因为正、逆反应平衡常数互为倒数,则正反应和逆反应的平衡常数均为1。由题中数据计算得Qc=1=K,则开始时v(正)=v(逆)。 (2)分子晶体(1分) 1∶1(2分) CN-(或C22-等合理答案即可得分)(1分) (3)电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应(2分) (4)N>O>S>H(2分) 正四面体(1分) sp3(1分) 解析:(1)铜元素的原子序数为29,则基态Cu+的价层电子电子排布式为3d10。铁元素的原子序数为26,基态Fe3+的电子排布式为1s22s22p63s23p63d5,则其含有23种运动状态不同的电子。 (2)Fe(CO)5的熔沸点相对较低,故为分子晶体;分子中含有10个σ键和10个π键,个数之比为1∶1。根据等电子体的含义,可写出与CO互为等电子体的离子符号。 (3)某些金属元素的焰色反应的微观原因是电子跃迁释放的光能,使灼烧时火焰呈现特殊颜色。 (4)[Cu(NH3)4]SO4中的非金属元素为N、O、S、H,根据其基态原子的非金属性和各能级轨道的电子排布特点可比较其第一电离能的大小顺序。SO24-中S原子的价层电子对数目为4,则其轨道杂化类型为sp3,SO24-的空间构型为正四面体。 (5)体心立方堆积的晶胞中,铁原子的配位数为8,面心立方最密堆积的晶胞中,铜原子的配位数为12,故二者配位数之比为2∶3。铁单质的晶体的密度为 21.(15分)(1)2-甲基苯酚或邻甲基苯酚

第Ⅱ卷(共52分)