苗期耐低氮基因型苦荞的筛选及其评价指标
2017-08-22楚张永清路之娟刘丽琴
张 楚张永清,2,*路之娟刘丽琴
1山西师范大学生命科学学院,山西临汾 041004;2山西师范大学地理科学学院,山西临汾 041004
苗期耐低氮基因型苦荞的筛选及其评价指标
张 楚1张永清1,2,*路之娟1刘丽琴1
1山西师范大学生命科学学院,山西临汾 041004;2山西师范大学地理科学学院,山西临汾 041004
土壤缺氮是造成我国黄土高原冷凉地区农业低产的主要原因。为了筛选耐低氮苦荞基因型及适宜鉴定指标,采用苗期水培方式,测定9个不同基因型苦荞在不同氮水平下的农艺性状、生理特性及植株氮素利用等指标,采用隶属函数法计算各指标耐低氮指数,通过主成分分析与聚类分析评价各基因型苦荞综合耐低氮能力。结果表明,低氮胁迫下,苦荞地上部生长受抑制程度大于根系,株高、茎粗、叶面积、地上部干重、根系体积、根系表面积及根系平均直径均呈下降趋势,主根长和根冠比呈上升趋势;根系活力、根系硝酸还原酶(NR)活性及可溶性蛋白含量有所下降,而根系超氧化物歧化酶(SOD)、过氧化物酶(POD)活性、丙二醛(MDA)、可溶性糖及游离脯氨酸含量有所升高;叶片叶绿素含量、Fm和Fv/Fm降低,而Fo升高;植株全氮含量及氮积累量降低,而由于植株氮积累量降幅明显大于生物量降幅,导致氮利用效率显著升高。将25个单项指标转化为4个相互独立的综合指标(累计贡献率达87.44%),并将9个苦荞基因型划分为耐低氮型、中间型和不耐低氮型。为了预测苦荞基因型的耐低氮能力,将D值作因变量,各指标耐低氮指数作自变量进行逐步回归分析,建立最优回归方程,筛选出株高、茎粗、叶面积、根冠比、叶绿素含量、Fm、根系超氧化物歧化酶(SOD)活性及氮利用效率8项对苦荞耐低氮能力有显著影响的指标,并且9个苦荞基因型的苗期耐低氮能力预测值Y与D值显著相关(R2=0.998,P<0.01),表明这8个指标可用于耐低氮苦荞基因型的快速鉴定。
苦荞;耐低氮能力;综合评价;回归分析
氮素不仅是植物所必须的首要元素,也是旱地土壤最易缺乏的营养元素之一,氮素亏缺直接影响作物的生命活动和产量[1-2]。土壤缺氮是造成我国黄土高原冷凉地区农业低产的主要原因,因此选择耐低氮能力强且适合当地环境条件的作物品种是解决当地农业可持续发展的重要途径。耐低氮胁迫和氮高效材料的筛选鉴定已成为品种选育的重要基础[3]。作物耐低氮品种的筛选已有很多报道[3-5],分苗期和全生育期筛选,其中苗期鉴定具有时间短、容量大、环境因素影响小等优点[4]。植株的农艺性状、根系特性及氮素的吸收和代谢特性、产量等均可作为作物耐低氮品种筛选的指标[3]。作物耐低氮特性是一个综合性状,单一指标无法全面反映植株对低氮胁迫的响应,因此需要采用多指标综合评价,目前,研究者多采用相关分析法、隶属函数法、主成分分析法等。
苦荞(Fagopyrum tataricum L.)不仅具有独特且丰富的营养价值及药用价值[6],还具有生育周期短、耐冷凉、耐瘠薄、适应性强等生理特性,在我国高寒和高原地区具有明显的区位优势和生产优势[7],是瘠薄地区的理想杂粮作物。目前,已有学者针对苦荞的营养和药用价值[5,8]、种质资源与栽培技术[9-10]、水分和矿质元素对苦荞生理及营养特性的影响[11-12]等开展了研究,但是低氮胁迫下苦荞的生物学响应及耐低氮品种鉴定和选育领域则少有研究。本研究通过水培试验,研究低氮胁迫下不同基因型苦荞幼苗生长、根系形态及生理特性等差异,并通过主成分分析和聚类分析对各品种苦荞的耐低氮能力综合评价,旨在探明耐低氮苦荞基因型的筛选指标,为苦荞耐低氮胁迫的生理机制研究提供依据。
1 材料与方法
1.1 供试材料
供试的9份苦荞材料分别是奇台农家种、迪庆苦荞、多元苦荞、云荞1号、西农9909、西荞1号、广苦1号、黔苦6号和黑丰1号,在山西适应性好,种植面积大,均由山西省农业科学院高寒作物研究所提供。
1.2 水培条件和氮处理
2016年5月至6月在山西师范大学塑料防雨棚内进行水培试验。选取饱满、均一且无病虫害的苦荞种子,经消毒、冲洗并浸泡后播于装有石英砂的育苗盆中。播后正常供应水分,生长到二叶一心时间苗;三叶一心时,挑选长势一致的健壮幼苗,用脱脂棉将其固定在泡沫塑料板上,孔穴间距为5 cm ×5 cm,每孔定植2株,并按品种移植入盆(110 cm× 35 cm×15 cm),每品种每盆20株,且各品种均处于2个不同的氮素环境中。移栽后在蒸馏水中过夜适应,第2天开始进行氮素水平处理,设置正常供氮(15 mmol L-1)和低氮胁迫(0.05 mmol L-1)两种处理。培养液为Hoagland营养液,配方略有修改,氮素供应形态为 NH4NO3,用 CaCl2代替 Ca(NO3)2,用K2SO4代替KNO3,营养液配方为CaCl2555.1 mg L-1、K2SO4435.7 mg L-1、MgSO4·7H2O 616.2 mg L-1、KH2PO4272.2 mg L-1、微量元素和铁盐同Hoagland营养液。每3 d换一次营养液,每天定时通气。
1.3 农艺性状和生理生化指标测定方法
培养20 d后达显蕾期,从各处理随机选取3株幼苗,用直尺测定株高,用游标卡尺测定茎粗,用LI-3000C便携式叶面积仪(成都科瑞达有限公司)测定叶面积;采用Delta-T SCAN根系分析系统(英国)测定主根长、根系体积、表面积及根系平均直径;将植株样品分成地上部和根系两部分,分别烘干后称重。
取样当天采用OS5P型叶绿素荧光仪(OPTI-SCIENCES,美国)测定叶片初始荧光(Fo)、最大荧光(Fm)及最大光化学效率(Fv/Fm),采用丙酮-乙醇直接浸提法[13]测定叶绿素含量,各项测定均用植株最上一片定型叶,均为3次重复。
按照常规方法[13]分别测定根系生化指标,其中用TTC法测定根系活力,分别用对氨基苯磺酸比色法之离体法、氮蓝四唑法和愈创木酚比色法测定硝酸还原酶(nitrate reductase,NR)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase, POD)活性,用硫代巴比妥酸法测定丙二醛(malonaldehyde,MDA)含量,分别用蒽酮比色法、考马斯亮蓝G-250染色法和酸性茚三酮法测定可溶性糖、可溶性蛋白和脯氨酸含量。根系活力及酶活性测定样品为根尖,MDA及渗透调节物质测定样品为距离根尖3~5 cm处根组织,以上所测指标均为3次重复。
采用凯氏定氮法[14]测定植株氮含量。氮积累量=植株干重×氮含量,氮利用效率=植株干重/植株氮积累量。
1.4 基因型耐低氮能力的评价方法
首先计算各指标的低氮处理相对值(Rx)及其隶属函数值(Zx)。
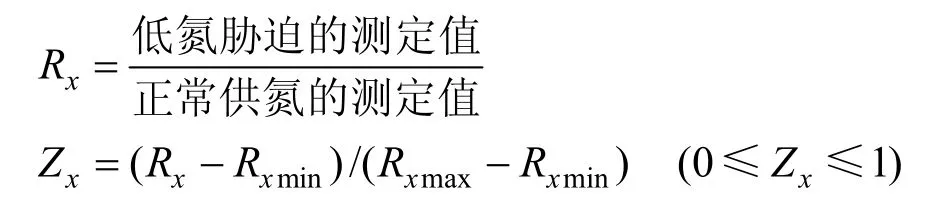
式中Rx为各指标的低氮处理相对值,隶属函数值Zx反映各指标的耐低氮指数,Rxmin、Rxmax分别为低氮处理值的最小值与最大值。然后,采用综合评价值(D)来评估不同苦荞基因型的耐低氮能力。
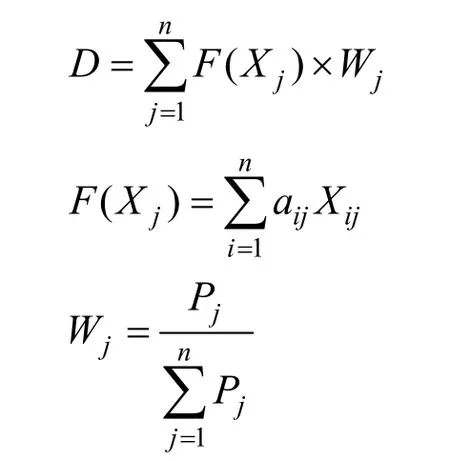
式中,F(Xj)为第j个综合指标值,Wj表示第j个综合指标的权重,aij为各单一指标的特征值所对应的特征向量,Xij为各单一指标的标准化处理值,Pj为第j个综合指标的方差贡献率,n为公式中所需求和的个数。
1.5 数据分析
采用Microsoft Excel 2007和SPSS 19.0软件进行生物统计与方差分析,并在此基础上进行主成分分析、聚类分析及回归分析。
2 结果与分析
2.1 低氮胁迫对不同基因型苦荞苗期相关农艺性状的影响
2.1.1 低氮胁迫对植株地上部生长的影响 与正常供氮相比,低氮条件下9个参试苦荞品种的株高、茎粗、叶面积均有所降低,且不同品种降幅存在差异(表1)。低氮胁迫下,西荞1号、广苦1号、黔苦6号和黑丰1号的株高均显著降低,其中黑丰1号降幅最大(37.5%);除奇台农家品种、黑丰1号外,其余苦荞品种在低氮胁迫条件下的茎粗与正常供氮相比差异均未达到显著水平,其中黑丰1号仍降幅最大,为14.5%。低氮胁迫使各苦荞幼苗的叶面积及茎叶干重均显著下降,降幅分别为17.1%~57.4%和17.5%~66.2%,低氮胁迫引起各指标的变化幅度为叶面积>茎叶干重>株高>茎粗,表明叶片对低氮条件更为敏感。
2.1.2 低氮胁迫对植株根系生长的影响 在低氮胁迫下,9个苦荞品种的根系均有所伸长(表2),为正常供氮的1.11~1.73倍,且除黑丰1号外,其余品种在低氮条件下的主根长与正常供氮相比均达到显著水平。低氮胁迫使各基因型苦荞的根系平均直径、根系体积和根表面积均降低,降幅分别为3.8%~ 37.1%、8.7%~46.2%和10.8%~41.7%,其中3个指标中降幅最大的2个品种均为西荞1号和黑丰1号。低氮胁迫对9个基因型根系干重的影响趋势不同,即低氮胁迫使奇台农家品种和迪庆苦荞的根系干重增加,而使其余品种的根系干重降低,说明低氮胁迫有使苦荞根系干重降低的趋势。低氮胁迫对苦荞地上部的影响远大于根系,进而导致根冠比在低氮环境下显著升高,其中黔苦6号增幅最大(94.7%),奇台农家种增幅最小(22.2%)。
2.2 低氮胁迫对不同品种苦荞苗期根系生理指标的影响
2.2.1 低氮胁迫对根系活力、酶活性及MDA含量的影响 低氮胁迫下,各基因型苦荞苗期的根系活力均呈下降趋势,其中,降幅以西荞1号>黑丰1号>黔苦6号,分别为46.8%、35.4%和24.4%,说明其根系活力对低氮胁迫较为敏感;而迪庆苦荞的降幅最小,仅为5.0%(表3)。
低氮胁迫下,各基因型苦荞的根系NR活性均显著下降,其中黑丰1号降幅最大,为51.8%,表明其根系NR活性对低氮胁迫最为敏感,其次为西荞1号和黔苦6号(表3)。
低氮胁迫使各基因型苦荞幼苗的根系SOD、POD活性升高(表3),其中根系SOD活性增幅较大的品种是迪庆苦荞(139.7%)、云荞1号(117.6%)与奇台农家品种(111.0%),根系POD活性增幅较大的品种是迪庆苦荞(37.2%)、奇台农家品种(24.3%)与广苦1号(19.8%),表明这些基因型在低氮环境中能保持较高的POD或SOD活性,具有减轻脂膜过氧化、维持细胞膜完整的优势,对低氮胁迫适应性较强。
低氮胁迫使苦荞根系MDA含量显著升高,9个苦荞品种根系MDA含量在正常供氮处理中为
8.79~11.86 nmol g–1,而在低氮处理中为11.12~15.11 nmol g–1(表3);以黑丰1号增幅最大(34.9%),表明其受MDA伤害较大。
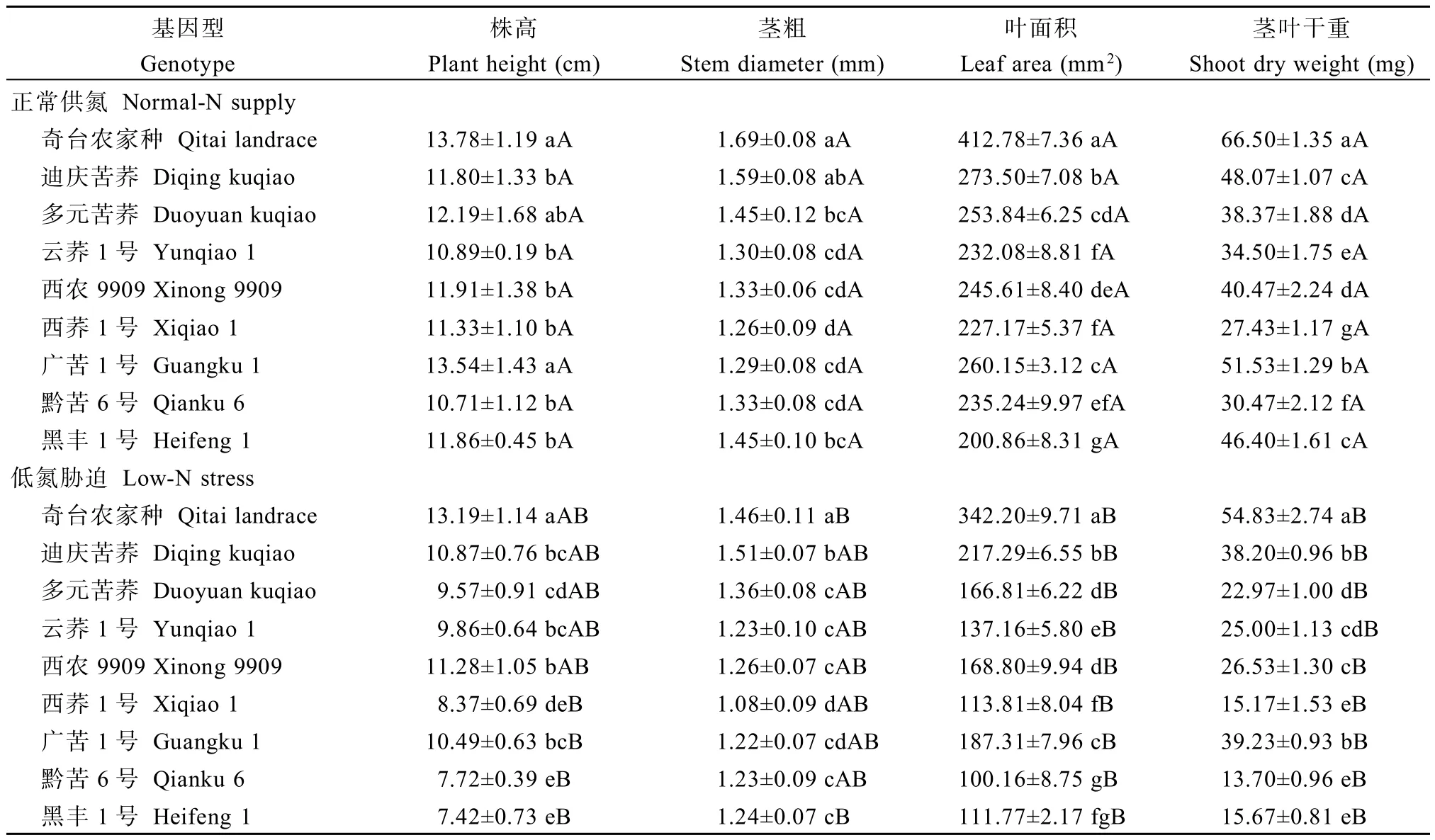
表1 低氮胁迫对不同品种苦荞幼苗地上部生长的影响Table 1 Effect of low-N stress on shoot growth at seedling stage in different Fagopyrum tararicum genotypes

表2 低氮胁迫对不同品种苦荞幼苗根系生长的影响Table 2 Effect of low-N stress on root growth at seedling stage in different Fagopyrum tararicum genotypes
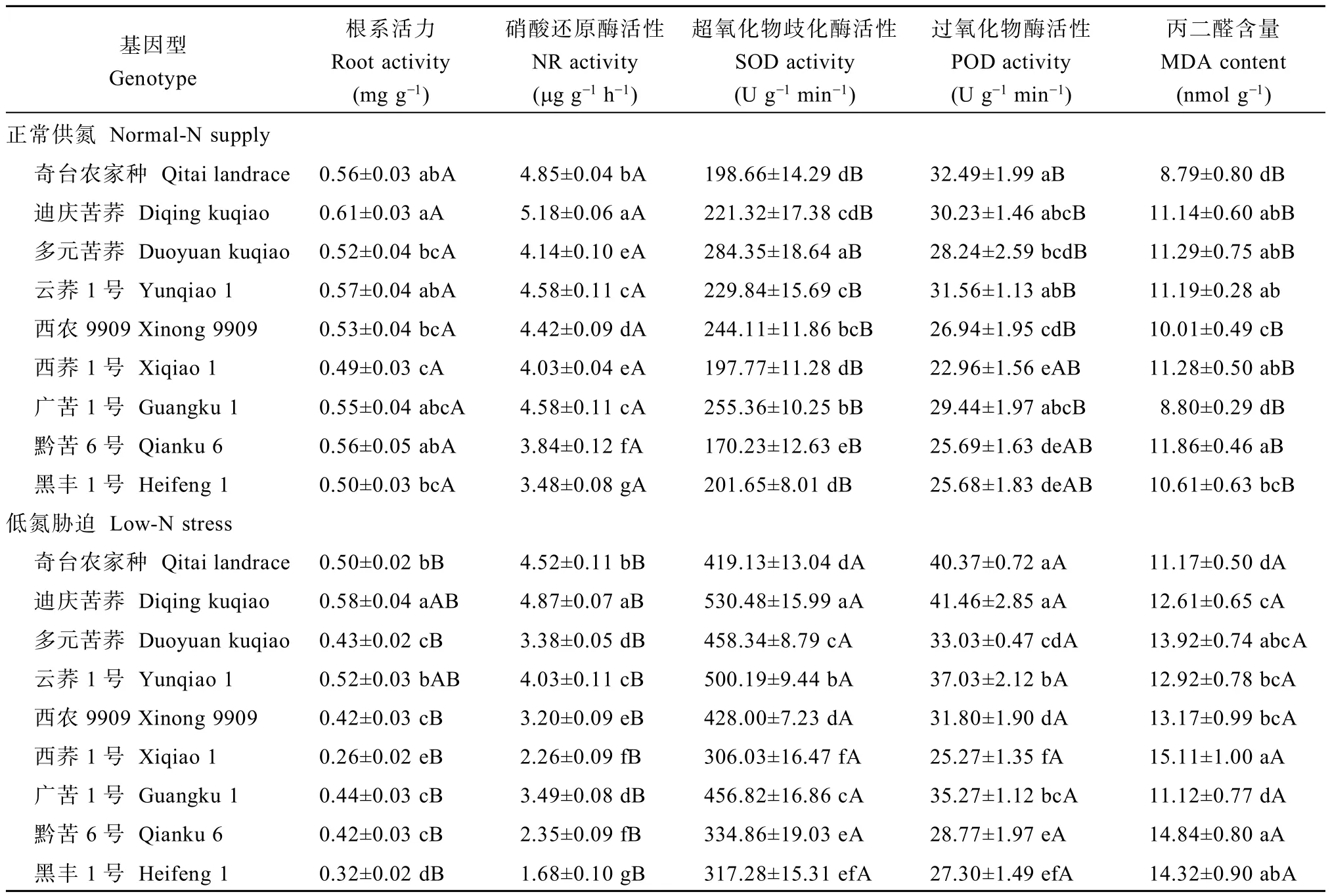
表3 低氮胁迫对不同品种苦荞幼苗根系活力、酶活性及MDA含量的影响Table 3 Effects of low-N stress on root activity,NR activity,enzyme activities,and MDA content in seedlings of different Fagopyrum tararicum genotypes
2.2.2 低氮胁迫对可溶性糖、可溶性蛋白及脯氨酸含量的影响 低氮胁迫使各基因型苦荞根系的可溶性糖和脯氨酸含量显著升高,可溶性蛋白含量显著降低(表4)。低氮胁迫下,根系可溶性糖含量增幅以迪庆苦荞>奇台农家品种>西农9909,分别是76.8%、45.3%和44.0%,而黑丰1号增幅最小,仅为12.5%;游离脯氨酸含量增幅以迪庆苦荞>奇台农家品种>云荞1号,分别为53.8%、43.2%和42.8%,而西荞1号增幅最小,仅为20.7%;可溶性蛋白含量的降幅为12.9%~55.5%,其中黑丰1号降幅最大而迪庆苦荞降幅最小。
2.3 低氮胁迫对不同苦荞品种苗期叶片叶绿素含量及荧光参数的影响
2.3.1 低氮胁迫对叶绿素的影响 低氮胁迫使各基因型苦荞的叶绿素含量显著降低,降幅为27.5%~ 59.2%;其中降幅以西荞1号>西农9909>黑丰1号,分别为59.2%、58.0%和57.5%,说明这些品种的叶片叶绿素含量对低氮胁迫较为敏感,而迪庆苦荞降幅最小,仅为27.5%(图1)。
2.3.2 低氮胁迫对荧光参数的影响 低氮胁迫使各基因型苦荞叶片的Fo升高,表明PSII反应中心失活,其中西荞1号的增幅最大,达到18.68%;低氮胁迫使苦荞幼苗叶片最大荧光(Fm)显著下降,降幅为19.1%~47.1%,其中黑丰1号降幅最大(图2)。最大光化学效率(Fv/Fm)降低表明植物体内发生了光合作用的抑制,低氮胁迫下各基因型苦荞幼苗叶片Fv/Fm显著降低,其中降幅较小的品种是黔苦6号(11.2%)和迪庆苦荞(12.8%),降幅较大的是黑丰1号(32.0%)和西荞1号(31.8%)。
2.4 低氮胁迫对不同品种苦荞全氮含量、氮积累量及氮利用效率的影响
低氮胁迫下各基因型苦荞的全氮量及氮积累量显著降低,而氮利用效率显著升高。正常供氮下,各基因型苦荞全氮含量为1.32~2.11 mg g-1,而低氮胁迫下是0.46~1.19 mg g-1;各基因型苦荞的氮积累量
降幅最大的品种是黑丰1号(85.4%),西荞1号与黔苦6号次之,而氮利用效率增幅最大的品种是西荞1号(184.7%),黑丰1号与多元苦荞次之(表5)。
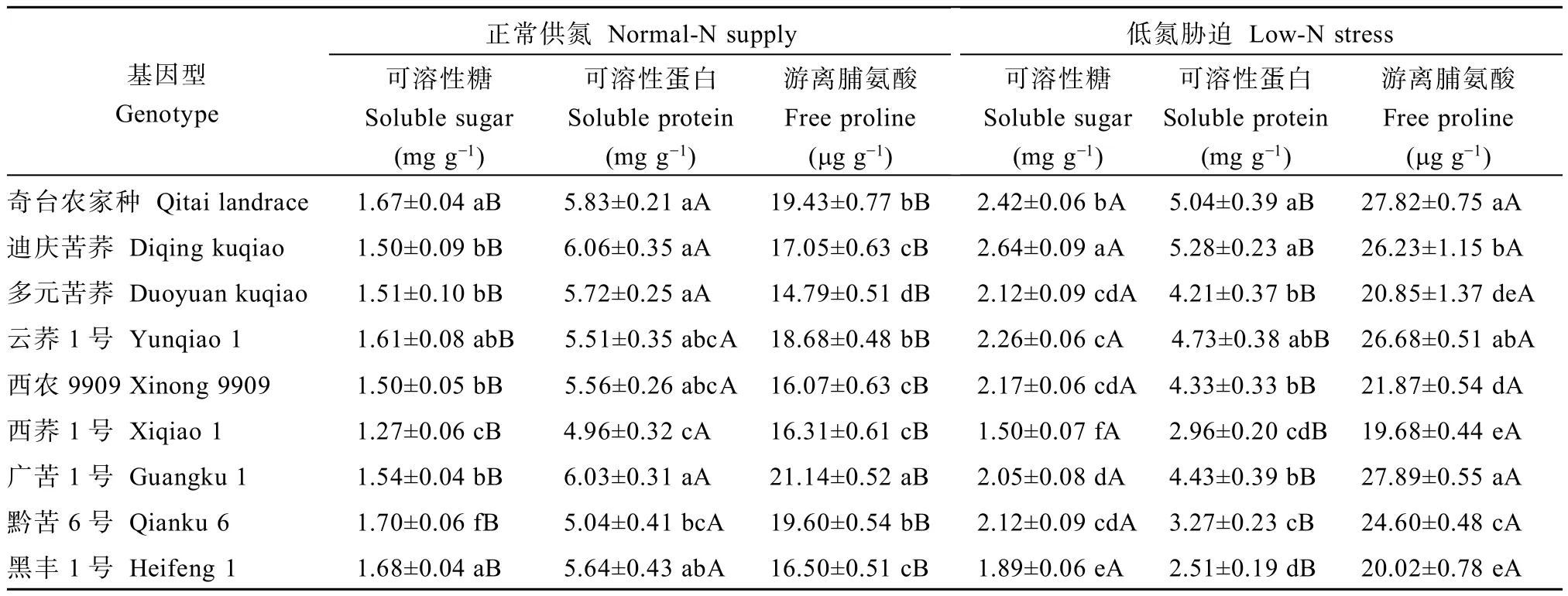
表4 低氮胁迫对不同品种苦荞幼苗根系渗透调节物质的影响Table 4 Effects of low-N stress on root soluble sugar,soluble protein and free proline contents in seedlings of different Fagopyrum tararicum genotypes

图1 低氮胁迫对不同品种苦荞幼苗叶片叶绿素含量的影响

(图2)

图2 低氮胁迫对不同品种苦荞幼苗叶片荧光参数的影响
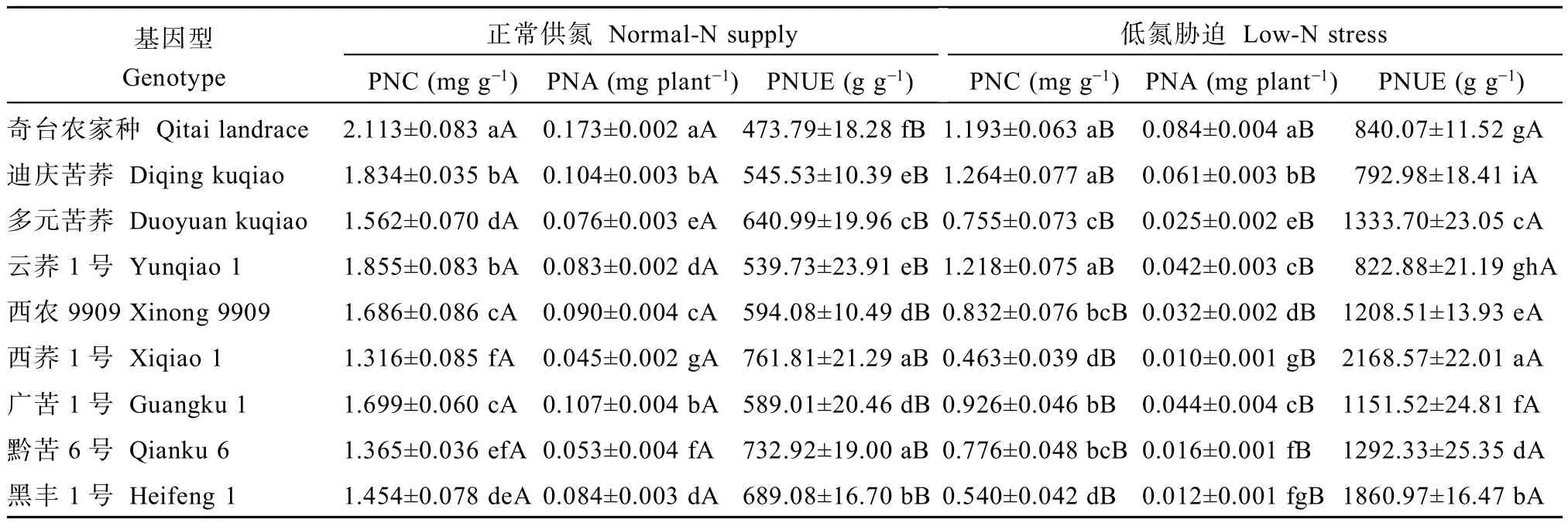
表5 低氮胁迫对不同苦荞品种苗期全氮含量、氮积累量及氮利用效率的影响Table 5 Effects of low-N stress on plant N content,N accumulation and N utilization efficiency in different Fagopyrum tararicum genotypes at seedling stage
2.5 主成分分析
2.5.1 各综合指标载荷系数及贡献率 对25个筛选指标的耐低氮指数进行主成分分析,前4个综合指标的方差贡献率分别为57.49%、20.29%、5.66%和4.01%,累计贡献率达87.44%,即这4个主因子可涵盖原始数据所提供的绝大部分信息(表6)。在第1主成分中,株高、叶面积、茎叶干重、根系表面积及根系体积、叶绿素含量、MDA、可溶性蛋白含量、全氮量、氮积累量及氮利用效率的载荷系数绝对值较大,说明该主成分反映的是植株地上部形态、部分根系形态生理特征、氮素吸收利用情况等信息;在第2主成分中,SOD及POD活性、可溶性糖及游离脯氨酸含量的载荷系数绝对值较大,说明该主成分主要反映的是根系脂膜过氧化作用及渗透调节等方面的信息;在第3主成分中,起主要作用的指标是茎粗、根系平均直径、Fo、Fv/Fm、根系活力及NR活性,说明该主成分反应的是叶片光合参数及部分根系酶活性的相关信息;在第4主成分中,起主要作用的指标是根系干重、根冠比及主根长,说明该主成分主要反映的是根系形态指标的相关信息。
2.5.2 各基因型苦荞的综合指标值、权重、D值及综合评价 迪庆苦荞的综合评价值(D值)最高,耐低氮能力最强;其他依次排序为奇台农家品种、云荞1号、广苦1号、多元苦荞、西农9909、黔苦6号、西荞1号和黑丰1号;黑丰1号的D值最低,说明其耐低氮能力最弱(表7)。
2.6 耐低氮基因型的筛选
采用欧氏距离平方法及系统聚类法对D值进行系统聚类,在欧氏距离5处可将9份苦荞聚成3类,即耐低氮型、中间型和不耐低氮型(图3)。耐低氮型为迪庆苦荞,中间型包括奇台农家品种、云荞1号、广苦1号、多元苦荞、西农9909和黔苦6号,不耐低氮型包括西荞1号和黑丰1号。
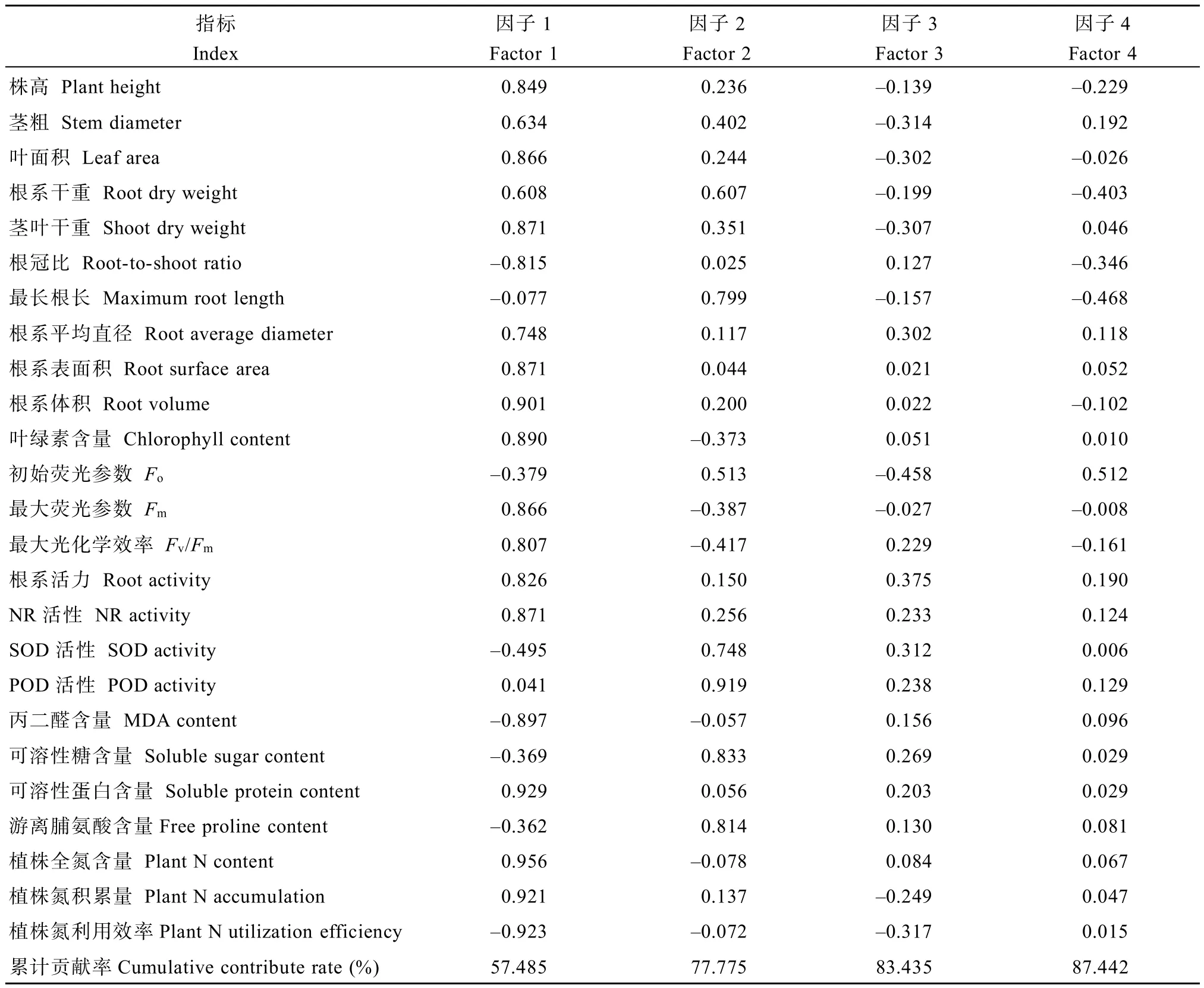
表6 各综合指标载荷系数及累计贡献率Table 6 Component matrix and cumulative contribution
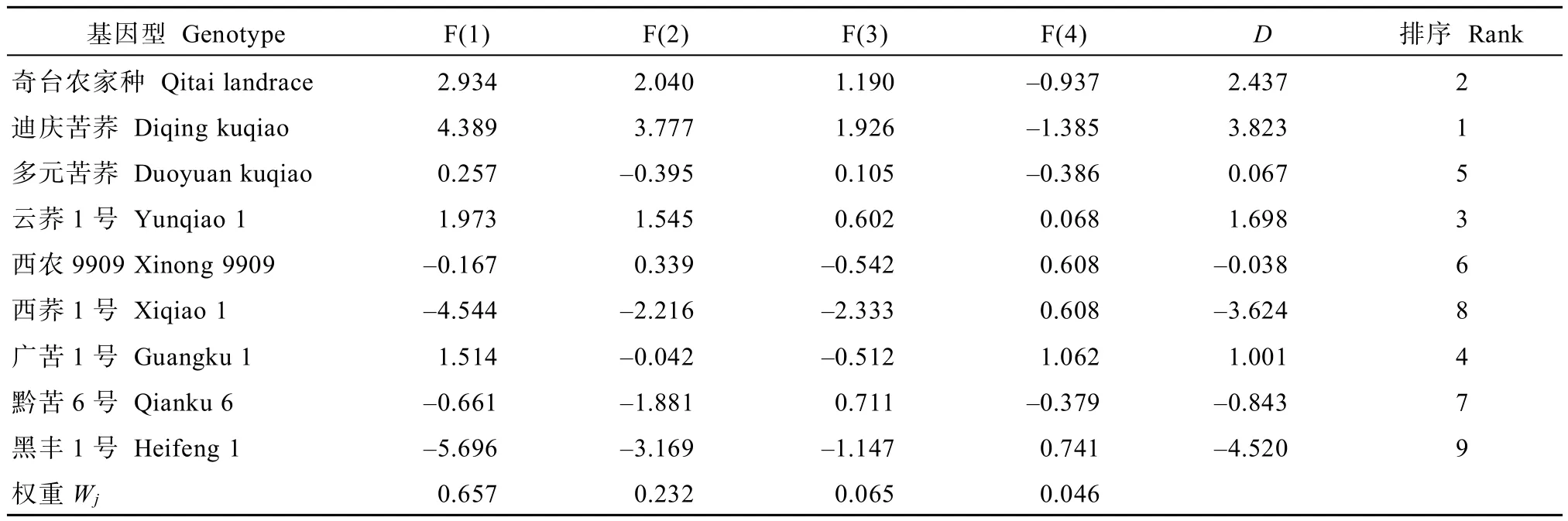
表7 苦荞基因型的综合指标值、权重、D值及综合评价Table 7 Principle component values and comprehensive indexs of low-N tolerance of different Fagopyrum tararicum genotypes
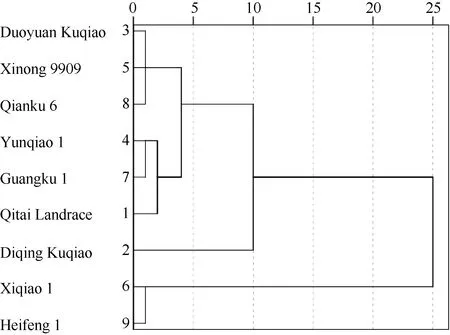
图3 9份不同基因型苦荞耐低氮能力的系统聚类图
Fig.3 Dendrogram of nine Fagopyrum tararicum genotypes based on low-N tolerance
2.7 苦荞耐低氮性鉴定指标的筛选
除茎粗、叶面积、根冠比、叶绿素含量、Fm及 Fv/Fm这6个指标外,综合评价值(D)与其余指标的相关性均达极显著水平(表8)。为建立耐低氮性评价的数学模型,把D值作因变量,各单项指标的耐低氮指数作自变量进行逐步回归分析,建立了最优回归方程,其R2=0.989。
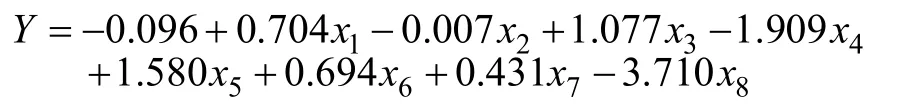
式中,Y为耐低氮综合评价值的预测值,x1~x8分别代表株高、茎粗、叶面积、根冠比、叶绿素含量、Fm、根系SOD活性及氮利用效率。9个苦荞基因型的耐低氮预测值Y与耐低氮测定评价值D的相关系数达到0.998(P <0.01),表明该方程具有一定的预测准确性和高效性。
3 讨论
3.1 苦荞苗期耐低氮形态及生理特性的差异与评价
选育耐低氮型品种是提高作物氮肥利用率、促进土壤缺氮地区农业生产的有效途径。研究表明,胁迫环境可导致植株形态学参数和生理生化参数改变[15-16]。例如,低氮胁迫下,植株地上部生长受抑制程度大于根部,植株氮积累量降低、氮利用效率明显升高等[16-17]。本试验结果表明,与不耐低氮苦荞基因型相比,耐低氮能力强的品种在低氮环境中表现为地上部生长受影响较小,株高、茎粗、叶面积及茎叶干重降幅较小;根系发达且根系吸收能力强,可维持较高的根系NR、SOD、POD活性和渗透压,能更好地适应低氮环境;具有较高的全氮含量和氮积累量,保证在低氮环境中有较高的氮素吸收量。研究发现,在低氮环境中,苦荞由于氮积累量的降幅明显大于其生物量的降幅,进而导致氮利用效率大幅度升高;此外,苦荞苗期氮素利用效率明显高于小麦[1,4-5]、玉米[3,16]、糜子[15]、谷子[17]等其他作物,说明苦荞在低氮环境能更加充分地利用氮素,这可能与其在低氮环境中根系发达、根系渗透调节物质含量较高有关。

表8 单个苦荞农艺性状、光合作用和生化特性相关指标与耐低氮综合评价值(D)的相关性Table 8 Correlations of the comprehensive value(D)for low-N tolerance with single agronomic traits and photosynthetic and biochemical parameters in Fagopyrum tararicum
3.2 筛选结果的评价
各苦荞基因型间的耐低氮能力存在差异,通过低氮胁迫可以筛选出耐低氮能力强的品种[3-5]。本试验最终选出迪庆苦荞为最耐低氮品种,奇台农家品种次之,二者均可作为黄土高原冷凉区等土壤缺氮地区的首选栽植品种;西荞1号、黑丰1号、黔苦6号等品种耐低氮能力较弱,生产上应该种植到土壤肥沃的土地上并应适当增加氮肥量。与不耐低氮品种相比,耐低氮苦荞品种在低氮环境中具有较高的氮积累量,且高氮素吸收与其根系的各形态及生理指标极显著相关;耐低氮苦荞品种在低氮环境中根系发达、根系活性及抗脂膜过氧化作用较强、根系渗透调节物质含量较高导致较高的氮素积累量,这是苦荞根系主要的耐低氮生理机制。
3.3 苦荞苗期耐低氮筛选指标体系
众多研究者进行了作物耐低氮基因型的筛选,但并未建立统一的评价体系。赵化田等[5]采用水培试验、球形检验和主成分分析法对小麦品种进行筛选;李强等[3]采用水培和盆栽试验、隶属函数法和主成分分析法对玉米进行品种筛选。本研究采用苗期水培的方式进行品种筛选,具有时间短、容量大、环境因素影响小等优点;试验测定指标不仅有苦荞的形态、生物量等,还包括苦荞生理指标,从而使试验数据信息更为充分;采用隶属函数法处理后的耐低氮指数作为筛选指标,能够消除不同基因型苦荞间固有的生物学和遗传学特性差异;采用主成分与系统聚类相结合的综合评价体系,能够更充分地对苦荞耐低氮能力进行评价;采用Pearson相关性分析和逐步回归分析,筛选出对苦荞耐低氮特性影响较为显著的指标,得出快速鉴别并预测苦荞耐低氮能力的最优回归方程。
4 结论
低氮胁迫下,苦荞苗期地上部受抑制程度大于根系,根系活力、NR活性、可溶性蛋白含量下降,而根系SOD和POD活性、MDA、可溶性糖、游离脯氨酸含量升高,植株氮积累量降低但氮素利用率升高。参试品种中迪庆苦荞耐低氮能力最强,奇台农家品种次之,可用作苦荞氮高效育种及黄土高原瘠薄土壤栽植的参考种质资源。株高、茎粗、叶面积、根冠比、叶绿素含量、Fm、根系SOD活性及氮利用效率8个指标可用于苦荞耐低氮特性的快速鉴定。
[1]张定一,张永清,杨武德,苗果园.不同基因型小麦对低氮胁迫的生物学响应.作物学报,2006,32:1349–1354
Zhang D Y,Zhang Y Q,Yang W D,Miao G Y.Biological response of roots in different wheat genotypes to low-N stress. Acta Agron Sin,2006,32:1349–1354(in Chinese with English abstract)
[2]Diaz C,Salibacolombani V,Loudet O.Leaf yellowing and anthocyanin accumulation are two genetically independent strategies in response to nitrogen limitation in Arabidopsis thaliana.Plant Cell Physiol,2006,47:74–83
[3]李强,罗延宏,谭杰,孔凡磊,杨世民,袁继超.玉米杂交种苗期耐低氮指标的筛选与综合评价.中国生态农业学报,2014, 22:1190–1199
Li Q,Luo Y H,Tan J,Kong F L,Yang S M,Yuan J C.Indexes screening and comprehensive evaluation of low nitrogen tolerance of hybrid maize cultivar at seeding stage.Chin J Eco-Agric,2014,22:1190–1199(in Chinese with English abstract)
[4]李春艳,张宏,马龙,李诚.冬小麦苗期氮素吸收利用生理指标的综合评价.植物营养与肥料学报,2012,18:523–530
Li C Y,Zhang H,Ma L,Li C.Comprehensive evaluation on physiological indices of nitrogen absorption and utilization in winter wheat at the stage.J Plant Nutr Fert,2012,18:523–530 (in Chinese with English abstract)
[5]赵化田,王瑞芳,许云峰,安调过.小麦苗期耐低氮基因型的筛选与评价.中国生态农业学报,2011,19:1199–1204
Zhao H T,Wang R F,Xu Y F,An D G.Screening and evaluating low nitrogen tolerant wheat genotype at seeding stage.Chin J Eco-Agric,2011,19:1199–1204(in Chinese with English abstract)
[6]Calderónmontaño JM,Burgosmorón E,Pérezguerrero C, López-Lázaro M.A review on the dietary flavonoid kaempferol.Mini Rev Med Chem,2011,11:298–344
[7]张雄,王立祥,柴岩,廖允成.小杂粮生产可持续发展探讨.中国农业科学,2003,36:1595–1598
Zhang X,Wang L X,Chai Y,Liao Y C.Sustainable development of minor crops in China.Sci Agric Sin,2003,36:1595–1598(in Chinese with English abstract)
[8]赵刚,唐宇,王安虎.苦荞麦的成分功能研究与开发应用.四川农业大学学报,2001,19:355–358
Zhao G,Tang Y,Wang A H.The function research and application development of the composition for tartary buckwheat.J Sichuan Agric Univ,2001,19:355–358(in Chinese with English abstract)
[9]侯雅君,张宗文,吴斌,李艳琴.苦荞种质资源AFLP标记遗传多样性分析.中国农业科学,2009,42:4166–4174
Hou Y J,Zhang Z W,Wu B,Li Y Q.Genetic diversity in tartary buckwheat revealed by AFLP analysis.Sci Agric Sin,2009,42: 4166–4174(in Chinese with English abstract)
[10]杨玉霞,吴卫,郑有良,王俊,李建,邬昌禄.苦荞品种(系)主要农艺性状与蛋白质含量的聚类分析.种子,2008,27(10): 30–34
Yang Y X,Wu W,Zheng Y L,Wang J,Li J,Wu C L.Cluster analysis of the mainly agronomic characters and the protein content on tartary uckwheat.Seed,2008,27(10):30–34(in Chinese with English abstract)
[11]Shi Y H,Zhang Y Q.Effect of seed soaking with rare earth on the seed germination and seeding growth of tartary buckwheat under different water conditions.Agric Sci Technol,2013,14:1237–1243
[12]田秀英,王正银.硒对苦荞产量、营养与保健品质的影响.作物学报,2008,34:1266–1272
Tian X Y,Wang Z Y.Effects of selenium application on yield and qualities for nutrition and health care in tartary buckwheat.Acta AgronSin,2008,34:1266–1272(inChinese with English abstract)
[13]张志良,翟伟菁,李小芳.植物生理学实验指导(第4版).北京:高等教育出版社,2009.pp 30–227
Zhang Z L,Zhai W J,Li X F.Experimental Instruction of Plant Physiology,4th edn.Beijing:Higher Education Press,2009.pp 30–227(in Chinese)
[14]鲍士旦.土壤农化分析(第2版).北京:中国农业出版社,1986. pp 213–216
Bao S D.Soil Agro-chemistrical Analysis,2nd edn.Beijing: China Agriculture Press,1986.pp 213–216(in Chinese)
[15]张美俊,乔治军,杨武德,冯美臣,肖璐洁,王冠,段云.不同糜子品种对低氮胁迫的生物学响应.植物营养与肥料学报, 2014,20:661–669
Zhang M J,Qiao Z J,Yang W D,Feng M C,Xiao L J,Wang G, Duan Y.Biological response of different cultivars of millet to low-N stress.J Plant Nutr Fert,2014,20:661–669(in Chinese with English abstract)
[16]谢孟林,李强,查丽,朱敏,程秋博,袁继超,孔凡磊.低氮胁迫对不同耐低氮性玉米品种幼苗根系形态和生理特征的影响.中国生态农业学报,2015,23:946–953
Xie M L,Li Q,Zha L,Zhu M,Cheng Q B,Yuan J C,Kong F L. Effects of low nitrogen stress on physiological and morphological traits of roots of different low nitrogen tolerance maize varieties at seeding stage.Chin J Eco-Agric,2015,23:946–953(in Chinese with English abstract)
[17]陈二影,杨延兵,秦岭,张华文,刘宾,王海莲,陈桂玲,于淑婷,管延安.谷子苗期氮高效品种筛选及相关特性分析.中国农业科学,2016,49:3287–3297
Chen E Y,Yang Y B,Qin L,Zhang H W,Liu B,Wang H L,Chen G L,Yu S T,Guan Y A.Evaluation of nitrogen efficient cultivars of foxtail millet and analysis of the related characters at seeding stage.Sci Agric Sin,2016,49:3287–3297(in Chinese with English abstract)
Screening Fagopyrum tararicum Genotypes Tolerant to Low Nitrogen Stress at Seedling Stage and Its Evaluating Indices
ZHANG Chu1,ZHANG Yong-Qing1,2,*,LU Zhi-Juan1,and LIU Li-Qin1
1College of Life Science,Shanxi Normal University,Linfen 041004,China;2College of Geographical Science,Shanxi Normal University,Linfen 041004,China
Nitrogen(N)deficiency is a major problem for agricultural production in the cold area of Loess Plateau.In this study, multiple indices of seedlings,including agronomic traits,physiological characteristics,and N utilization parameters,were measured in a hydroponics experiment with nine F.tararicum genotypes.The low-N tolerance was assessed by calculating subordinate function values,and making the comprehensive evaluation after principal component and clustering analyses.Under low-N stress,the restraint degree was greater for shoots than for roots.Compared with normal-N supply,low-N stress resulted in decreases of plant height,stem diameter,leaf area,shoot dry weight,root average diameter,root volume and root surface area and increases of main root length and root-to-shoot ratio.In addition,the root activity,nitrate reductase(NR)activity and soluble protein content decreased under low-N stress,whereas the activities of superoxide dismutase(SOD)and peroxidase(POD)as well as the contents of malonaldehyde(MDA),soluble sugar and free proline increased.The photosynthesis-related indices also changed under low-N stress,showing the decreases of leaf chlorophyll content,Fmand Fv/Fmand the increase of Fo.The plant N content and plant N accumulation decreased under low-N condition,however,the plant N utilization efficiency showed obvious increase,owing to the greater decline of N accumulation than that of plant biomass.The 25 single indices were converted into four independent comprehensive indices(accumulative contribution of 87.44%),with which the nine F.tararicum genotypes were classified into high-,medium-,and low-tolerance groups.An optimal equation was also set up to evaluate and predict low-Ntolerance of F.tararicum genotypes through stepwise regression with D value as the dependent variable and low-N tolerance index as the independent variable.Finally,eight indices,plant height,stem diameter,leaf area,root-shoot ratio,chlorophyll content,Fm,root activity and plant N utilization efficiency,were selected due to their significant impacts on low-N tolerance. These indices are recommended in quick by screening low-N tolerant F.tararicum genotypes.
Fagopyrum tararicum;Low nitrogen tolerance;Comprehensive evaluation;Regression analysis
(
):2017-01-18;Accepted(接受日期):2017-05-10;Published online(网络出版日期):2017-05-19.
10.3724/SP.J.1006.2017.01205
本研究由国家自然科学基金项目(31571604)资助。
This study was supported by the National Natural Science Foundation of China(31571604).
*通讯作者(Corresponding author):张永清,E-mail:yqzhang208@126.com
联系方式:E-mail:zhangchu0331@126.com
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20170519.1200.006.html
